花椒叶多酚提取物对白鲢咸鱼脂肪氧化及脂肪酸组成的影响
李君珂,刘森轩,刘世欣,崔保威,崔昱清,彭增起,*
(1.鲁东大学食品工程学院,山东烟台 264025;2.南京农业大学食品科技学院,江苏南京 210095)
花椒叶多酚提取物对白鲢咸鱼脂肪氧化及脂肪酸组成的影响
李君珂1,刘森轩2,刘世欣2,崔保威2,崔昱清2,彭增起2,*
(1.鲁东大学食品工程学院,山东烟台 264025;2.南京农业大学食品科技学院,江苏南京 210095)
将花椒叶多酚提取物添加于白鲢咸鱼中,研究加工过程中咸鱼脂肪酸组成变化,分析花椒叶提取物对脂肪氧化的影响规律。结果表明:花椒叶多酚提取物处理组的白鲢咸鱼在加工过程中总脂肪含量略有增加(p>0.05),游离脂肪酸所占比例有所下降(p<0.05)。与空白组比较,添加花椒叶提取物可以有效降低咸鱼的脂肪氧化水平,且随着花椒叶的添加量增多,过氧化值(POV)和硫代巴比妥酸值(TBARS)都显著下降(p<0.05),脂肪氧化水平降低。当添加量为0.03%时,能够有效控制白鲢咸鱼的脂肪氧化,并形成较好的风味、色泽和口感。
花椒叶提取物,白鲢咸鱼,脂肪氧化,脂肪酸组成
咸鱼在中国一直备受欢迎,不仅是由于风味独特、易于保存,而且鱼肉中含有丰富的多不饱和脂肪酸[1]。不饱和脂肪可以减少中风发病率、降血压、抗心血管病[2],但却易被氧化,而过多摄入脂肪氧化的产物也是衰老、心脏病、癌症和脑功能障碍的诱因。脂肪酸含量及成分因鱼的种类而有明显不同[3-4]。海水鱼中含有丰富的不饱和脂肪酸,对于淡水鱼脂肪酸组成研究较少[5]。脂肪水解产生游离脂肪酸,游离脂肪酸氧化形成醛、醇、酮、酸、烃类等挥发性化合物[6-7]。适度脂质氧化对咸鱼制品风味起积极作用,但是加工过程中出现的过度脂肪氧化会导致产品发黄出油,并对风味产生影响,是影响产品质量的主要原因之一[8]。
添加化学合成的抗氧化剂,如叔丁基对羟基茴香醚(BHA)、2,6 二叔丁基化羟基甲苯(BHT)、特丁基对苯二酚(TBHQ)等[9-10],作为控制脂肪氧化的手段之一,对于控制脂肪氧化效果明显。但是,这类抗氧化剂安全性备受质疑。近年来,关于天然的抗氧化剂的研究成为热点[11-13]。花椒叶作为我国传统的药食两用植物,其治疗哮喘、关节炎[14]的药用价值及花椒叶精油的抗虫活性[15]已有研究,Yang[16]对花椒叶多酚清除超氧阴离子能力及DPPH自由基能力进行报道,Li[17]对花椒叶提取物提高白鲢咸鱼加工过程中的抗氧化酶活性也进行研究。本实验研究白鲢咸鱼的加工过程中脂肪酸的变化过程,并将提取的花椒叶多酚物质用于白鲢咸鱼加工,了解和掌握咸鱼加工过程中脂肪氧化的变化特点,分析花椒叶提取物对脂肪氧化影响的规律。
1 材料与方法
1.1 材料与仪器
花椒叶 于2013年8月采于山西省太原市;白鲢 购于卫岗农贸市场,平均重约1.5 kg;37种脂肪酸标准品(1 mg/mL)、氯仿、乙酸、乙醚、异丙醇、2,2-二甲氧基丙烷、甲醇、异丙醇、三氟化硼-甲醇、正已烷(色谱纯)、4-甲基伞形酮、4-甲基伞形酮油酸酯、HCl、1,1,3,3-四乙氧基丙烷、硫代巴比妥酸、氟化钠、EGTA、Triton-100、牛血清蛋白、磷酸氢二钠、柠檬酸等。
中草药粉碎机 河北省黄骅科学仪器厂;KQ2200DE型超声波清洗机 昆山市超声仪器有限公司;RE52-86A旋转蒸发仪 上海亚荣生化仪器厂;BY型恒温恒湿箱 宝元通仪器设备公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器有限公司;IKAT18basic型高速分散机 德国IKA;DU 730型紫外-可见分光光度计 美国Beckman Coulter有限公司;DC-12H型氮吹仪 上海安谱科学仪器有限公司;Allegra 64R型高速冷冻离心机 美国BECKMAN COULTER公司;Spectra Max M2e酶标仪 美国分子仪器公司;TRACE GC Ultra气相色谱仪 美国Thermo。
1.2 实验方法
1.2.1 花椒叶多酚提取物的制备 按照Li[17]的方法,将花椒叶洗净烘干、粉碎,过40目筛,得到的花椒叶置于干燥器中。用65%乙醇溶于花椒叶粉末,超声波提取花椒叶多酚,100 W、15 min,并用石油醚萃取脂溶性色素等,冷冻干燥,得到花椒叶粗提物干燥粉末。花椒叶粗提物通过D101大孔吸附树脂进行分离纯化,再次冷冻干燥,最终得到花椒叶多酚提取物。
1.2.2 白鲢预处理 将白鲢去除腮、鳞和内脏,自来水冲洗干净,放在架子上于4 ℃环境中晾15 min,将白鲢鱼分四组,添加4%(w/w)食盐涂抹在鱼的表面。一组作为空白对照,另外三组,分别于鱼的表面添加0.015%、0.030%和0.045%(w/w)花椒叶多酚提取物(w/w)并进行涂抹,于4 ℃、85%~90%湿度(RH)环境下放置2 d;取出后放入恒温恒湿箱,17 ℃、85%湿度(RH)放置2 d;19 ℃、82%湿度(RH)放置2 d;21 ℃、79%湿度(RH)放置2 d,成品。
抽样工艺点:原料、第2 d(腌制2 d结束)、第4 d(干燥2d)、第6 d(干燥4d)、第8 d(干燥6 d,终点)的每个工艺点取样,在背侧肌取3个肉块,共51个肉块,真空包装,-20 ℃条件下贮存备用。
1.3 测定方法
1.3.1 脂质氧化指标测定
1.3.1.1 硫代巴比妥酸值(TBARS) 参照Salih[18]方法,称取5 g空白样品和三个添加花椒叶提取物的处理组样品分别置于离心管中,加入25 mL 20% TCA和20 mL H20,在冰水浴中以3000 r/min转速匀浆60 s,静置1 h,继续在4 ℃、2000×g的条件下离心10 min后过滤,滤液用双蒸馏水定容到50 mL,最后取2 mL滤液于试管中,加入2 mL TBA(0.02 mol/L)混合均匀,沸水浴中反应20 min,冷却至室温,用紫外-可见分光光度计测定532 nm的吸光度,空白样:不加入肉样步骤如上所述。TBARS值表示为mg丙二醛(MDA)/kg肌肉。
1.3.1.2 过氧化值(POV) 按照GB/T5009.37-2003《食用植物油卫生标准的分析方法》测定。
1.3.2 总脂肪提取 取少许样品5 g,剔除鱼刺,将样品剪成2 mm×2 mm×2 mm大小的碎肉,精确称取一定量处理好的样品,按照Folch[19]的方法提取。总脂肪含量通过称量得出,表示为g/100 g样品。
1.3.3 脂质分离 参照Kaluzny[20]的方法,称取100.0 mg脂质,先用1.0 mL氯仿将其溶解,随后进氯仿活化的氨丙基硅胶小柱进行吸附分离,依次用3.0 mL氯仿-异丙醇(2∶1)、3.0 mL的2%乙酸-乙醚溶液和3.0 mL的甲醇溶液进行洗脱,分别得到中性脂肪、游离脂肪酸和磷脂洗脱液,最后将所得三种洗脱液用氮吹仪吹干。
1.3.4 游离脂肪酸测定及气相色谱(GC)分析 将游离脂肪酸甲酯化,进行气相色谱(GC)分析:色谱柱:CP-Sil88 FAME柱子(50 m×0.25 mm×0.2 μm);升温程序:初温90 ℃保持2 min,然后以10 ℃/min的速度升至180 ℃平衡5 min,随后以5 ℃/min的速度升至240 ℃维持12 min;载气为高纯氮气流速为1 mL/s;分流比1∶70;进样量:1 μL,进样口温度为240 ℃;火焰离子监测器(FID)检测温度为240 ℃。
1.3.5 感官评定 将两组咸鱼蒸熟,由10位受过训练的评定人员对咸鱼的色泽、风味、口感3个指标采用5分制进行嗜好程度感官评定,评定时成员之间单独进行且互不交流,样品评定之间用清水漱口。色泽:根据鱼的黄度和亮度,1表示发黄发暗色泽差,5表示具有鲜艳的色泽;风味:根据咸鱼的香气、味道,1表示有哈喇味、异味,不喜欢,5表示具有咸鱼特有香味非常喜欢;口感:根据咀嚼时鱼肉的硬度,1表示过软或过硬,5表示硬度适中。
1.4 统计分析
数据统计采用SAS 8.2(SAS Institute Inc.,Cary,North Carolina,USA)进行ANOVA单因素方差分析及Ducan’s多重检验(p<0.05),数值以均值±标准差来表示。
2 结果与讨论
2.1 白鲢咸鱼加工过程中氧化的变化
2.1.1 白鲢咸鱼加工过程中POV值的变化 POV主要是评价脂质初级氧化产生氢过氧化物的量,它们作为重要的风味前体物质,很容易被进一步氧化形成醛、酮、酸和氨基酸等化合物。
由图1看出,整个加工过程中,空白组和处理组的POV值都是先升高再降低。可见,POV最大值出现在加工6 d时,之后由于氢过氧化物的进一步氧化,造成POV值的下降。
其中,添加花椒叶提取物的处理组POV值显著低于空白组(p<0.05),且随着添加量的增多而减少。而添加0.030%和0.045%花椒叶提取物的处理组在终产品时的POV值相差0.17 mmol/kg muscle,差异不显著(p>0.05),说明添加0.030%和0.045%花椒叶提取物的这两组白鲢咸鱼的初级氧化产物值差异不显著。
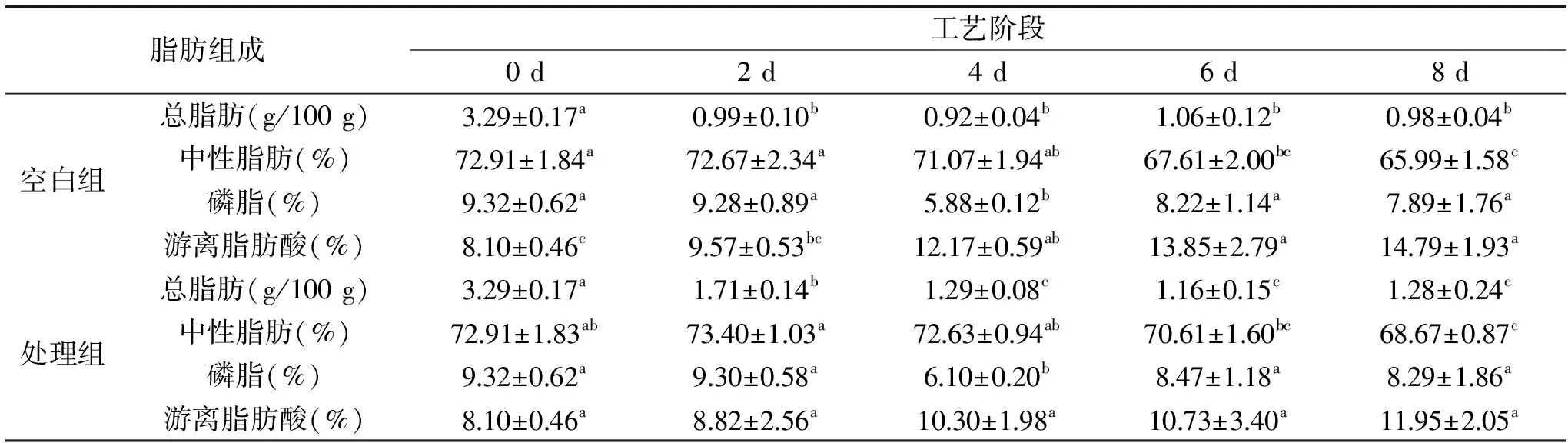
表1 白鲢咸鱼加工过程中总脂肪和脂肪组成的变化
注:
注:同行间标不同字母为差异显著(p<0.05),中性脂肪、磷脂和游离脂肪酸表示为所占总脂肪的百分比%。
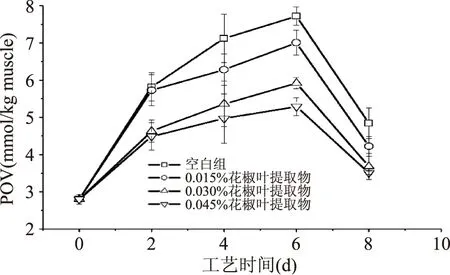
图1 白鲢咸鱼加工过程中POV值的变化Fig.1 POV value of different salted fishtreatments during processing
2.1.2 白鲢咸鱼加工过程中硫代巴比妥酸值(TBARS)的变化 根据图1看出加工过程中POV值先增加后降低,由此可以推断咸鱼的挥发性风味化合物在盐腌阶段就开始快速形成。从氧化角度考虑,加工过程中POV最大值点的出现要先于TBARS值,因为POV主要是评价脂质初级氧化产生氢过氧化物的量,而TBARS是评价脂质二次氧化产生的以丙二醛(MDA)为代表的醛类化合物的量。由图2可以看出,随着加工时间的延长,TBARS值呈增长趋势,说明脂肪氧化是发生在整个加工过程中的,同时也说明POV最大值先于TBARS值出现。
其中空白组没有添加花椒叶提取物,TBARS值增长明显。添加0.015%的处理组,TBARS值也呈上升趋势,但是TBARS值明显低于空白组(p<0.05),而添加0.030%和0.045%的处理组,其TBARS值上升缓慢,终产品时添加0.030%和0.045%的处理组的TBARS值分别为0.29、0.28 mg MDA/kg muscle,两组数值差异不明显(p>0.05)。
通过图1和图2看出,添加花椒叶提取物可以有效降低咸鱼的脂肪氧化水平,这是由于花椒叶中含有绿原酸、金丝桃和槲皮苷等多酚物质[17],起到抗氧化的作用。且随着花椒叶的添加量增多,脂肪氧化水平降低。而添加0.030%和0.045%的咸鱼处理组的初级氧化产物和二级氧化产物差异并不明显(p>0.05),因此从节约、方便的角度考虑,后面的实验选用不添加花椒叶提取物的空白组和添加0.030%花椒叶提取物的处理组进行研究。

图2 白鲢咸鱼加工过程中TBARS的变化Fig.2 TBARS value of different salted fishtreatments during processing
2.2 白鲢咸鱼加工过程中脂肪组成变化
白鲢咸鱼空白组及处理组在加工过程中总脂肪和脂肪组成的变化见表1,随着加工过程的进行,空白组总脂肪含量呈降低趋势,然后在第6 d的时候略有升高又减低,最后脂肪含量达到0.98 g/100 g;处理组的总脂肪总体也是下降趋势,后略有升高,最后脂肪含量达到1.28 g/100 g,可见花椒叶提取物对咸鱼样品的脂肪起到了保护作用。空白组和处理组的中性脂肪组成比例都呈下降趋势,磷脂的组成比例呈现先下降后上升的趋势,这是由于磷脂含有较多长链的多不饱和脂肪酸,这些脂肪酸在加工条件下极易被氧化,所以出现先下降趋势,与中性脂肪相比其更容易接触到细胞水相中的脂肪酶等催化剂[21],但最终的组成比例低于原料鱼中的比例。可见中性脂肪和磷脂在加工过程中都发生水解,而处理组由于添加花椒叶多酚提取物抑制了氧化速度,其中性脂肪和磷脂所占比例略有升高。
游离脂肪酸是脂质分解与氧化重要的中间物质,它的含量是一个动态过程。空白组和处理组的游离脂肪酸所占比例随着加工时间的延长而增大,这表明在加工过程中其生成的速率大于氧化分解的速率。
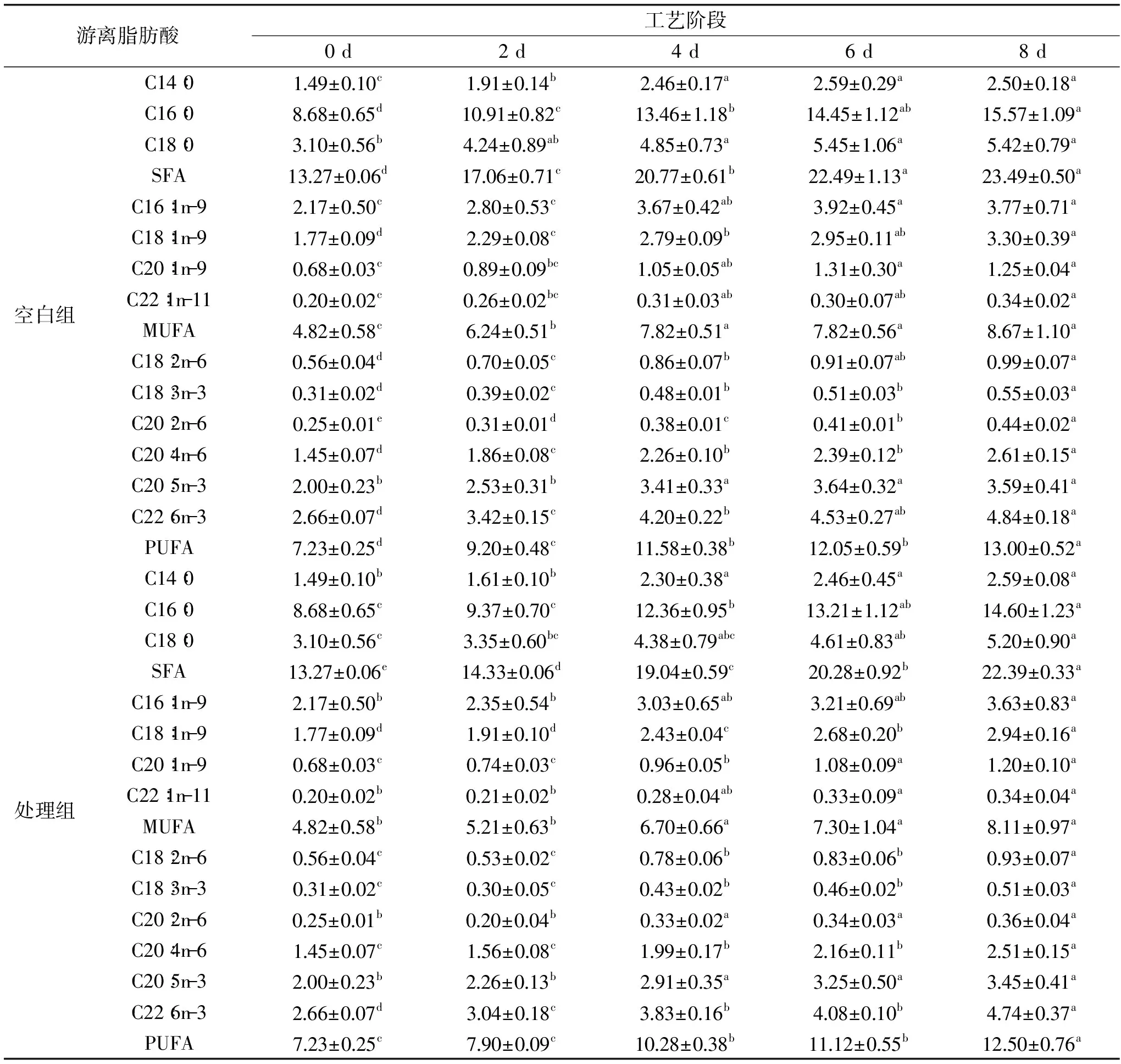
表2 游离脂肪酸组成在加工过程中的变化
注:
注:同行间标不同字母为差异显著(p<0.05),表中数据单位为mg/g脂肪。
2.3 白鲢咸鱼加工过程中游离脂肪酸组成的变化
表2为加工过程白鲢咸鱼游离脂肪酸的变化情况。游离脂肪酸发生较大变化,其中空白组除豆蔻酸(C14∶0)、硬脂酸(C18∶0)、棕榈酸烯甲酯(C16∶1n-9)、二十碳烯酸甲酯(C20∶1n-9)和二十碳五烯酸(EPA)呈先升高又略有下降趋势之外,其他饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸均呈递增的趋势,这与青鱼在干燥期间游离脂肪酸变化的规律是一致的[22]。虽然在加工过程中,白鲢咸鱼的总脂肪含量是逐渐降低的,且TBARS值是显著上升的(p<0.05),而游离脂肪酸含量确是在显著增加(p<0.05),主要原因是在这一阶段脂质分解产生脂肪酸的速度要大于脂肪酸氧化形成二级氧化产物的速度。饱和脂肪酸含量最高,约占原料鱼肉中游离脂肪酸的52.41%,其中棕榈酸(C16∶0)含量最高;多不饱和脂肪酸含量高于单不饱和脂肪酸含量。而在多不饱和脂肪酸中,二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)含量最高,分别占多不饱和脂肪酸含量的25.32%和36.79%,其中DHA的增加来源于磷脂的部分水解,EPA和DHA的含量变化趋势与之前Takiguchi[23]报道一致。处理组的各成分含量比空白组略低。而在终点阶段的处理组的游离脂肪酸中的多不饱和脂肪酸和饱和脂肪酸略低于空白组。
2.4 感官评定
由感官评定的结果来看,空白组和处理组的色泽和风味具有显著性差异(p<0.05)。花椒叶多酚提取物处理组的色泽,比空白组色泽高7.99%,可能是由于花椒叶提取物能够有效控制脂肪氧化,改善脂肪过度氧化引起的发黄现象。同理,花椒叶多酚提取物处理组的风味得分高空白组12.10%,原因可能也是由于花椒叶多酚抗氧化的作用,同时花椒叶本身作为调味料也赋予鱼肉香味。由图3看出,空白组和处理组的口感没有差异显著(p>0.05),说明添加花椒叶多酚提取物,对白鲢咸鱼的口感并无影响。
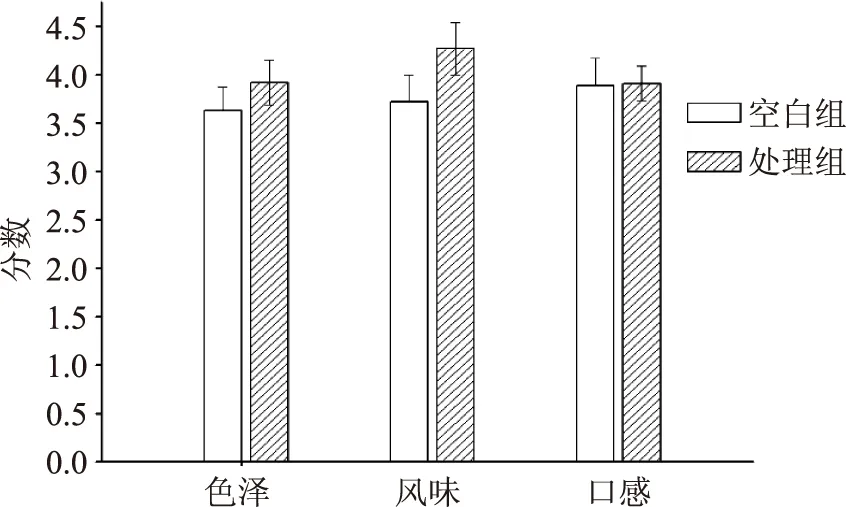
图3 不同组白鲢咸鱼感官评定的比较Fig.3 Comparison of the sensory resultsbetween different groups of salted fish
3 结论
花椒叶多酚提取物处理组的白鲢咸鱼在加工过程中总脂肪含量相对于空白略有增加(p>0.05),游离脂肪酸所占比例相对于空白有所下降(p<0.05)。与空白组比较,添加花椒叶提取物可以有效降低咸鱼的脂肪氧化水平,且随着花椒叶的添加量增多,过氧化值(POV)和硫代巴比妥酸值(TBARS)都显著下降(p<0.05)。当添加量为0.030%时,能够有效控制白鲢咸鱼的脂肪氧化,并形成较好的风味、色泽和口感。
[1]Siddaiah D,Vidya Sagar Reddy G,Raju C V,et al. Changes in lipids,proteins and kamaboko forming ability of silver carp(Hypophthalmichthys molitrix)mince during frozen storage[J]. Food Research International,2001,34:47-53.
[2]孙翔宇,高贵田,段爱莉,等. 多不饱和脂肪酸的研究进展[J]. 食品工业科技,2012,33(7):418-423.
[3]Eboh L,Mepba H D,Ekpo M B. Heavy metal contaminants and processing effects on the composition,storage stability and fatty acid profiles of five common commercially available fish species in Oron Local Government[J]. Nigeria Food Chemistry,2006,97:490-497.
[4]代鸣,姚俊杰,侯俊利,等. 黄颡鱼和大鳍鳠肌肉及鱼卵中脂肪酸组成的比较[J]. 食品工业科技,2009,30(6):282-285.
[5]罗永康. 7 种淡水鱼肌肉和内脏脂肪酸组成的分析[J]. 中国农业大学学报,2001,6(4):108-111.
[6]Coutron-Gambotti C,Gandemer G. Lipolysis and oxidation in subcutaneous adipose tissue during dry-cuerd ham poreessing[J].Food Chemistry,1990(64):95-101.
[7]Ordónez J A,Hierro E M,Bruna J M,et al. Changes in the components of dry-fermented sausages during ripening[J]. Critical Reviews in Food Science and Nutrition,1999,39(4):329-367.
[8]Lauritzsen K,Martinsen G,Olsen R L. Copper induced lipid oxidation during salting of cod(GadusmorhuaL.)[J]. Journal of Food Lipids,1999,6:299-315.
[9]李书国,赵文华,陈辉. 实用油脂抗氧化剂及其安全性研究进展[J]. 粮食与油脂,2006(5):34-37.
[10]Juntachote T,Berghofer E. Antioxidative properties and stability of ethanolic extracts of holy basil and galangal[J]. Food Chemistry,2005,92:193-202.
[11]Juntachote T,Berghofer E,Siebenhandl S,et al. The effect of dried galangal powder and its ethanolic extracts on oxidative stability in cooked ground pork[J]. LWT-Food Science and Technology,2007,40:324-330.
[12]Iglesias J,Pazos M,Torres J M,et al. Antioxidant mechanism of grape procyanidins in muscle tissues:Redox interactions with endogenous ascorbic acid and α-tocopherol[J]. Food Chemistry,2012,134:1767-1774.
[13]Abdelkader B,Yilmaz U,Badis B,et al. Effect of the icing with thyme,oregano and clove extracts on quality parameters of gutted and beheaded anchovy(Engraulisencrasicholus)during chilled storage[J]Food Chemistry,2014,145:681-686.
[14]Tang W,Xie Q,Guan J,et al. Phytochemical profiles and biological activity evaluation ofZanthoxylumbungeanumMaxim seed against asthma in murine models[J]Journal of Ethnopharmacology,2014,152,444-450.
[15]Wang C Y,Yang K,Zhang H M,et al. Components and Insecticidal Activity against the Maize Weevils of Zanthoxylum schinifolium Fruits and Leaves[J]Molecules,2011,16,3077-3088.
[16]Yang L C,Li R,Tan J,et al. Polyphenolic composition of the leaves of Zanthoxylum bungeanum Maxim. grown in Hebei China and their radical scavenging activities[J]. Journal of Agricultral and Food Chemisty,2013,61(8),1772-1778.
[17]Li J K,Wang F L,Li S,et al. Effects of pepper(Zanthoxylum bungeanum Maxim.)leaf extract on the antioxidant enzyme activities of salted silver carp(Hypophthalmichthys molitrix)during processing[J]. Journal of Functional Food,2014,DOI:10.1016/j.jff.2014.07.018.
[18]Salih A M,Smith D M,Priee J F,et al. Modifiedextraetion2-thiobarblturic acid rnethod for measuring lipid oxidation in Poultry[J]. Poultry Science,1987,66(9):1483-1488.
[19]Folch J,Lees M,Sloane-Stanley G. A simple method for the isolation and purification of total lipids from animal tissues[J]. The Journal of Biological Chemistry,1957,226(1):497-509.
[20]Kaluzny M,Duncan L,Merritt M,et al. Rapid separation of lipid classes in high yield and purity using bonded phase columns[J]. Journal of Lipid Research,1985,26(1):135-140.
[21]周光宏,徐幸莲.肉品学[M].北京:中国农业科技出版社,1999.
[22]Azad Shah A K M,Tokunaga C,Kurihara H,et al. Changes in lipids and their contribution to the taste of migaki-nishin(dried herring fillet)during drying[J]. Food Chemistry,2009,115:1011-1018.
[23]Takiguchi A. Effects of smoking on lipid oxidation in niboshi and niboshi powder[J]. Nippon Suisan Gakkaishi,1988,54:869-874.
Effect ofZanthoxylumbungeanumMaxim. leaf extract on the lipid oxidation and fat acid composition of salted silver carp
LI Jun-ke1,LIU Sen-xuan2,LIU Shi-xin2,CUI Bao-wei2,CUI Yu-qing2,PENG Zeng-qi2,*
(1.College of Food Engineering,Ludong University,Yantai 264025,China;2.College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
The effect ofZanthoxylumbungeanumMaxim. leaf(ZML)extract on fat composition of salted silver carp was measured during the processing time,and the effect of ZML extract on lipid oxidation of salted silver carp was indicated. Results showed that the treatment salted fish had higher lipid content than control(p>0.05)and lower free fatty acid percent(p<0.05). With the growing addition of extract,the peroxide value(POV)and thiobarbituric acid reactive substances(TBARS)values were decreased rapidly(p<0.05). An amount of 0.03% extract could inhibit the oxidation of salted fish and form excellent flavor,good color,lustre,and taste.
ZanthoxylumbungeanumMaxim. leaf extract;salted silver carp;lipid oxidation;fat composition
2014-09-22
李君珂(1985-),女,博士研究生,研究方向:水产品加工,E-mail:junjunke@163.com。
*通讯作者:彭增起(1956-),男,博士,教授,研究方向:畜产品加工与质量控制,E-mail:zqpeng@njuau.edu.cn。
现代农业产业技术体系建设专项(nycytx-38)。
TS251.5
A
1002-0306(2015)15-0109-05
10.13386/j.issn1002-0306.2015.15.015

