Y染色体微缺失类型与睾丸活检组织病理分型相关性分析*
刘兴章 唐运革郑立新 王奇玲 邓顺美 周冰燚 刘 晃 李铭臻广东省计划生育科学技术研究所(广州 510600)
Y染色体微缺失类型与睾丸活检组织病理分型相关性分析*
刘兴章 唐运革**郑立新 王奇玲 邓顺美 周冰燚 刘 晃 李铭臻
广东省计划生育科学技术研究所(广州 510600)
摘要目的 研究无精子症及严重少精子症患者Y染色体微缺失的缺失类型与睾丸活检组织学类型的关系。方法 收集来我院就诊的病因诊断为Y染色体微缺失的无精子症及严重少精子症患者的完整睾丸活检病理报告。根据Y染色体微缺失区域类型,将研究对象分为A缺失组、B缺失组、B/C/D联合缺失组和C/D联合缺失组。分析Y染色体微缺失的缺失类型与睾丸活检组织学类型、睾丸体积、卵泡刺激素、黄体生成素之间的关系。结果 在254例Y染色体微缺失患者中,各缺失组之间睾丸活检组织学类型存在统计学差异(P<0.01)。A缺失组有66.7% (14/21)为唯支持细胞综合征和28.6%(6/21)为成熟停滞;B缺失组有9.7%(3/31)为唯支持细胞综合征和90.3% (28/31)为成熟停滞;B/C/D联合缺失组有44.4%(28/63)为唯支持细胞综合征和52.4%(33/63)为成熟停滞;C/D联合缺失33.1%(46/139)为唯支持细胞综合征和有51.8%(72/139)为成熟停滞。成熟精子总检出率9.4% (24/254)。各缺失组之间血清卵泡刺激素存在统计学差异(P<0.01)。各缺失组之间在睾丸体积、黄体生成素水平之间比较无统计学差异性(P>0.05)。结论 Y染色体微缺失患者中,不同缺失类型之间睾丸活检组织学类型存在差异。AZFa缺失类型主要表现为唯支持细胞综合征,AZFb缺失类型主要表现为成熟停滞,AZFb联合缺失和AZFc/d联合缺失则表现多样化,主要表现为成熟停滞和唯支持细胞综合征,成熟精子的检出率低。
关键词不育, 男性; 无精子症; 少精子症; 活组织检查, 针吸; 唯支持细胞综合症
随着辅助生殖技术的发展,单精子卵泡浆内注射技术(ICSI)的日臻成熟,使得Y染色体微缺失(AZF,azoospermia factor)患者也有希望通过ICSI生育血亲后代。由于AZF区域缺失的表现是异质的,证实Y染色体微缺失患者的生精功能损害程度主要依靠睾丸活组织病理学检查。我们对AZF缺失引起不育的男性患者的睾丸活检组织生精细胞类型进行分析,了解患者生精功能损害的程度及其与Y染色体微缺失类型的相关性,为Y染色体微缺失患者进一步诊治提供依据,为进一步研究Y染色体微缺失的致病机理提供参考。
对象与方法
一、对象
本研究收集在我院就诊的无精子症及严重少精子症患者,病因诊断为Y染色体微缺失,有完整睾丸活检病理报告的不育患者254例。
二、方法
(一)精液检查
按照WHO《人类精液检查与处理实验室手册》第5版[1]的定义和方法,进行至少2次精液分析。将精液离心沉淀后显微镜检测,诊断为隐匿精子症、无精子症。
(二)睾丸体积的测量
按照WHO《男子不育标准化诊疗手册》[2]的要求和方法,由男科医生严格按照Prader椭圆型睾丸测量模型标准和测量方法确定。
(三)染色体核型分析
常规抽取外周血,培养制备染色体,G显带分析,对每个受检查者常规计数30个核型。
(四)AZF检测
应用多重PCR在4管PCR反应管中扩增AZF区域内的15个STS位点,分别是AZFa区sY82,sY84,sY86,AZFb区的sY124,sY127,sY128,sY133,sY134,sY143,AZFd区的sY145,sY152和AZFc区的sY239,sY242,sY254,sY255,用性别决定因子(sex determining region Y, SRY)作为内控片段,每次检测均同时进行质量控制。设立正常男性阳性对照及空白对照。
(五)睾丸活检
收集来自本院或其它正规医院检查的完整的睾丸活检病理报告。
(六)睾丸组织学分类方法
本研究参照WHO《男子不育标准化诊疗手册》睾丸组织学分类方法,即睾丸活检结果分为生精小管内见成熟精子、生精小管内有生精细胞未见成熟精子(成熟停滞)和唯支持细胞综合症(包括严重玻璃化,即生精小管内没有细胞存在及生精细胞完全萎缩)共3种类型。
(七)性激素测定
用化学发光法测定血清卵泡刺激素(FSH)、黄体生成素(LH )水平。血清FSH水平正常参考值范围为:1.27~19.26 mIU/mL;血清LH水平正常参考值范围为: 1.24~8.62 mIU/mL。
三、研究分组
本研究根据Y染色体微缺失区域类型,分为A缺失组(AZFa缺失)、B缺失组(AZFb缺失)、 B/C/ D联合缺失组(有AZFb+c或 AZFb+c+d缺失)、C/D缺失组(有AZFc或/AZFc+d缺失/或AZFd缺失)。
四、统计学分析
采用SPSS 18.0统计软件包进行统计处理,计量资料用均值±标准差表示,计量资料差异性分析采用ANOVA分析;计数资料差异性分析和率的比较采用x2检验, P<0.05为有统计学意义。
结 果
254例患者平均年龄(31.0±4.0)岁;不育时间(4.7±2.9)年;睾丸总体积(22.7±5.7)mL;精液量(3.2±1.4)mL;黄体生成素(LH)(6.6±4.1)mIU/L;血清卵泡刺激素(FSH)(16.3±10.9)mIU/L,其中正常171例,异常增高83例。AZF缺失分组和睾丸活检结果见表1。4组患者年龄分布、睾丸体积、精液量、LH水平比较无统计学差异性(P>0.05),SH水平比较有统计学差异(F=7.327,P=0.000)。四组AZF缺失患者FSH异常率比较存在统计学差异(见表2)。不同AZF缺失类型患者睾丸活检结果见图1,A缺失组以唯支持细胞综合症表现为主(占6.7%),B缺失组以生精细胞减少、未见成熟精子表现为主(占90.3%),组间比较存在统计学差异(x2=33.069,P=0.000)。

表1 254例患者的AZFAZF缺失和睾丸活检情况

表2 AZF缺失患者FSHFSH异常率分布
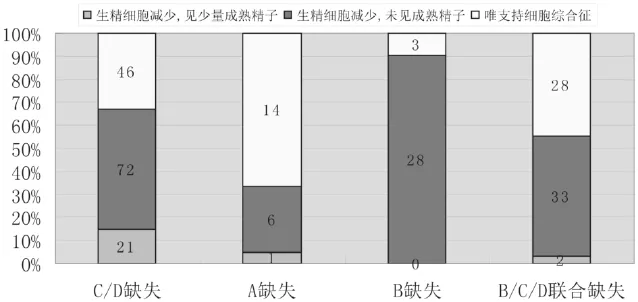
图1 不同AZFAZF缺失类型睾丸活检结果
讨 论
自1976年发现Y染色体长臂远端存在部分缺失以来,对Y染色体AZF区域微缺失的研究[3-6]表明这些区域内任何一个或多个区域的微缺失都将导致精子发生障碍。蔡志明[7]分析研究表明,AZFa缺失与唯支持细胞综合征或早期的生精阻滞具有明显的相关性。AZFb全部缺失的患者表现为生精阻滞,主要停留在精母细胞或精子细胞阶段;AZFb部分缺失时,临床表现多样化,包括唯支持细胞综合征、无精子症或少精子症;如果同时伴有AZFa或AZFc的缺失,则表现为唯支持细胞综合征或生精阻滞。Kent研究报道[8],AZFa缺失患者常表现为无精子症和唯支持细胞综合征。本研究显示,AFZa缺失患者睾丸病理主要表现为唯支持细胞综合征占66.7%,成熟停滞占28.6%,另有4.8%见成熟精子;精液检查有4.8%为隐匿精子症,表明其临床表现多样化,包括唯支持细胞综合征、无精子症或严重少精子症。与研究[8]报道相似。Stahl研究[9]报道,AFZb区域的基因CDY2或HSFY的表达障碍可能与成熟停滞发病相关。本研究显示,AFZb区缺失的缺失类型有90.3%表现为成熟停滞,没有见成熟精子,表明AFZb区主要影响生精细胞的成熟过程,与研究[9]相一致。有研究[10]认为AZFb或AZFb+c区域大片段的缺失致严重的生精功能缺陷,是导致唯支持细胞综合征和/或精子成熟障碍的遗传学原因。本研究显示,B缺失组与 B/C/D联合缺失组比较存在统计学差异,显示当AFZb区与AFZc区及AFZd区联合缺失时,表现为唯支持细胞综合征的比例显著增加,提示AFZc及AFZd位点联合缺失将加重AFZb区缺失患者睾丸生精功能障碍。
有研究分析报道[11],AZFc 缺失的无精子症中,约50%可以经睾丸穿刺获取精子。本研究显示,AZF缺失患者睾丸活检成熟精子检出率为9.4%,其中AZFc/d 缺失组的精子检出率为15.1%,显著较低于研究分析报道[11],可能与样本数量不同有关。
本研究显示,各组之间血清FSH异常增高率比较存在统计学差异,AFZa缺失组FSH异常率较高,AFZb缺失组异常率较低,与睾丸活检唯支持细胞综合征检出率基本相似,表明FSH水平与唯支持细胞综合征存在相关性。
本研究显示,各组之间在睾丸体积、黄体生成素水平之间没有统计学差异,与Hauser研究结果相一致[12]。
总之,本研究结果显示,AZF缺失对睾丸生精功能产生严重影响,各缺失类型患者睾丸活检病理表现存在差异,AZFa缺失类型患者睾丸活检主要表现为唯支持细胞综合征,AZFb缺失类型患者睾丸活检表现为成熟停滞,而AZFb/c/d联合缺失主要表现为成熟停滞和唯支持细胞综合征,AZFc/d联合缺失则表现多样化,主要表现为成熟停滞和唯支持细胞综合征。AZF缺失患者成熟精子的检出率低。因此,对于Y染色体微缺失患者,若表现为AFZa或AFZb区缺失,则一般不建议进行睾丸活检手术或进行ICSI技术助孕。
参 考 文 献
1 World Health Organization, WHO laboratory manual for the examination and processing of human semen - 5th ed. Geneva :World Health Organization, 2010: 37-55
2 World Health Organization, WHO manual for the standardized investigation, diagnosis and management of the infertile male, Cambridge: Cambridge university press, 2000: 37-60
3 Martínez MC, Bernabé MJ, Gómez E, et al. Screening for AZF deletion in a large series of severely impaired spermatogenesis patients. J Androl 2000; 21(5): 651-655
4 Foresta C, Ferlin A, Moro E. Deletion and expressiom analysis of AZFa genes on the humanY chromosome revealed amajor role for DBY inmale infertility. Hum Mol Genet 2000; 9(8): 1161-1169
5 Ferlin A, MoroE, RossiA, et al. CDY1 analysis in infertile patients with DAZ deletions. J Endocrinol Invest 2001; 24(2): RC4-6
6 Blagosklonova O, Fellmann F, Clavequin MC,et al. AZFa deletions in Steroli cell only syndrome: a retrospective study. Mol Hum Reprod 2000; 6(9): 795-799
7 蔡志明. Y染色体及其微缺失与男性不育: 过去、现在与将来. 中华男科学杂志 2010; 16(5): 387-394
8 Kent-First M, Muallem A, Shultz J, et al Defi ning regions of the Y-chromosome responsible for male infertility and identification of a fourth AZF region (AZFd) by Y-chromosome microdeletion detection. Mol Reprod Dev 1999; 53(1): 27-41
9 Stahl PJ, Mielnik AN, Barbieri CE, et al. Deletion or underexpression of the Y-chromosome genes CDY2 and HSFY is associated with maturation arrest in American men with nonobstructive azoospermia. Asian J Androl 2012; 14(5): 676-682
10 Yang Y, Ma MY, Xiao CY, et al. Massive deletion in AZFb/ b+c and azoospermiawith Sertoli cell only and/ormaturation arrest. Int J Androl 2008; 31(6): 573-578
11 何南南, 孙莹璞. 男性不育中 Y 染色体微缺失的研究进展. 生殖与避孕 2012; 32(7): 482-485
12 Hauser R, Botchan A, Yogev L, et al. Probability of spermdetection in nonobstructive zoospermic men undergoing testicular sperm extraction rocedures unrelated to clinical parameters. Arch Androl 2002; 48(4): 301-305
(2015-01-08收稿)
*资金项目资助: 广东省人口和计划生育委员会科研项目(编号:20132017)
**通讯作者, E-mail: tyg813@126.com
doi:10.3969/j.issn.1008-0848.2015.04.004
中图分类号R 698.2
Study on the correlation of Y chromosome microdeletions and the pathological alterations of spermatogenic impairment*
Liu Xingzhang, Tang Yunge**, Zheng Lixin, Wang Qiling, Deng Shunmei, Zhou Bingyi, Liu Huang, Li Mingzhen
The Family Planning Research Institute of Guangdong Province,Guangzhou 510600,Guangdong,China Corresponding author: Tang Yunge, E-mail: tyg813@126.com
AbstractObjective To analyze the correlation of Y chromosome microdeletion and the pathological alterations of spermatogenic impairment in patients with azoospermia and severe oligozoospermia. Methodsthods The pathological report of testicular biopsy of patients diagnosed as azoospermia and severe oligozoospermia with Y chromosome microdeletion were collected. Based on the locus of deletion, they were divided into Group1(AZFa deletion), Group2( AZFb deletion), Group3( AZFb/c/d deletion), Group4 (AZFc/d deletion). The correlation of Y chromosome microdeletion and testicular histology, testicular volume, follicle stimulating hormone, luteinizing hormone was analyzed respectively. Resultssults There were signifi cant difference for the pathological alteration among the four groups by the microdeletion of Y chromosome (P<0.01). The 14 ( 66.7%) cases of Sertoli cell only syndrome and the 6 (28.6%) cases of maturation arrest were found in the group1. The 3 ( 9.7%) cases of Sertoli cell only syndrome and the 28 (90.3%) cases of maturation arrest were found in the group2. The 28 ( 44.4%) cases of Sertoli cell only syndrome and the 33 (52.4%) cases of maturation arrest were found in the group3.The 46 ( 33.1%) cases of Sertoli cell only syndrome and the 72 (51.8%) cases of maturation arrest were found in the group4. The spermatozoa present positive rate in testicular biopsy was 9.4%. Signifi cant differences were found among the four groups in testicular histology,serum FSH level (P<0.01), but not in testicular volume, serum LH level (P>0.05). Conclusionusion Different types of microdeletions would bring about different pathological alteration. The microdeletion of AZFa were mainly found in the Sertoli cell only syndrome in testicular biopsy, and the microdeletion of AZFb in the maturation arrest in testicular biopsy. The presence of AZFb/c/d or AZFc/d deletion were diversifi ed and grouped mainly on the Sertoli cell only syndrome or maturation arrest in testicular biopsy. Spermatozoa present of testicular biopsy was lower in the patients with Y chromosome microdeletion.
Key wordsords infertility, male; azoospermia; oligozoospermia; Biopsy, Needle; Sertoli cell only syndrome

