BDNFBDNF过表达的MSCsMSCs成功干预大鼠神经性阴茎勃起功能障碍的实验研究*
沈寒坚 杨小萍朱广友 沈 彦 王飞翔司法部司法鉴定科学技术研究所,上海市法医学重点实验室(上海 200063)
·论 著·
BDNF
BDNF过表达的MSCsMSCs成功干预大鼠神经性阴茎勃起功能障碍的实验研究*
沈寒坚 杨小萍**朱广友 沈 彦 王飞翔
司法部司法鉴定科学技术研究所,上海市法医学重点实验室(上海 200063)
摘要目的 探索在海绵体神经损伤的大鼠神经性阴茎勃起功能障碍(NED)模型中,注射BDNF过表达的MSCs在神经再生和修复中的作用。方法 建立脑源性神经营养因子(BDNF)过表达的骨髓间充质干细胞(MSCs),通过Western Blot检测BDNF和VEGF-A的表达的水平。 通过Elisa检测BDNF和VEGF-A在细胞上清液中的含量。取120只3月龄大鼠随机分为4组:第1组为假手术组(Sham组), 其余三组均损伤双侧海绵体神经, 第2组(Control组)不再进行干预, 第3组(MSC组)和第4组(BDNF-MSC)分别在关腹前注射MSCs和BDNF过表达的MSCs。大鼠在手术造模后12周,通过海绵体神经电刺激并测阴茎海绵体内压(ICP)来评价阴茎勃起功能。取大鼠阴茎海绵体组织行免疫组化评价诱导型NO合酶(iNOS)的表达水平。结果 通过绿色免疫荧光试验证实BDNF过表达MSCs 制备成功。Western Blot验证结果显示BDNF过表达的MSC细胞中的BDNF和VEGF-A表达水平较MSC细胞明显上调, ELISA验证结果显示BDNF过表达的MSC细胞上清液中的BDNF和VEGF-A表达水平较MSC细胞上清液明显上调。手术后12周,通过海绵体神经电刺激并测ICP来评价阴茎勃起功能,其中假手术组平均最大ICP为(102.20±15.61)cmH2O,实验对照组为(35.47±13.16),MSC干预组为(43.79±16.94)cmH2O,BDNF-MSC干预组为(66.04±15.33)cmH2O。免疫组化结果显示,BDNF-MSC干预组大鼠阴茎海绵体组织内iNOS阳性表达细胞数明显高于MSC干预组。结论 本研究结果显示局部注射MSCs和BDNF过表达的MSCs对于大鼠的NED具有治疗作用。
关键词勃起功能障碍; 间质干细胞; 脑源性神经营养因子
男性勃起功能障碍(ED)是指男性持续性或反复发作的难以达到和维持阴茎勃起,进而无法完成性交和满意性活动的病理现象。阴茎的勃起依赖于一系列正常的神经和血管性反应,包括正常的性心理反应,正常的生理结构,正常的内分泌、神经和血管功能等,任何一个环节的异常都有可能导致ED。神经性阴茎勃起功能障碍(NED)约占ED的10%~19%,主要的相关病变包括急性神经损伤、前列腺癌、糖尿病和帕金森病等,海绵体神经(CN)的损伤最为常见,是最主要的致病因素。盆腔恶性肿瘤术后或者外伤后,ED的发生率明显升高,因为在手术及外伤过程中CNs可能会被切断、撕裂或者牵拉等,从而造成其损伤。目前,磷酸二酯酶-5(PDE-5)抑制剂(如西地那非等)是临床治疗ED的一线药物,但是它对ED患者疗效欠佳。干细胞技术是近年来生物学领域的一项尖端技术,已在各个学科广泛应用,尤其是干细胞治疗技术更是生物医学领域的热点和难点。本研究通过损伤CN构建大鼠NED模型,用骨髓间充质干细胞(MSC)及脑源性神经营养因子(BDNF)过表达的MSC来干预NED大鼠,对其治疗效果进行实验研究。
材料与方法
一、材料
BDNF过表达的慢病毒载体和MSC由复旦大学生物医学研究院友情提供。用BDNF过表达的慢病毒载体感染MSC,制备BDNF过表达的MSC(BDNFMSC)。将接种目的细胞置于6cm培养皿中,当细胞融合度达到30%~45%左右时,加入3mL的病毒上清,同时加入2mL含10%胎牛血清的细胞培养液,加入polybrene至终浓度4~8μg/mL,24h后更换为正常培养基。48h后在荧光显微镜下观察细胞感染效率。通过Western-blot和ELISA方法验证BDNF-MSC中 BDNF的表达情况。
二、实验动物
取成年雄性SD大鼠120只(上海斯莱克实验动物有限责任公司提供),体重200~300g,实验大鼠进入研究前交配试验证实均有正常的性功能,在14 h光照/10 h黑暗周期恒温环境下圈养,随意进食,直至试验的当天。将 120只大鼠分为4组:(1)假手术组(Sham组),即大鼠下腹正中切口后,暴露并游离出盆腔星状神经节(Major pelvic ganglion, MPG)和海绵体神经,不经任何其他处理即缝合关闭腹膜和皮肤;(2)实验对照组(Control组),步骤如第一组,在关腹前用血管钳夹闭海绵体神经2min,造成神经损伤,之后关闭缝合腹膜和皮肤;(3)MSC干预组,前序步骤如第二组,在关腹前向海绵体神经损伤区周围注射20μL的MSC(1×106)细胞悬液,之后关闭缝合腹膜和皮肤;(4)BDNF-MSC干预组,其他步骤同第三组,注射液改为20μL BDNF-MSC(1 ×106)细胞悬液。大鼠行手术处理后,继续上述方法饲养12周。
三、手术方式
所有手术均在无菌操作下完成,均以4%水合氯醛(1ml/100g)腹腔麻醉。将麻醉好的大鼠仰卧固定于解剖板上, 行下腹正中切口,提起包皮沿阴茎背侧正中剪开皮肤,直至耻骨联合下方,长约3cm,游离腹侧阴茎皮肤近端至睾丸上极,打开腹腔,提出睾丸,暴露背侧前列腺,在10倍外科显微镜下仔细游离前列腺两侧叶后方, 可暴露出盆腔星状神经节, 沿盆腔星状神经节向周围仔细分离可识别出盆神经、腹下神经这两支主要的输入支以及沿尿道侧面走行的最大输出支-海绵体神经。所有神经均经多道生理记录仪(美国 BIOPAC 公司,MP150 型)电刺激,观察阴茎勃起反应予以确认。至此,第一组30只大鼠关闭腹膜,逐层缝合。后三组大鼠游离海绵体神经并于近端用血管钳夹闭海绵体神经2min,造成神经损伤。第二组大鼠在海绵体神经损伤之后关闭缝合腹膜和皮肤,逐层缝合。第三组大鼠在关闭腹膜前向海绵体神经损伤区周围注射20μL的MSC(1×106)细胞悬液,之后关闭缝合腹膜和皮肤,第四组大鼠注射液改为20μL BDNF-MSC(1×106)细胞悬液。所有大鼠待清醒后送至动物房继续饲养。
四、阴茎海绵体神经电刺激及海绵体内压(ICPICP)监测
大鼠行手术造模后12周,将建模后的大鼠腹腔麻醉后如前所述再次游离出阴茎海绵体神经,用间距1 mm 的双极电极勾住海绵体神经,液体石蜡保护神经周围,调整生理多用仪参数: 刺激电流1.6mA,刺激时间0.2ms,频率20Hz,直至阴茎膨胀、勃起,证实阴茎海绵体神经的应用解剖学走行。将插入一侧阴茎海绵体的25G针头连接于压力传感器和四路放大器,后者再连接到资料获取模块,并采用SMUP2PC型生物信号处理系统在计算机上记录数据。
五、取材
将测量ICP之后的大鼠处死,取阴茎海绵体组织并立即加入液氮中,置于-80℃冰箱保存。
六、统计分析
应用软件Graphpad prism 5进行统计分析并输出图片,用非配对t检验对4组大鼠海绵体神经电剌激后的ICP数据进行显著性检验。
结 果
一、细胞培养结果
用BDNF过表达的慢病毒载体感染MSC,成功制备BDNF过表达的MSC(BDNF-MSC)。图1和图2分别为慢病毒载体感染MSC后的荧光和白光照片。

图1 慢病毒载体(BDNFBDNF过表达)感染MSCMSC后48h48h的荧光照片
二、BDNFBDNF过表达验证
(一)Western验证
Western-blot验证结果显示BDNF过表达的MSC细胞中的BDNF和VEGF-A表达水平较MSC细胞明显上调(见图3)。
图2 慢病毒载体(BBDDNNFF过表达)感染MMSSCC后4488hh的白光照片

图3 BBDDNNFF过表达MMSSCC细胞中的BBDDNNFF和VEEGGFF--AA表达均明显上调
(二)细胞上清液ELISA测定
取MSC细胞和BDNF过表达的MSC细胞的上清液,ELISA方法测定BDNF和VEGF-A的水平,结果显示BDNF过表达的MSC细胞上清液中的BDNF和VEGF-A表达水平较MSC细胞上清液明显上调(见图4)。
三、动物实验结果
(一)动物实验结果
所有120只大鼠在进行手术处理过后的12周中,第一组、第四组各死亡一只,第二组、第三组各死亡两只。最终进入测量ICP的大鼠为114只。
(二)海绵体内压测量结果
假手术组平均最大ICP为(102.20±15.61)cmH2O,N=29;实验对照组为(35.47±13.16)cmH2O,N=28;MSC干预组为43.79±16.94,N=28;BDNF-MSC干预组为66.04±15.33,N=29。其中第四组与第二组、第三组比较,最大ICP均有显著性提高,P<0.001(见图5)。
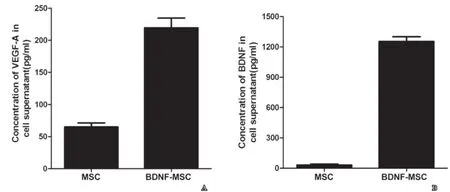
图4 BDNFBDNF过表达MSCMSC细胞上清液的BDNFBDNF和VEGF-AEGF-A表达明显上调

图5 各组阴茎海绵体内压测定结果
(三)阴茎海绵体组织免疫组化结果
取处死大鼠的阴茎中段海绵体制成组织切片,并行免疫组化结果显示,BDNF-MSC干预组(见图6A6A)大鼠阴茎海绵体组织内诱导型NO合酶(iNOS)阳性表达细胞数明显高于MSC干预组(见图6B6B)。细胞质和细胞核中呈现棕黄色颗粒为iNOS阳性表达(如图6A6A中箭头所示)。

图6 免疫组化结果
讨 论
骨髓间充质干细胞(MSC)是起源于中胚层的一类多能干细胞,主要存在于结缔组织和器官间质中,不但可以分化为中胚层组织细胞如成骨细胞、软骨细胞及脂肪细胞等[1],还可以分化为非中胚层细胞如肺上皮细胞、神经元细胞及肝细胞等[2]。既往的研究显示,MSC具有促进组织修复的功能[3, 4]。即使MSC在某些组织的修复中发挥重要作用,其应该不具有直接诱导神经再生的作用。据文献报道,大鼠阴茎海绵体内注射MSC,可以修复STZ诱导的糖尿病大鼠的勃起功能障碍[5, 6]。但是,需要进一步的研究去证实,MSC是否可以直接作用于海绵体神经。
我们通过制备大鼠NED模型来研究MSC对于NED是否具有治疗作用。本实验发现,NED大鼠阴茎海绵体内注射MSC后12周,ICP有部分升高,说明其对于NED有一定的修复作用,但是未达到我们所希望的预期效果。有报道显示,周围神经切断后,雪旺细胞和神经元分泌的BDNF对于轴突的再生有重要作用[7]。另一项研究显示,神经肌肉系统的内环境中保持正常水平的BDNF,对于维持神经肌肉系统的活力以及可塑性有重要作用[8]。同时,BDNF除了可以作用于神经细胞外,还可以调节卫星细胞的分化和促进骨骼肌的再生[9]。在大脑中动脉梗死的大鼠模型中,BDNF基因修饰的MSC具有明显的修复作用[10]。基于上述研究成果,我们考虑是否可以将MSC和BDNF的作用联合起来。因此,我们制备了可以表达BDNF基因的慢病毒载体,并以此制备了可以稳定过表达BDNF的MSC。在用BDNF过表达的MSC干预NED大鼠12周后,我们发现ICP较MSC干预组有明显升高。从宏观的层面来看,BDNF过表达的MSC可以成功干预NED大鼠,使其勃起功能明显恢复,但是其分子机制尚未完全清楚。
我们通过分析BDNF-MSC和其上清液,发现VEGF-A的表达均明显增高。既往的研究显示,VEGF除了可以作用于血管内皮以外,还具有很多同神经营养因子相似的作用[11, 12],如VEGF对于大鼠的盆大神经节有营养作用[13]。另外,在对人多发性骨髓瘤细胞的研究中发现,BDNF可以通过激活MEKERK和PI3K/AKT信号通道,诱导VEGF的分泌[14]。据此,我们推测在BDNF-MSC促进大鼠NED恢复的过程中,VEGF可能也发挥了重要作用。
既往的研究显示,通过激活VEGF受体1,可以增加eNOS和iNOS的表达[15],而iNOS是重要的心血管系统的保护蛋白[16]。通过免疫组化实验,我们发现BDNF-MSC干预组大鼠的阴茎海绵体组织内iNOS阳性表达细胞数明显高于MSC干预组。据此,我们推测,BDNF-MSC之所以可以促进NED大鼠的阴茎勃起功能的恢复,除了修复其海绵体神经外,可能还通过VEGF-A促进iNOS等血管保护蛋白的分泌,对于阴茎海绵体组织的血管内皮也有一定的修复作用。
总之,本研究发现,BDNF转染的MSC对于大鼠NED具有明显的治疗作用,但其分子机制有待于进一步实验来证实。
参 考 文 献
1 Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells. Science 1999; 284(5411): 143-147
2 Aurich I, Mueller LP, Aurich H, et al. Functional integration of hepatocytes derived from human mesenchymal stem cells into mouse livers. Gut 2007; 56(3): 405-415
3 Alfaro MP, Young PP. Lessons from genetically altered mesenchymal stem cells (MSCs); candidates for improved MSC-directed myocardial repair. Cell Transplant 2012; 21(6): 1065-1074
4 Ciapetti G, Granchi D, Baldini N. The combined use of mesenchymal stromal cells and scaffolds for bone repair. Curr Pharm Des 2012; 18(13): 1796-1820
5 Qiu X, Lin H, Wang Y, et al. Intracavernous transplantation of bone marrow-derived mesenchymal stem cells restores erectile function of streptozocin-induced diabetic rats. J Sex Med 2011; 8(2): 427-436
6 Sun C, Lin H, Yu W, et al. Neurotrophic effect of bone marrow mesenchymal stem cells for erectile dysfunction in diabetic rats. Int J Androl 2012; 35(4): 601-607
7 Wilhelm JC, Xu M, Cucoranu D, et al. Cooperative roles of BDNF expression in neurons and Schwann cells are modulated by exercise to facilitate nerve regeneration. J Neurosci 2012; 32(14): 5002-5009
8 Gomez-Pinilla F, Ying Z, Roy RR, et al. Voluntary exercise induces a BDNF-mediated mechanism that promotes neuroplasticity. J Neurophysiol 2002; 88(5): 2187-2195
9 Clow C, Jasmin BJ. Brain-derived neurotrophic factor regulates satellite cell differentiation and skeltal muscle regeneration. Mol Biol Cell 2010; 21(13): 2182-2190
10 Kurozumi K, Nakamura K, Tamiya T, et al. BDNF genemodifi ed mesenchymal stem cells promote functional recovery and reduce infarct size in the rat middle cerebral artery occlusion model. Mol Ther 2004; 9(2): 189-197
11 Storkebaum E, Lambrechts D, Carmeliet P. VEGF: once regarded as a specifi c angiogenic factor, now implicated in neuroprotection. Bioessays 2004; 26(9): 943-954
12 Jin K, Zhu Y, Sun Y, et al. Vascular endothelial growth factor (VEGF) stimulates neurogenesis in vitro and in vivo. Proc Natl Acad Sci U S A 2002; 99(18): 11946-11950
13 Lin G, Shindel AW, Fandel TM, et al. Neurotrophic effects of brain-derived neurotrophic factor and vascular endothelial growth factor in major pelvic ganglia of young and aged rats. BJU Int 2010; 105(1): 114-120
14 Sun CY, Hu Y, Huang J, et al. Brain-derived neurotrophic factor induces proliferation, migration, and VEGF secretion in human multiple myeloma cells via activation of MEK-ERK and PI3K/AKT signaling. Tumour Biol 2010; 31(2): 121-128
15 Kroll J, Waltenberger J. VEGF-A induces expression of eNOS and iNOS in endothelial cells via VEGF receptor-2 (KDR). Biochem Biophys Res Commun 1998; 252(3): 743-746
16 Dawn B, Bolli R. Role of nitric oxide in myocardial preconditioning. Ann N Y Acad Sci 2002; 962: 18-41
(2015-02-25收稿)
doi:10.3969/j.issn.1008-0848.2015.04.001
中图分类号R 698.1
*基金项目资助: 本课题获中央级公益性科研院所基本科研业务费资助(编号:GY2012G-3)**通讯作者, E-mail: yangxp@ssfjd.cn
Mesenchymal stem cells with BDNF overexpression is a potential cure for neurogenic erectile dysfunction*
Shen Hanjian, Yang Xiaoping**, Zhu Guangyou, Shen Yan, Wang Feixiang
Institute of Forensic Science, Ministry of Justice,Shanghai Key Laboratory of Forensic Medicine, Shanghai 200063, China Corresponding author: Yang Xiaoping, E-mail: yangxp@ssfjd.cn
AbstractObjective To investigate the effects of intracavernosal injection with brain-derived neurotrophic factor (BDNF) overexpressed mesenchymal stem cells (BDNF-MSCs) on recovery of erectile function after cavernous nerve injury (CNI). Methodsthods Stable MSCs with BDNF over epression were fi rst established. Western blot and ELISA were applied to detect the levels of BDNF and Vascular endothelial growth factor A (VEGF-A) in cells or their supernatants respectively. A total of 120 3-month-old Sprague-Dawley (SD) rats were used in the study and they were divided randomly into four groups. Rats in sham-operated group were treated with a sham operation without cavernous nerve manipulation. Rats in the other three groups were treated with bilateral CNI,but rats in the control group had no further manipulation. Rats in MSC and BDNF-MSC groups were treated by intracavernosal injection with MSCs or BDNF-MSCs respectively. Erectile function was assessed by cavernosal nerve electrostimulation 12 weeks after operation. The penile tissues werethen collected for analysis of inducible nitric oxide synthase (iNOS) level. Resultssults BDNF-MSC cells were successfully established. Western blot and ELISA results demonstrated that both BDNF and VEGF-A were all increased in the BDNFMSC cells and its supernatant, as compared with that in MSC cells. After nerve crushing, the erectile functional evaluation of rats in the control group at 3 months showed a lower mean maximal intracavernous pressure (ICP) under CN stimulation, at (35.47±13.16)cmH2O, than that of rats in the sham group, at (102.20±15.61)cmH2O. Meanwhile, the ICP of BDNF-MSC group was signifi cantly higher than that of the controls, at (66.04±15.33)cmH2O. Immunohistochemical staining showed an increase of iNOS in penile smooth muscle cells of BDNF-MSC group. Conclusionusion Intracavernous injection with BDNF-overexpressed MSCs may enhance the therapeutic effect of MSCs for the treatment of erectile dysfunction.
Key wordsords erectile dysfunction; mesenchymal stem cell; brain-derived neurotrophic factor

