1株耐热产乙醇酵母的分离、鉴定与性能测试
费文斌 雍晓雨 徐俊等

摘要:以江苏省灌南县汤沟酿酒厂的大曲、窖泥及发酵酒醅为样品,经富集、分离得到18株初筛酵母菌株,从中经复筛分离出1株能在42 ℃下发酵产乙醇的酵母菌,命名为NR11。经过形态观察、BIOLOG微生物检定系统以及18S rDNA基因的分析,将该酵母菌鉴定为酿酒酵母(Saccharomyces cerevisiae)。对其特性及发酵性能的研究结果显示,NR11可以在12%乙醇溶液及55%糖溶液下正常发酵,致死温度可达60 ℃,在30、38、40、42 ℃条件下,乙醇产量分别可以达到109.0、93.2、73.8、44.0 g/L。
关键词:酿酒酵母;富集;分离;性能测试;菌株鉴定;耐热性;乙醇
中图分类号: TS261.1 文献标志码: A
文章编号:1002-1302(2015)03-0319-04
乙醇为一种可再生的清洁能源,可用作液体燃料替代或部分替代石油燃料,并且其生产工艺成熟,原料来源广泛[1-3]。酿酒酵母(Saccharomyces cerevisiae)是使用最广泛的乙醇发酵出发功能菌株,然而传统的酿酒酵母的最适发酵温度为28~33 ℃,一般不超过36 ℃,因此在气温较高地区和夏季会严重影响正常生产。研究显示,应用耐高温酵母生产乙醇具有节约能源、提高出酒率、缩短发酵周期、提高设备利用率及维持高温下正常生产等诸多优势[4]。耐高温高产乙醇酵母菌的选育和发酵工艺的改进是实现浓醪发酵工业的关键,因此分离、筛选和应用耐高温高产乙醇酵母菌的研究已经受到广泛重视,成为当前国内外乙醇生产行业研究的热点[5-7]。
白酒的传统酿造过程是以含有复杂微生物种类的酒曲作为发酵剂,以淀粉质、糖质为原料,在窖池中完成乙醇发酵的过程。在发酵过程中,窖泥和发酵糟醅密封接触,大量微生物在两者间扩散、交换,最终使得作为发酵容器的窖泥中含有包括酵母菌在内的非常丰富的微生物种群。这些微生物在白酒生产后期,能利用含高浓度乙醇的酒醅进行发酵,并且发酵温度高,经过长期驯化可以具有比其他环境微生物更强的耐高温、耐乙醇能力[8-9],因此白酒厂窖池中的窖泥、酒曲成为分离选育酵母菌及其他微生物的良好来源[10]。本试验旨在通过初筛、复筛试验得到可以耐高温并且高产乙醇酵母,并对耐高温酵母的生理特性及发酵性能进行研究。
1 材料与方法
1.1 试验材料
试验材料为大曲、窖泥、发酵酒醅,由江苏省灌南县汤沟酿酒厂提供。
1.2 培养基
YEPD液体培养基:20.0 g/L葡萄糖、20.0 g/L酵母粉、20.0 g/L蛋白胨;
YEPD固体培养基:20.0 g/L葡萄糖、20.0 g/L 酵母粉、20.0 g/L蛋白胨、20.0 g/L琼脂;
酵母富集培养基:含10%乙醇的6Be°麦芽汁,pH值自然;
初筛培养基由上下2层培养基组成;下层培养基为YEPD固体培养基,上层培养基主要成分包括0.3 g/L红四氮唑(TTC)、30.0 g/L葡萄糖、20.0 g/L琼脂;乙醇发酵培养基:250.0 g/L葡萄糖、4.0 g/L蛋白胨、3.0 g/L 酵母粉、4.0 g/L (NH4)2SO4、3.0 g/L KH2PO4、0.5 g/L MgSO4、0.05 g/L ZnSO4、0.05 g/L ZnSO4 、0.05 g/L FeSO4。
1.3 筛选方法
酵母分离样品的采集:从酒厂窖泥、酒曲、酒醅中以随机取样原则收集样品,装入灭菌纸袋中,贮存于冰箱中备用。
样品的预处理:分别将10.0 g大曲、窖泥、酒醅样品加入50 mL装有灭菌玻璃珠的无菌水中,200 r/min处理30 min以打碎样品。
酵母菌的富集:取5.0 mL各样品悬液接入酵母富集培养基中,于30 ℃、180 r/min条件下培养,以富集样品中的酵母;6 h 后转成40 ℃、180 r/min条件下培养18 h,以富集其中的耐热酵母菌株。
一级筛选:将富集的菌液涂布于YPD固体培养基上,于40 ℃培养24 h,长出菌落后倒入45 ℃ TTC上层培养基中,于40 ℃下避光保温6 h。比较各菌株颜色,颜色呈深红色的即具有较高的产乙醇能力。挑取明显的酵母菌落,多次划线得到单菌落,镜检并观察记录菌体形状、大小、出芽情况、菌落大小等。
二级筛选:将一级筛选酵母菌分别接入带有杜氏小管的不同的YEPD液体试管中,在不同温度下培养,分别在12、24、48 h观察杜氏小管中的产气情况。
三级筛选:过夜培养各酵母菌株,按体积分数为20%的接种量接入到发酵培养基中,37 ℃厌氧培养48 h,测定D600 nm值、残糖含量、乙醇含量。
1.4 酵母菌的鉴定
1.4.1 BIOLOG鉴定 BIOLOG代谢指纹分析:将菌株在BIOLOG专用酵母培养基上培养约48 h,制备菌悬液,调整吸光度至合适范围,上样于96孔微鉴定板,于30 ℃培养。分别在24、48、72 h使用BIOLOG微生物鉴定仪读取数据,将该菌株对95种碳源的利用率与数据库中的信息进行比对,得出鉴定结果[11]。
1.4.2 18S rDNA基因序列鉴定 18S rDNA基因扩增和测序:使用OMEGA公司的Yeast DNA Kit试剂盒提取该菌株的基因组DNA,利用通用引物(上游:5′-TCCTCTAAATGACCAAGTTTG-3′,下游:5′-GGAAGGGATGTATTTATTAG-3′)进行PCR扩增[12],PCR产物经纯化后送南京金斯瑞生物科技有限公司测序,最后将测序结果进行BLAST比对。
1.5 酵母菌性能测试
耐热性能:将菌株按体积分数为10%的接种量接入到种子培养基中,在37、40、43、45 ℃下培养24 h,测定其生物量。endprint
耐糖性能:分别制备初始葡萄糖质量分数为10%、20%、25%、30%、35%、40%、45%、50%、55%、60%的培养基,37 ℃ 培养24 h,测定其生物量。
耐酸性能:制备初始pH值分别为2、3、4、5、6的YEPD培养基,37 ℃培养24 h,测定其生物量。
耐醇性能:制备初始乙醇体积分数分别为6%、8%、10%、12%、14%、16%、18%的YEPD培养基,于37 ℃培养 24 h,测定其生物量。
致死温度测定:将装有1 mL已培养菌液的试管,分别置于52、54、56、58、60 ℃条件下维持5 min后马上冷却,取 0.1 mL 菌液涂布于YEPD平板上,观察菌落生长情况,如果没有菌落生长则表示该温度为该菌的致死温度。
1.6 分析方法
生物量的测定:采用比浊法,将发酵液混匀后稀释成一定倍数,测定其在波长600 nm下的吸光度(D600 nm)。
残糖、乙醇含量的测定:利用SBA-40E生物传感仪(山东省科学院生物研究所)进行测定。
2 结果与分析
2.1 耐高温酵母菌的初筛
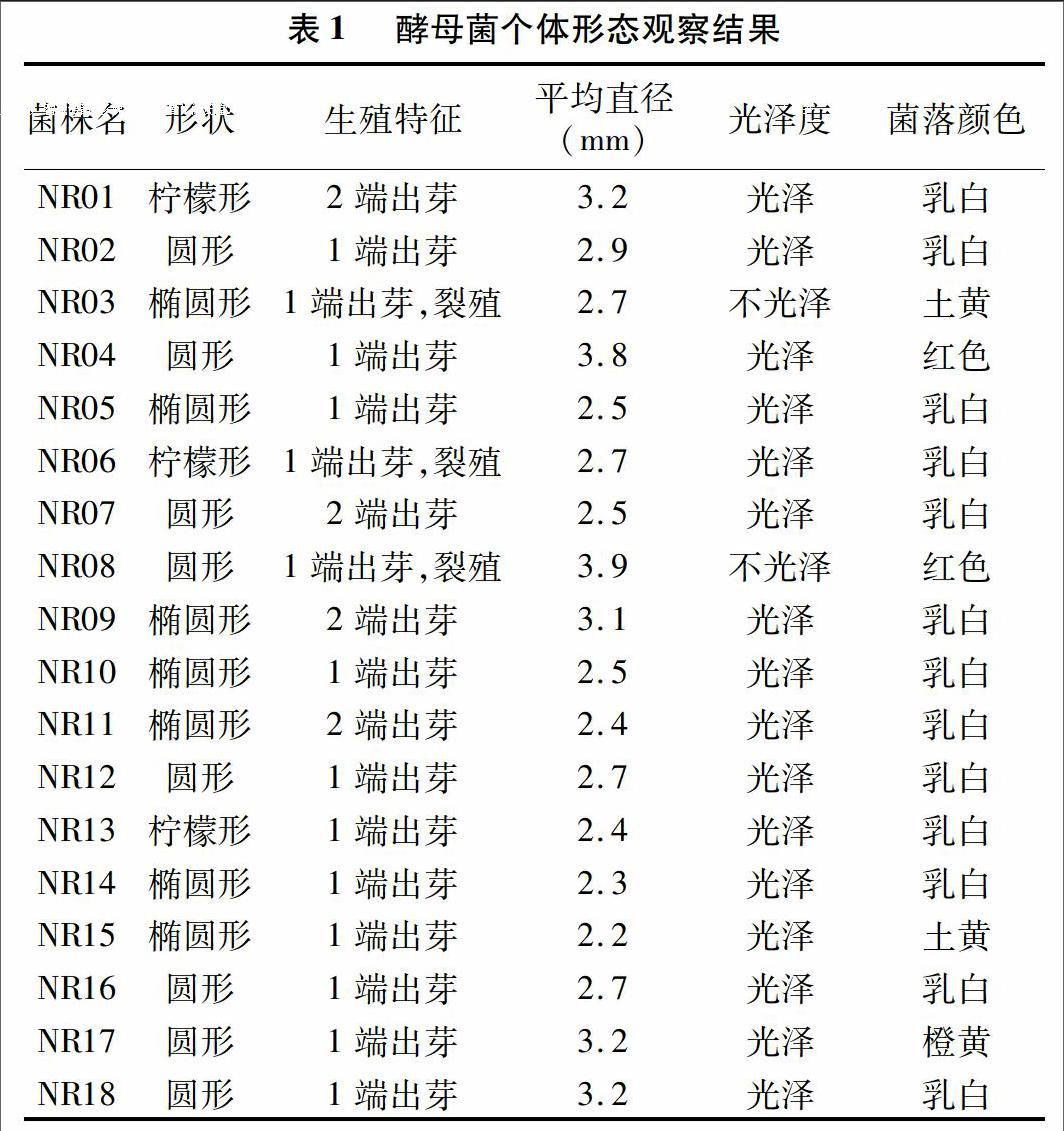
TTC是1种显色剂,它对酵母的代谢产物产生呈色反应,因此通过它可以判断酵母中呼吸酶的活力,即酵母产乙醇的能力。经过二级筛选和镜检,获得18株颜色最红且菌落较大的酵母菌落,杜氏管产气能力强的酵母菌株编号为NR01至NR18,观察记录菌体形状、出芽情况、是否有裂殖现象、是否形成假菌丝,同时测定其细胞大小,结果如表1所示。
2.2 耐高温酵母菌的复筛
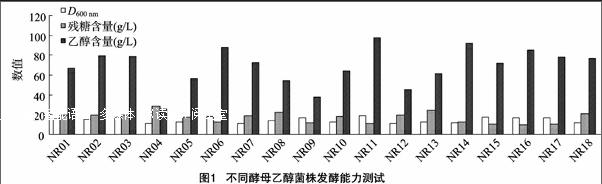
将过夜培养的各酵母菌按体积分数20%接入到复筛培养基中,37 ℃厌氧培养48 h。从图1可以看出,发酵48 h后,在37 ℃培养条件下,菌株NR11的乙醇质量浓度最高,达到 98 g/L,残糖质量浓度为11.2 g/L,D600 nm达到18.9,乙醇得率为76.7%,各方面性能均是18株初筛酵母菌中性能最佳的。因此,选取NR11进行下一步鉴定及性能测试试验。
2.3 酵母菌的种属鉴定结果
2.3.1 BIOLOG鉴定结果 与传统鉴定方法相比,BIOLOG自动微生物鉴定系统快速、便捷、有效,在微生物鉴定技术上是一个很大的进步,由于其数据库范围广、包含全面,为广大的微生物工作者提供了方向性指导[11]。此外,仪器在鉴定结束时会给出与数据库最匹配的4个结果,根据P值从大到小排序,最佳试验结果见表2。由表2可以看出,相似度=0967>0.75,距离=0.471<5.0,P值为0.999。系统得到的3个重要参数比较理想,与数据库匹配良好,相似度越接近100,说明鉴定结果的可靠性更高。在ID地址栏显示出1个最佳匹配名称,物种名为Saccharomyces cerevisiae(酿酒酵母)。各种数据指标都表明,鉴定结果准确,与数据库有很好的匹配。
2.3.2 18S rDNA菌株鉴定结果 18S rDNA作为一种经典的鉴定方式在真菌的鉴定工作中占有重要作用,用于扩增18S rRNA基因片段的PCR引物是根据真菌18S的保守区域设计的。通过PCR对酵母18S rRNA 基因片段进行扩增并测序,再对测序结果进行多态性分析,从而将待测酵母正确分类[12]。本试验将目标菌株的18S rRNA基因上传至NCBI数据库并进行BLAST比对,下载相关18S基因序列构建进化树,结果如图2所示。经比较可知,NR11与酿酒酵母的同源性为100%,因此,综合形态观察、BIOLOG微生物检定系统以及18S rDNA基因的分析结果,将该酵母菌鉴定为1株酿酒酵母,并命名为酿酒酵母NR11。
2.4 酵母菌性能测试
2.4.1 温度对酵母菌生长影响 温度在酵母的生长及发酵过程中起至关重要的作用。在低温范围内,温度越高,酶促反应越快,酵母生长代谢越快,乙醇提前生成,产量也进一步提高;当温度超过最适温度后,高温抑制酵母细胞生长,表现出酵母易衰老、相关酶类易失活、细胞膜稳定性降低等,从而延长发酵周期,并影响发酵乙醇的产量[10]。从图3可见,菌株NR11的最适生长温度为37 ℃,此时D600 nm 最高达到了19.84;菌株NR11在40 ℃ 下也有较好的长势, D600 nm 值最高达到了17.14;随着温度的升高,温度对酵母生长的抑制作用明显增强,D600 nm值逐渐降低,45 ℃条件下,酵母菌几乎没有生长。
2.4.2 初始糖浓度对酵母菌的影响 初始碳源的浓度对发酵也会产生影响,在工业化生产中,糖浓度一般不超过20%,若培养基中营养物质过于丰富,会导致酵母异常增殖,降低底物转化成产物的效率,对酵母发酵会产生不良影响[13];另外,高糖浓度所产生的高渗透压也会影响菌体的正常生长、代谢以及发酵活性[14]。
从图4可以看出,当初始糖浓度在10%~55%的范围内,D600 nm随着糖浓度的提高而提高;当初始糖浓度在60%时,就出现抑制作用。目前,从天然环境分离得到的菌株大多只能耐受20%左右的糖浓度,说明菌株NR11具有较强的耐渗透压能力,可以耐受60%以上的糖浓度所产生的渗透压。
2.4.3 乙醇浓度对酵母菌生长的影响 乙醇发酵是利用酵母将糖类物质转化为乙醇和二氧化碳,随着发酵的进行,乙醇浓度不断增加,高浓度乙醇会抑制酵母生长及存活率,并影响一些运输系统,如葡萄糖和氨基酸的运输等,同时会改变细胞膜的流动性和膜上H+-ATP酶的活性,从而影响酵母细胞的生长和细胞的形态[15]。
从图5可以看出,初始乙醇体积分数越高,D600 nm值越小;当初始乙醇体积分数在6%以上时,对酵母开始有抑制作用;当初始乙醇体积分数在10%以上时,乙醇对酵母生长的抑制明显增强。这是因为在高温与高乙醇浓度共同作用下,酵母细胞膜通透性增强,流动性降低,各种酶促反应受到抑制,从而对酵母细胞的生长和代谢产生了胁迫作用。endprint
2.4.4 培养基pH值对酵母菌生长的影响 酵母细胞的生长和胞内酶促反应都需要在一定的pH值环境中进行,pH值值过高或过低都会影响酵母细胞膜所带电荷状态,使酵母生长代谢受阻[14]。
2.5 不同温度下菌株NR11的产乙醇能力
分别在30、38、40、42 ℃下,以20%的接种量将NR11接入发酵培养基中进行厌氧发酵48 h,试验结果如图7所示。由图7可以看出,在初始糖浓度260.0 g/L条件下发酵48 h后,30 ℃ 条件下的乙醇含量达到109.0 g/L,残糖含量为 4.6 g/L,乙醇得率83.6%;38 ℃条件下,乙醇含量达到 93.2 g/L,残糖含量为10.4 g/L,乙醇得率72.9%;40 ℃条件下,乙醇含量达到73.8 g/L,残糖含量为8.5 g/L,乙醇得率670%;43 ℃条件下乙醇含量达到44.0 g/L,残糖含量为 21.7 g/L,乙醇得率34.4%。
3 结论
经过初筛和复筛,从采自于江苏省灌南县汤沟酿酒厂的酒曲样品中筛选出1株在42 ℃下生长并产乙醇的酵母,命名为NR11。经过BIOLOG和18S rDNA鉴定,NR11为酿酒酵母。进一步研究结果表明,NR11有较强的耐糖和耐热性,可以在初始糖浓度为60%和42 ℃的高温下生长,致死温度也达到60 ℃,在30、38、40、42 ℃下的乙醇产量分别可以达到109.0、93.2、73.8、44.0 g/L,在42 ℃的高温下仍旧可以生产乙醇,充分显示其在高温下发酵生产乙醇的潜力巨大。
综上所述,从酒曲样品中筛选出的NR11生长旺盛,发酵能力强,发酵所得生物量高,耐高温和高糖,在低pH值下也可以生长以避免杂菌污染,可见其是一株有工业生产应用价值的酵母菌株,具有广阔的应用前景。
参考文献:
[1]Farrell A E,Plevin R J,Turner B T,et al. Ethanol can contribute to energy and environmental goals[J]. Science,2006,311(5760):506-508.
[2]Service R F. Cellulosic ethanol. Biofuel researchers prepare to reap a new harvest[J]. Science,2007,315(5818):1488-1491.
[3]Blieck L,Toye G,Dumortier F,et al. Isolation and characterization of brewers yeast variants with improved fermentation performance under high-gravity conditions[J]. Applied and Environmental Microbiology,2007,73(3):815-824.
[4]赵 群,王红岩,刘德勋,等. 燃料乙醇发展现状及发展潜力[J]. 广州化工,2012,40(7):72-73,92.
[5]吕超雷. 谈薯类酒精生产工艺的创新[J]. 酿酒,2010,37(1):82-83.
[6]刘海臣,张敏楠,阮时雷,等. 多样品耐高温产乙醇酵母的筛选及生长特性研究[J]. 食品科技,2008,33(3):17-21.
[7]张 宁,蒋剑春,李翔宇,等. 我国非粮燃料乙醇产业发展现状及前景展望[J]. 生物质化学工程,2011,45(4):47-50.
[8]张文彬,蔡 葆,徐艳丽.我国生物燃料乙醇产业的发展[J]. 中国糖料,2010(3):58-62,67.
[9]刘从艾,穆文斌,徐怀玉,等. 大曲酵母菌及窖泥生香菌耐酸能力的研究[J]. 酿酒,1999(1):35-39.
[10]徐大鹏,李云杰,张 栩,等. 耐高温酵母菌的筛选及特性[J]. 生物加工过程,2011,9(3):17-21.
[11]李金霞,程 池,姚 粟,等. Biolog微生物自动分析系统——酵母菌鉴定操作规程的研究[J]. 食品与发酵工业,2006,32(7):50-53.
[12]张晓娟,王 柱,周光燕,等. 西南菌种站20株酵母菌种基于26S rDNA D_1/D_2区序列分析研究[J]. 四川食品与发酵,2008,44(3):1-4.
[13]苑 伟,王学锋,刘延琳. 优选酿酒酵母菌株发酵性能研究[J]. 中国酿造,2010,29(9):48-52.
[14]程殿林. 微生物工程技术原理[M]. 北京:化学工业出版社,2007:114-124.
[15]杨东升,朱丽元,谢晓红,等. UV处理筛选耐高浓度乙醇酿酒酵母菌株[J]. 中国酿造,2010,29(10):35-38.endprint

