支原体巨噬细胞活化脂肽-2诱导人单核细胞分泌MMP-9
李媛媛 余敏君 游晓星 李冉辉 陈列松 朱翠明 文道林 曾焱华
支原体巨噬细胞活化脂肽-2诱导人单核细胞分泌MMP-9
李媛媛 余敏君 游晓星 李冉辉 陈列松 朱翠明 文道林 曾焱华
目的 观察支原体巨噬细胞活化脂肽-2(MALP-2)对人单核细胞分泌基质金属蛋白酶-9(MMP-9)的影响。方法 体外培养人单核细胞系THP-1,分别采用0、0.1、1.0和5.0 μg/mL MALP-2刺激THP-1细胞12~18 h,采用实施定量PCR检测MMP-9 mRNA的表达,荧光共振能量转移(FRET)检测MMP-9的酶活性变化,ELISA检测培养上清中MMP-9的含量。结果 THP-1细胞未刺激时,MMP-9的mRNA表达量、酶活性以及分泌水平极低。当给予0.1~5.0μg/mL MALP-2作用18 h后,MMP-9的分泌水平显著增高,细胞培养上清液中MMP-9的酶活性也明显增强。此外,5.0μg/mL MALP-2刺激THP-1细胞6 h后即可诱导MMP-9 mRNA表达,16 h后达到峰值。结论 MALP-2可诱导人单核细胞表达MMP-9,这可能是支原体感染早期重要的致病因素。
支原体巨噬细胞活化脂肽-2;基质金属蛋白酶-9;单核细胞
支原体是一类缺乏细胞壁的原核细胞型微生物。目前已明确的对人类致病的支原体主要包括肺炎支原体(Mycoplasma. pneumoniae)、生殖支原体(M. genitalium)、人型支原体(M. hominis)等[1-3]。研究表明,支原体感染后所致的炎症反应主要与其细胞膜上的膜脂蛋白有关。支原体膜脂蛋白N末端的二酰甘油半胱氨酸结构是活化单核、巨噬细胞的基础[4]。巨噬细胞活化脂肽2(macrophage-activating lipopeptide-2,MALP-2)是根据支原体膜脂蛋白二酰甘油半胱氨酸结构人工合成的一种脂肽,它几乎所有支原体膜脂蛋白的免疫刺激活性,因此被广泛应用于支原体感染以及各种免疫机制相关研究[5-6]。支原体感染后可活化单核、巨噬细胞,并诱导其分泌一系列炎症相关介质,如细胞因子、趋化因子、活性氧类、前列腺素、一氧化氮等分子。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一类能降解细胞外基质(extracellular matrix,ECM)的酶类。多种因素可诱导MMPs的表达,如细胞因子、生长因子等。微生物感染后,可诱导单核细胞趋化至感染部位并分泌多种MMPs,从而参与炎症反应、组织重构、血管发生和伤口愈合。在所有的MMPs中,以MMP-9最重要。研究显示,MMP-9的分泌与气道高反应性有关,在哮喘和阻塞性肺疾病中,MMP-9的水平显著增高。这表明MMP-9可能与呼吸道炎症反应密切相关,但迄今为止缺乏支原体感染与MMP-9的相关报道。本研究通过体外实验观察MALP-2对人THP-1单核细胞分泌MMP-9的影响,探讨支原体潜在的致病机制。
1 材料与方法
1.1 主要实验材料 RPMI-1640培养基、胎牛血清、Trizol试剂为Invitrogen产品;FastStart Essential DNA Green Master购自Roche。人MMP-9 ELISA检测试剂盒购自深圳欣博盛生物有限公司。MMP-9酶活性检测试剂盒购自AnaSpec(SensoLyte® 490 MMP-9 Assay Kit)。
1.2 细胞培养与处理 人单核细胞系THP-1用含10%胎牛血清的RPMI-1640培养基培养,于37℃,5% CO2条件下培养。待细胞生长密度达到视野的80%时,将其接种至24孔板中(细胞数约5×105),加入终浓度为0、0.1、1.0和5.0 μg/mL MALP-2刺激18 h,或用5.0 μg/mL MALP-2刺激0~36 h,随后获取上清用于下一步研究。
1.3 MMP-9 mRNA水平分析 采用实时定量PCR(Real-time PCR)检测MMP-9 mRNA的表达。细胞经MALP-2孵育结束后,用Trizol试剂提取细胞总RNA并测量其浓度。取2 μg RNA用于Real-time PCR分析。设计MMP-9和GAPDH引物,并由上海生工合成。MMP-9引物序列分别为:5’-TTGACAGCGACAAGAAGTGG-3’(正向)和5’-GCCATTCACGTCGTCCTTAT-3’(反向);GAPDH:5’-AGGGCTGCTTTTAAC TCTGGT-3’(正向)和5’-CCCCACTTGATTTTGGAGGGA-3’。反应条件是: 94℃3 min,然后94℃ 30 s、50℃ 30 s、72℃ 30 s,总共40个循环(LightCycle @96)。所得数据与内参GAPDH之比作为相对值。
1.4 MMP-9酶活性检测 细胞经MALP-2刺激完毕后,获取培养上清,采用荧光共振能量转移(fluorescence resonance energy transfer,FRET)间接法测定MMP-9的酶活性。其原理为MMP-9可降解底物FRET peptide,从而使DabcylPlusTM无法淬灭荧光分子EDANS,后者可通过激化荧光而检测到,其荧光强度与MMP-9的活性成正比。具体操作根据AnaSpec公司提供的试剂盒操作步骤进行。在荧光酶标仪(Synergy HT,Bio-Tec)上测定其强度(激发/发射波长分别为340和490 nm),并计算各组与对照组的比值(相对活性)。
1.5 MMP-9分泌检测 细胞处理结束后,通过反复冻融以裂解细胞。经1000 r/min离心5 min后,弃沉淀,采用双抗体夹心ELISA法检测上清中MMP-9的含量。操作方法按照深圳欣博盛生物有限公司提供的试剂盒操作步骤进行。结果以相对含量表示(处理组吸光值/对照组吸光值×100%)。
1.6 统计学方法 所有实验数据重复3次,应用
SPSS 17.0软件进行统计学分析,数据用“x±s”表示,组间比较采用单因素方差分析数据,P<0.05为差异具有统计学意义。
2 结果
2.1 不同浓度MALP-2诱导THP-1细胞分泌MMP-9 THP-1细胞基础状态下MMP-9分泌水平极低。当给予0.1、1.0、5.0 μg/mL MALP-2作用18 h后,可显著诱导THP-1细胞分泌MMP-9,且随着MALP-2浓度的增加,MMP-9的分泌水平进一步增多。见图1。
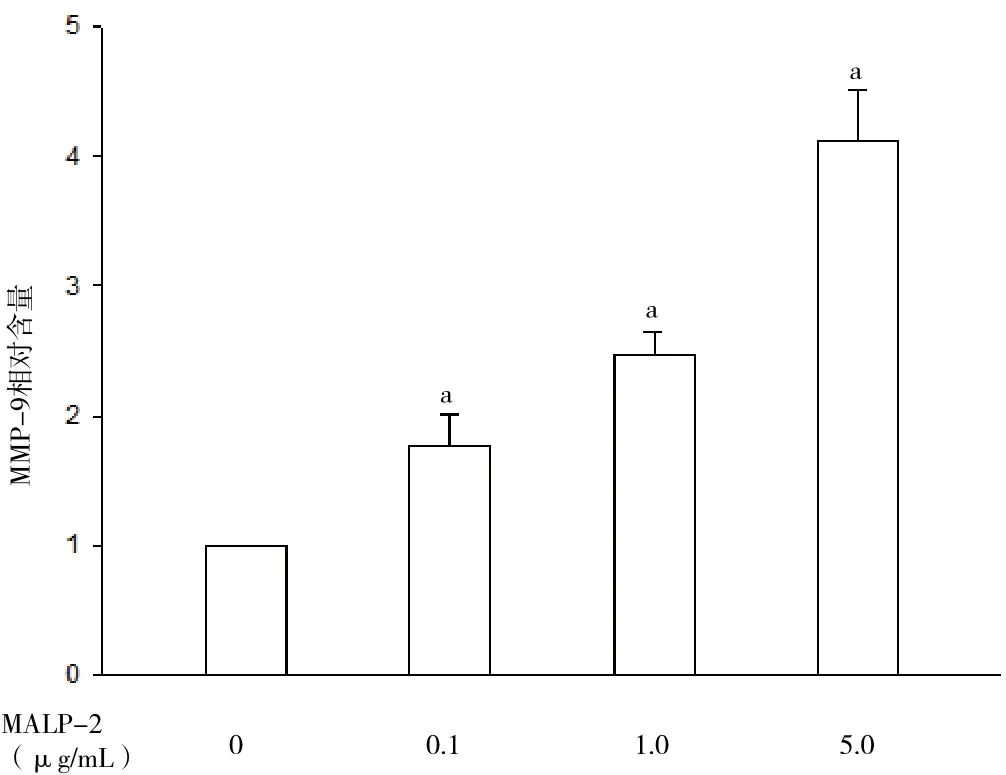
图1 不同浓度MALP-2对THP-1细胞分泌MMP-9的影响注:与对照组(0 μg/mL)相比,aP<0.05
2.2 MALP-2诱导THP-1细胞表达MMP-9 mRNA MALP-2处理THP-1细胞16 h后,也可上调细胞内mRNA的表达。当MALP-2浓度为5.0 μg/mL时,MMP-9 mRNA表达水平增加了4.3倍。见图2。

图2 不同浓度MALP-2对MMP-9 mRNA表达的影响注:与对照组(0 μg/mL)相比,aP<0.05
2.3 MALP-2作用不同时间对THP-1表达MMP-9的影响 MALP-2作用THP-1细胞6 h后即可上调MMP-9 mRNA表达,随着时间的延长,mRNA表达水平逐渐增高,16 h后达到峰值,并持续高表达至36 h。见图3。
2.4 不同浓度MALP-2对MMP-9活性的影响 THP-1细胞未刺激时,培养上清液中MMP-9酶活性很低。经不同浓度MALP-2作用后,MMP-9酶活性随着MALP-2浓度的增加而逐渐增强。见图4。
3 讨论
MMPs是一类Zn2+依赖性的肽链内切酶,可降解组织中的ECM。MMPs根据其结构可分为4个不同的功能区,分别为疏水信号肽区、催化区、前肽区、羧基末端区和铰链区。其中前肽区和酶催化活性区结构非常保守,但各种MMPs又具有不同的功能,如,不同的MMPs对底物具有专一性,但也非绝对[7]。同一种MMPs可降解多种ECM,而某些特定的ECM又可被多种MMPs降解。尽管如此,不同MMPs对同一ECM的降解效率也有所不同。MMPs家族根据底物特异性和结构相似性可大致分为胶原酶、间质溶解素、明胶酶、基质溶解因子和膜型金属蛋白酶[8]。其中明胶酶主要包括MMP-2和MMP-9,两者主要降解IV/V型胶原。研究表明,MMP-2和MMP-9广泛表达于白细胞、气道上皮细胞、血管内皮细胞以及肿瘤细胞等。MMP-2通常为组成性表达,而MMP-9为诱导型。在各种感染性疾病、炎症反应、血管病变和恶性肿瘤的发生过程中,MMP-9表达往往上调表达[9-10]。

图3 MALP-2作用不同时间对MMP-9 mRNA表达的影响注:与对照组(0 h)相比,aP<0.05

图4 不同浓度MALP-2对MMP-9酶活性的影响注:与对照组(0 μg/mL)相比,aP<0.05
研究表明,MMPs参与了支原体感染后的发病过程。Baluk等[11]研究发现,鼠支原体感染大鼠肺组织中MMP-2和MMP-9含量显著增高,但该过程与血管重构无关。随后Peltier[12]的研究也表明,鼠肺炎支原体感染妊娠期大鼠后,羊水中前MMP-9的分泌也显著增高。此外,肺炎支原体所致的社区获得性肺炎患者血清中MMP-9的含量也明显高于正常人群[13]。目前国内外的研究多集中在支原体感染动物模型或肺炎患者体内MMPs水平的检测及,而对于体外研究较少。本实验通过体外培养人单核细胞,采用支原体的病原相关分子模式MALP-2对MMP-9的分泌情况进行观察,结果显示,THP-1细胞未经MALP-2处理时,MMP-9 mRNA的表达水平、培养上清中MMP-9的分泌情况及酶活性较低。而当单核细胞与MALP-2作用后,上清中MMP-9的浓度显著增高,与临床肺炎支原体感染患者外周血中MMP-9变化趋势抑制。Real-time PCR也证实MALP-2刺激细胞6 h后即可上调其mRNA表达水平,并持续至36 h。MMP-2的表达同时也伴随有酶活性的增高。本研究采用荧光共振能量转移原理对MMP-9的酶活性进行观察,结果也发现,随着MALP-2浓度的增加,酶活性逐渐增强,与ELISA检测结果一致。
总之,支原体MALP-2能诱导并促进人单核细胞表达MMP-9,从而参与对ECM的降解。随着ECM的广泛降解,在感染早期会使更多的白细胞渗出至感染部位,或者促进支原体进一步扩散,从而加剧局部组织的破坏,促进疾病的发生发展。
[1] Citti C,Blanchard A.Mycoplasmas and their host:emerging and reemerging minimal pathogens[J].Trends Microbiol,2013,21(4):196-203.
[2] Catrein I,Herrmann R.The proteome of Mycoplasma pneumoniae,a supposedly "simple" cell[J].Proteomics,2011,11(18):3614-3632.
[3] McGowin CL,Radtke AL,Abraham K,et al.Mycoplasma genitalium infection activates cellular host defense and inflammation pathways in a 3-dimensional human endocervical epithelial cell model[J].J Infect Dis,2013,207(12):1857-1868.
[4] Quentmeier H,Schmitt E,Kirchhoff H,et al.Mycoplasma fermentansderived high-molecular-weight material induces interleukin-6 release in cultures of murine macrophages and human monocytes[J].Infect Immun,1990,58(5):1273-1280.
[5] Gao F,Brant KA,Ward RM,et al.Multiple protein kinase pathways mediate amplified IL-6 release by human lung fibroblasts coexposed to nickel and TLR-2 agonist,MALP-2[J].Toxicol Appl Pharmacol,2010,247(2):146-157.
[6] Sawahata R,Shime H,Yamazaki S,et al.Failure of mycoplasma lipoprotein MALP-2 to induce NK cell activation through dendritic cell TLR 2[J]. Microbes Infect,2011,13(4):350-358.
[7] Vandenbroucke RE,Libert C.Is there new hope for therapeutic matrix metalloproteinase inhibition?[J].Nat Rev Drug Discov,2014,13(12):904-927.
[8] Thomas NV,Manivasagan P,Kim SK.Potential matrix metalloproteinase inhibitors from edible marine algae:a review[J].Environ Toxicol Pharmacol,2014,37(3):1090-1100.
[9] 杨丽君,陈钟.OPN和MMP-9在结直肠癌中的表达及其与肝转移的相关性[J].当代医学,2012,18(12):7-9.
[10] 王海波,俞为荣.MMP-2/MMP-9在炎症中的研究进展[J].医学综述,2014,20(17):3120-3122.
[11] Baluk P,Raymond WW,Ator E,et al.Matrix metalloproteinase-2 and-9 expression increases in Mycoplasma-infected airways but is not required for microvascular remodeling[J].Am J Physiol Lung Cell Mol Physiol,2004,287(2):L 307-317.
[12] Peltier MR,Barney BM,Brown MB.Effect of experimental genital mycoplasmosis on production of matrix metalloproteinases in membranes and amniotic fluid of Sprague-Dawley rats[J].Am J Reprod Immunol,2007,57(2):116-121.
[13] Puljiz I,Markotic A,Cvetko KL,et al.Mycoplasma pneumoniae in adult community-acquired pneumonia increases matrix metalloproteinase-9 serum level and induces its gene expression in peripheral blood mononuclear cells[J].Med Sci Monit,2012,18(8):CR 500-505.
10.3969/j.issn.1009-4393.2015.29.002
国家自然科学基金(31370207)
湖南 421001 南华大学病原生物学研究所 (李媛媛 余敏君 游晓星 李冉辉 陈列松 朱翠明 文道林 曾焱华) 湖南 422000 邵阳市中心医院检验科( 李媛媛) 广东 518106 深圳市光明新区人民医院( 文道林)
曾焱华 E-mail:zengyihua 21 cn@126.com

