超大剂量甲泼尼龙治疗实验性变态反应性脑脊髓炎的疗效分析
危智盛 黄叶青 刁胜朋 洪铭范
超大剂量甲泼尼龙治疗实验性变态反应性脑脊髓炎的疗效分析
危智盛 黄叶青 刁胜朋 洪铭范
目的 研究超大剂量甲泼尼龙(MP)对实验性变态反应性脑脊髓炎(EAE)大鼠的治疗作用,探讨超大剂量MP能否提高疗效。方法 构建EAE大鼠模型,分为超大剂量组、小剂量组和模型对照组,分别予以尾静脉注射MP100mg/kg、25mg/kg、等体积生理盐水;另取正常大鼠为正常对照组,给予等体积生理盐水注射。连续给药5d,处死大鼠,采血检测血浆白细胞介素-2(IL-2)、肿瘤坏死因子-α(TNF-α)含量。取脑、脊髓组织行HE染色及髓鞘染色。对临床评分、炎性病灶计数、髓鞘脱失评分、细胞因子含量等进行综合评价。结果 超大剂量组和小剂量组大鼠经MP治疗前后临床评分差异均有统计学意义(P<0.05),组织炎性病灶数、髓鞘脱失评分及血浆IL-2、TNF-α含量均较模型对照组低。而超大剂量、小剂量组间在临床评分、炎性病灶数、髓鞘脱失评分、细胞因子含量等方面比较均无统计学差异。结论 两种剂量MP均能缓解EAE症状,改善病情,但临床疗效并不与剂量呈依赖性,在一定的有效剂量范围内,超大剂量MP并不能提高疗效。
甲泼尼龙;实验性变态反应性脑脊髓炎;糖皮质激素;白细胞介素-2;肿瘤坏死因子-α
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统(central nervous system,CNS)炎症性、脱髓鞘性自身免疫性疾病。对于MS急性发作和复发,循证医学A级证据推荐使用大剂量甲泼尼龙(methylprednisolone,MP)短程冲击治疗[1-2]。然而,目前MP使用剂量尚不统一,有学者认为2000mg/d MP冲击治疗MS,在一定程度上可优于500mg/d及1000mg/d[3-4]。也有研究表明大剂量与小剂量MP治疗MS在临床疗效上比较并无显著差异[5]。因此,目前临床医生常根据临床经验采用500mg/ d、1000mg/d或2000mg/d MP冲击治疗MS。由于使用大剂量糖皮质激素(glucocorticoid,GC)治疗同时可造成严重不良反应,因此,选择恰当的有效剂量是临床医生迫切关注的问题。目前相关的实验论证不多,且针对GC治疗MS或MS动物模型─实验性变态反应性脑脊髓炎(experimental allergic encephalomyelitis,EAE)的量效关系的研究甚少。本研究拟通过超大剂量MP对EAE大鼠进行冲击治疗,从临床评分、病理改变、细胞因子等多个角度观察,比较其与小剂量MP的疗效差异,探讨MP的量效关系,以证实超大剂量MP是否能提高疗效,为临床选择恰当的GC剂量治疗MS提供实验依据。
1 材料与方法
1.1 实验动物及主要试剂 雌性Wistar大鼠,6~8周龄,体质量180~200g;豚鼠,雌雄不限,体质量350~400g,购自南方医科大学医学实验动物中心。注射用甲泼尼龙琥珀酸钠(辉瑞公司);白细胞介素-2(interleukin-2,IL-2)及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)放射免疫检测试剂盒购自北京华英生物技术研究所。
1.2 EAE模型制备 参照文献[6]方法制备EAE模型。免疫接种后,每日观察大鼠反应,包括进食、体质量、行动等情况,并参照Becher的标准[7]对大鼠神经损害表现进行临床评分:正常或无任何神经缺损症状计为0分;尾巴远端无力计0.5分;尾巴完全无力计1分;尾巴无力并后肢无力计1.5分;单侧后肢部分瘫痪计2分;双侧后肢部分瘫痪计2.5分;双侧后肢完全瘫痪计3分;双后肢完全瘫痪并有一侧前肢瘫痪计3.5分;四肢瘫痪计4分;濒临死亡状态或死亡计5分。大鼠评分≥1分即为临床发病。
1.3 实验分组及给药 将EAE大鼠随机分成3组,分别为:(1)超大剂量组:8只,给予MP 100mg/kg,生理盐水稀释后自尾静脉注射;(2)小剂量组:8只,MP 25mg/kg,生理盐水稀释后自尾静脉注射;(3)模型对照组:7只,给予等体积生理盐水尾静脉注射;(4)另取5只未经造模的正常Wistar大鼠在同等条件下饲养作为正常对照组,给予等体积生理盐水尾静脉注射。在免疫接种第12天大鼠发病后开始给药,每天给药1次,连续给药3d后,MP减半量再给药2d,共给药5次。
1.4 血IL-2、TNF-α测定 给药5d后,各组大鼠于第6天进行临床评分,处死后剪断颈部血管,采血约2mL/只,入EDTA抗凝管,离心后提取血浆约1mL,-20℃保存。按照IL-2、TNF-α放免试剂盒操作步骤,应用中国科学技术大学科技实业总公司生产的GC-911γ放射免疫计数器检测大鼠血浆IL-2、TNF-α含量。
1.5 HE染色及髓鞘染色 取大鼠大脑视交叉层面2mm脑组织、小脑、脑干、脊髓颈膨大、腰膨大等部分,以4%多聚甲醛固定,常规石蜡包埋、切片,并进行HE染色及砂罗铬花青法(solochrome cyanin)髓鞘染色,光镜下观察脑、脊髓组织的形态学改变。对脊髓HE染色切片进行炎性病灶计数,参照标准[8]:呈袖套样改变或者超过15~20个炎性细胞浸润者记为1个炎性病灶。对脊髓组织髓鞘染色切片进行髓鞘脱失评分,参照评分标准[9]:(1)软脊膜下少量脱髓鞘改变,计1分;(2)软脊膜下和血管周围明显的脱髓鞘,计2分;(3)软脊膜下或血管周围见脱髓鞘斑块融合,计3分;(4)软脊膜下和血管周围见广泛的脱髓鞘并累及一半的脊髓,同时伴有中枢神经系统实质内炎性细胞的浸润,计4分;(5)广泛的软脊膜下和血管周围脱髓鞘并累及整个脊髓横断面,伴有中枢神经系统实质内的炎细胞浸润,计5分。
1.6 统计学方法 采用SPSS17.0软件进行统计分析,计量资料数据以“x±s”表示;治疗前后临床评分采用Wilcoxon秩检验,2组间的临床评分、髓鞘脱失评分采用Mann-Whitney u检验;多组间炎症病灶计数以及细胞因子含量的比较采用单因素方差分析,多组均数的两两比较采用LSD-t检验进行分析。
2 结果
2.1 临床评分比较 免疫诱导后,大鼠在第10天开始陆续发病,表现为进行性体质量下降、尾巴张力减退,继而尾巴无力,并可出现后肢及四肢无力、麻痹,伴有大小便失禁。超大剂量组和小剂量组大鼠经MP治疗后神经损害症状均得到明显改善,而模型对照组大鼠症状无改善,且部分大鼠症状加重。治疗组临床评分下降(P<0.05),而模型对照组评分加重(P<0.05)。超大剂量组与小剂量组治疗前后临床评分改变的差值比较,差异无统计学意义。见表1。

表1 EAE大鼠临床评分、炎性病灶数、髓鞘脱失评分比较(x±s)
2.2 炎性病灶数比较 EAE大鼠脑、脊髓组织HE染色镜下可见小血管充血、血管壁增厚、内皮细胞破坏,血管周围可见大量炎性细胞浸润,以淋巴细胞为主,形成典型的“袖套样(cuffing)”改变。而正常对照大鼠脑和脊髓均无异常。对脊髓切片中炎性病灶数进行比较,可见超大剂量组和小剂量组病灶计数显著较模型对照组减少(P<0.001),但超大剂量组与小剂量组之间比较病灶计数无统计学差异。
2.3 髓鞘脱失比较 砂罗铬花青法染色在光镜下可见髓鞘呈蓝色,胶原纤维呈粉红色,细胞核呈深蓝色,EAE大鼠脊髓组织可见髓鞘均有不同程度脱失。超大剂量和小剂量组髓鞘脱失评分均较模型对照组低(P<0.05),但超大剂量组与小剂量组间进行比较评分差异无统计学意义。
2.4 细胞因子比较 模型对照组大鼠血浆IL-2和
TNF-α含量均较正常对照组高(P<0.01);超大剂量组与小剂量组IL-2、TNF-α含量均较模型对照组低(P<0.05),但IL-2与正常对照组比较,差异无统计学意义,TNF-α仍高于正常水平,与正常对照组比较,差异有统计学意义(P<0.01)。超大剂量组与小剂量组间IL-2、TNF-α含量进行比较,差异均无统计学意义。见表2。
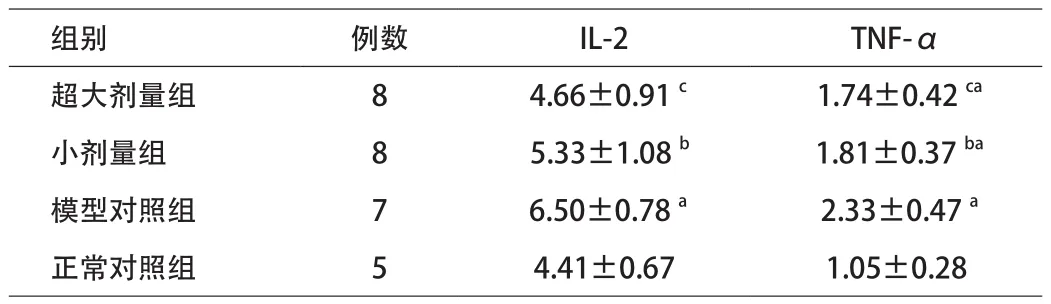
表2 各组大鼠血IL-2、TNF-α含量比较(ng/mL,x±s)
3 讨论
EAE是一种由特异性致敏的CD4+T细胞介导的,以CNS内小血管周围单个核细胞浸润及髓鞘脱失为主要特征的自身免疫性疾病[10]。其病理生理改变与人类MS极为相似,是目前国内外研究MS发病机制及实验性治疗的最适宜模型[11]。GC可以通过诱导T细胞凋亡,下调T细胞粘附分子及调节T细胞迁移等机制达到治疗EAE的作用[12]。研究已表明,EAE的病理变化与其病情的严重程度基本一致[13]。在MS及EAE,由于Th1细胞的过度活化,其表达的IL-2及TNF-α水平增高,而且其增高的程度可与疾病的严重程度相平行[14]。因此,我们从临床评分、炎性病灶数、髓鞘脱失评分、细胞因子等多个角度来比较超大剂量MP与小剂量MP对EAE病情改善的差异,探讨超大剂量MP能否优于小剂量MP,为临床优化GC治疗MS提供一定的实验依据。
本实验表明,超大剂量和小剂量MP治疗后,EAE大鼠神经损害症状均得到显著的改善,治疗前后临床评分比较,差异有统计学意义;超大剂量和小剂量组炎性病灶计数、髓鞘脱失评分、细胞因子IL-2和TNF-α含量均较模型对照组低。表明两种剂量MP均能缓解EAE症状,改善病情,缩短病程。然而,无论是从临床评分、炎性病灶计数、髓鞘脱失评分及细胞因子含量等多个方面进行比较,超大剂量与小剂量组间差异无统计学意义。因此,临床疗效并不与剂量呈依赖性。我们认为,在一定的有效剂量范围内,超大剂量MP尚不能提高疗效。
Schmidt等[15]曾以50mg/kg、10mg/kg、1mg/kg MP等作为大、中、小剂量治疗EAE大鼠,并分析其对T细胞凋亡的差异,结果表明,1mg/kg MP不能诱导T细胞凋亡,而50mg/ kg则优于10mg/kg。因此,我们采用25mg/kg作为为小剂量,100mg/kg为超大剂量,以此拉开剂量跨度,但结果并未发现这种两种剂量在临床评分、炎性病灶计数、髓鞘脱失评分及细胞因子含量等方面的疗效存在差异。本研究分析考虑有以下几点可能:(1)大鼠对药物的耐受范围较大。按照体表面积计算法对动物与人的剂量进行换算,大鼠每公斤体重剂量是人的6倍[16]。因此,在一定有效药物浓度内,大鼠剂量与疗效可能不呈依赖性。(2)糖皮质激素受体饱和。GC进入细胞浆后,与胞浆内GR的激素结合区结合,然后进入细胞核,启动并调控某些具有一定生物学效应的多肽、酶、细胞因子等基因的转录,从而发挥免疫抑制、抗炎等效应[17-18]。因此,当GR饱和后,增大GC剂量亦无法提高GC的生物效应。(3)实验样本量不够大。本实验MP治疗各组大鼠样本量尚不够大,可能在统计过程易出现偏差。对于MP剂量设计上也可能存在不足。以大鼠每公斤体重用药剂量相当于人的6倍为标准,本实验所用超大剂量100mg/kg MP,约相当于给予60kg体质量患者1000mg/d的MP冲击治疗,因此,今后我们还可以设计更大剂量MP,研究其对EAE大鼠的疗效。GC对MS或EAE的作用机制非常复杂,剂量与疗效关系的研究亦还有待更深入探讨。
[1] Kamm CP,Uitdehaag BM,Polman CH.Multiple Sclerosis:Current Knowledge and Future Outlook[J].Eur Neurol,2014,72(3-4):132-141.
[2] 李梦秋,胡佳,司洋,等.多发性硬化治疗措施的临床证据评价[J].中国现代神经疾病杂志,2012,12(2):152-157.
[3] Oliveri RL,Valentino P,Russo C,et al.Randomized trial comparing two different high doses of methylprednisolone in MS:a clinical and MRI study[J].Neurology,1998,50(6):1833-1836.
[4] Fierro B,Salemi G,Brighina F,et al.A transcranial magnetic stimulation study evaluating methylprednisolone treatment in multiple sclerosis[J].Acta Neurol Scand,2002,105(3):152-157.
[5] Miller DM,Weinstock-Guttman B,Béthoux F,et al.A meta-analysis of methylprednisolone in recovery from multiple sclerosis exacerbations[J]. Mult Scler,2000,6(4):267-273.
[6] Tian DH,Perera CJ,Apostolopoulos V,et al.Effects of vaccination with altered Peptide ligand on chronic pain in experimental autoimmune encephalomyelitis,an animal model of multiple sclerosis[J].Front Neurol,2013,4:168.
[7] Becher B,Durell BG,Noelle RJ.Experimental autoimmune encephalitis and inflammation in the absence of interleukin-12[J].J Clin Invest,2002,110(4):493-497.
[8] Sobel RA,Blanchette BW,Bhan AK,et al.The immunopathology of experimental allergic encephalomyelitis.I.Quantitative analysis of inflammatory cells in situ[J].J Immunol,1984,132(5):2393-2401.
[9] Zappia E,Casazza S,Pedemonte E,et al.Mesenchymal stem cells ameliorate experimental autoimmune encephalomyelitis inducing T-cell anergy[J]. Blood,2005,106(5):1755-1761.
[10] Klaren RE,Motl RW,Woods JA,et al.Effects of exercise in experimental autoimmune encephalomyelitis (an animal model of multiple sclerosis)[J].J Neuroimmunol,2014,274(1-2):14-19.
[11] Rangachari M,Kuchroo VK.Using EAE to better understand principles of immune function and autoimmune pathology[J].J Autoimmun,2013,45:31-39.
[12] Schweingruber N,Fischer HJ,Fischer L,et al.Chemokinemediated redirection of T cells constitutes a critical mechanism of glucocorticoid therapy in autoimmune CNS responses[J].Acta Neuropath ol,2014,127(5):713-729.
[13] 陆正齐,朱灿胜,郑雪平,等.不同抗原诱导不同动物多发性硬化模型的比较[J].中山大学学报(医学科学版),2008,29(6):684-689.
[14] Monteiro de Castro G,Eduarda Zanin M,Ventura-Oliveira D,et al.Th1 and Th2 cytokine immunomodulation by gangliosides in experimental autoimmune encephalomyelitis[J].Cytokine,2004,26(4):155-163.
[15] Schmidt J,Gold R,Schönrock L,et al.T-cell apoptosis in situ in experimental autoimmune encephalomyelitis following methylprednisolone pulse therapy[J].Brain,2000,123 (Pt7):1431-1441.
[16] Reagan-Shaw S,Nihal M,Ahmad N.Dose translation from animal to human studies revisited[J].FASEB J,2008,22(3):659-661.
[17] Quax RA,Manenschijn L,Koper JW,et al.Glucocorticoid sensitivity in health and disease[J].Nat Rev Endocrinol,2013,9(11):670-686.
[18] Gomez FP,Steelman AJ,Young CR,et al.Hormone and immune system interactions in demyelinating disease[J].Horm Behav,2013,63(2):315-321.
Objective To evaluate the therapeutic effects of super-high dose of methylprednisolone (MP) in experimental allergic encephalomyelitis (EAE), and to investigate whether a super-high dose of MP improves its efficacy. Methods EAE models were induced by Wistar rats, and then the EAE rats were randomly divided into three groups (super high-dose group, low-dose group, and model control group). Super highdose group and low-dose group were given MP at a dose of 100 and 25 mg/kg i.v., respectively. Model control group and normal control groups were injected with an equivalent volume of 0.9% saline solution. The rats were sacrificed after five consecutive days therapy, then the plasma concentrations of interleukin-2 (IL-2) and tumor necrosis factor-α (TNF-α) were measured by radioimmunoassay. Pathological feature and myelin of spinal cord was observed by HE staining and myelin staining respectively. The efficacy of super high-dose and low-dose MP was evaluated by analyzing clinical score changes, demyelination scores, inflammatory foci and the cytokine concentrations. Results The clinical scores of EAE rats in super high-dose and low-dose group after MP treatment were significantly lower than that before treatment, and the counts of inflammatory foci, scores of demyelination and concentrations of IL-2 and TNF-α in super high-dose and low-dose group were significantly lower than that in model control group. However, there were no significant differences in those aspects between super high-dose group and low-dose groups. Conclusion Both MP doses had similar therapeutic effects, but there is no dependent correlation between dosage and therapeutic effects, to some effective dose range, super high-dose of MP does not improve efficacy.
Methylprednisolone; Experimental allergic encephalomyelitis; Glucocorticoid; Interleukin-2; Tumor necrosis factor-α
10.3969/j.issn.1009-4393.2015.16.001
广东 510080 广东药学院附属第一医院神经内科 (危智盛 黄叶青 刁胜朋 洪铭范)

