伊立替康联合顺铂或5-FU治疗UGT1A1*28野生型TA6/6患者不良反应的比较
秦琼 黄镜 杨林 周爱萍 陶云霞 王金万#
1天津医科大学总医院肿瘤科,天津300052
2中国医院科学院肿瘤医院肿瘤内科,北京100021
3江苏省徐州市中心医院肿瘤科,徐州221009
伊立替康联合顺铂或5-FU治疗UGT1A1*28野生型TA6/6患者不良反应的比较
秦琼1黄镜2杨林2周爱萍2陶云霞3王金万2#
1天津医科大学总医院肿瘤科,天津300052
2中国医院科学院肿瘤医院肿瘤内科,北京100021
3江苏省徐州市中心医院肿瘤科,徐州221009
目的比较尿苷二磷酸葡萄糖醛酸转移酶1A1(UGT1A1)*28启动子为野生型的TA6/6患者在使用伊立替康(irinotecan,CPT-11)联合顺铂与CPT-11联合5-FU/亚叶酸钙治疗时不良反应方面的差异。方法根据采取的治疗方案将98例UGT1A1*28野生型TA6/6患者分为CPT-11联合顺铂组(IP组,n=47)和CPT-11联合5-FU/亚叶酸钙组(FOLFIRI组,n=51),对患者进行UGT1A1*28启动子多态性检测,比较不良反应差异。结果在总体3~4级不良反应方面,IP组的发生率(61.7%)明显高于FOLFIRI组(39.2%),且组间差异具有统计学意义(P=0.026)。在血液学不良反应方面,IP组3~4级白细胞减少、中性粒细胞减少、血小板减少和血红蛋白减少发生率分别为34.0%、51.1%、14.9%和8.5%,FOLFIRI组的发生率分别为11.8%、29.4%、2.0%、0,组间差异均有统计学意义(均P<0.05);在非血液学方面,FOLFIRI组3~4级迟发性腹泻发生率为9.8%,IP组未发生3~4级腹泻,两组间发生率的差异有统计学意义(P=0.028)。结论UGT1A1*28野生型TA6/6患者在接受CPT-11联合顺铂和CPT-11联合5-FU/亚叶酸钙两种化疗方案治疗的不良反应谱存在差异;应用CPT-11时,不但要考虑到UGT1A1*28启动子多态性对不良反应的影响,而且还要考虑CPT-11联合不同药物出现不良反应情况。
伊立替康;顺铂;5-FU;不良反应;UGT1A1*28野生型
Oncol Prog,2015,13(4)
伊立替康为半合成水溶性喜树碱衍生物,是DNA拓扑异构酶Ⅰ抑制剂,对结直肠癌、胃癌、肺癌、胰腺癌、卵巢癌等多种实体瘤有效[1]。CPT-11的主要不良反应是3~4级中性粒细胞减少和迟发性腹泻[2],尤其是严重迟发性腹泻的发生限制了其在临床上的广泛应用,因此预测其不良反应的发生尤为重要。国外Meta分析的结果显示在CPT-11高剂量组(>125mg/m2)中,3~4级迟发性腹泻、中性粒细胞减少的发生与UGT1A1*28位点启动子的多态性具有相关性:与UGT1A1*28野生型TA6/6患者相比,UGT1A1*28杂合突变型TA6/7患者、UGT1A1*28纯合突变型TA7/7患者发生3~4级腹泻的风险明显升高(OR=1.92,95%CI:1.31~2.82,P=0.001;OR=3.69,95%CI:2.00~6.83,P<0.001)[3];与UGT1A1*28野生型TA6/6患者和 UGT1A*28杂合型 TA7/6患者相比,UGT1A1*28纯合突变型TA7/7患者发生3~4级中性粒细胞减少的风险明显升高(OR=27.8,95% CI:4.0~195,P=0.005;OR=3.22,95%CI:1.52~6.81,P=0.008)[4]。国内学者也认为UGT1A1*28基因多态性与CPT-11所致3级及以上迟发性腹泻和中性粒细胞减少相关[5-6]。即使在UGT1A1*28野生型TA6/6患者中,CPT-11联合不同化疗药物所致的不良反应也存在差异。而UGT1A1*28野生型TA6/6患者在中国人群中所占比例最高,为72.9%~77.2%[5,7-9],因此,针对这类患者,分析CPT-11联合不同化疗药物不良反应的差异对指导临床工作意义重大。
1 资料和方法
1.1 临床资料
收集2011年3月至2013年5月中国医学科学院肿瘤医院内科收治的符合入组条件的患者的临床资料。入组条件:经病理学证实的晚期胃癌和结直肠癌患者;患者年龄≥18岁;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~2分;预计生存时间≥3个月;中性粒细胞≥1.5×109/L,血小板≥80×109/L;经UGT1A1*28基因检测为UGT1A1*28野生型TA6/6的患者;初次使用含CPT-11联合顺铂或者CPT-11联合5-FU/亚叶酸钙化疗方案;心肺功能基本正常。
1.2 治疗方案
根据所采取的治疗方案将患者分为CPT-11联合顺铂组(IP组)和CPT-11联合5-FU/亚叶酸钙组(FOLFIRI组)。具体用药方案如下:
CPT-11联合顺铂组(IP组):CPT-11 100~125 mg/m2静脉滴注90分钟,d1;DDP 50~60mg/m2静脉滴注≥2小时,d2;每14天重复。
CPT-11联合5-FU/亚叶酸钙组(FOLFIRI组):CPT-11 180 mg/m2静脉滴注90分钟,d1;CF 200 mg/m2静脉滴注2小时,5-FU 400mg/m2静脉滴注,d1、d2,5-FU 600mg/m2持续滴注22小时,d1、d2。或改良FOLFIRI:CPT-11 180 mg/m2静脉滴注90分钟,d1;CF 200mg/m2静脉滴注2小时,5-FU 400 mg/m2静脉滴注,d1,5-FU 2400mg/m2持续滴注44小时;每14天重复。
1.3 毒性反应评价标准
依据美国国立癌症研究所(National Cancer Institute,NCI)的常见不良反应评价标准(common term inology criteria for adverse events,CTCAE)3.0版对毒性反应进行评价分级。所有患者于下一个治疗周期的前1天进行毒性反应评价,将治疗期间出现的最严重不良反应作为最终的不良反应。
1.4UGT1A1基因启动子基因型的检测
化疗前采集患者血液,采用Qiagen试剂盒(上海源奇生物医药科技有限公司)提取基因组DNA,并严格按照说明书操作,使DNA纯级合格;设计引物序列,正向引物序列为5′-AAATTCCAGCCAGTTCAACTGTT-3′,反向引物序列为5′-CTGCTGGATGGCCCCAAG-3′;对抽取物进行PCR扩增,扩增程序为:42℃,5 m in;94℃,5 m in;(94℃,15 s;55℃,25 s;72℃,50 s)40个循环;72℃,5min。将PCR产物和标准分子量内标混合,进行毛细管电泳。电泳时,带有荧光染料标记的DNA片段按片段大小依次通过测序仪的检测窗口,由激光诱发荧光而检测。用GeneMapper软件分析检测结果。
1.5 统计学分析
采用SPSS 16.0软件进行统计学分析。采用χ2检验或Fisher精确检验,比较IP组和FOLFIRI组在迟发性腹泻、中性粒细胞减少、血小板减少及其他化疗不良反应方面的差异。检验水准α=0.05。
2 结果
2.1 两组患者的基本资料
IP组有47例患者,全部为晚期胃癌患者,中位年龄为56岁(33~69岁),随访周期为2~8个周期,中位随访时间为4周期;FOLFIRI组有51例患者,其中有16例为晚期胃癌患者,35例为晚期结直肠癌患者,中位年龄为59岁(36~76岁),随访周期为3~12周期,中位随访时间为5周期。两组患者在年龄、性别、ECOG评分等方面的差异均无统计学意义(P>0.05),具体见表1。在肿瘤原发部位方面IP组患者全部为胃癌,而FOLFIRI组患者以结直肠癌为主,胃癌所占的比例在两组间的差异有统计学意义(P<0.001)。
2.2 两组患者不良反应发生情况的比较
总体上,IP组的3~4级不良反应发生率明显高于FOLFIRI组,两组差异具有统计学意义(61.7%vs 39.2%;HR=1.57,95%CI:1.045~2.369;P=0.026)。在血液学不良反应方面,IP组的3~4级不良反应(包括白细胞减少、中性粒细胞减少、血小板减少和血红蛋白减少)的发生率也明显高于FOLFIRI组,组间差异均具有统计学意义(P<0.05);并且IP组的3~4级血液学不良反应的发生时间明显早于FOLFIRI组(中位周期分别为第1周期和第3周期)。在非血液学不良反应方面,FOLFIRI组的3~4级迟发性腹泻发生率要明显高于IP组,两组间的差异具有统计学意义(P=0.028)。另外,在总体不良反应方面,两组间呕吐、黏膜炎、白细胞减少、血小板减少、血红蛋白减少的发生率差异具有统计学意义(均P<0.05)。(表2)
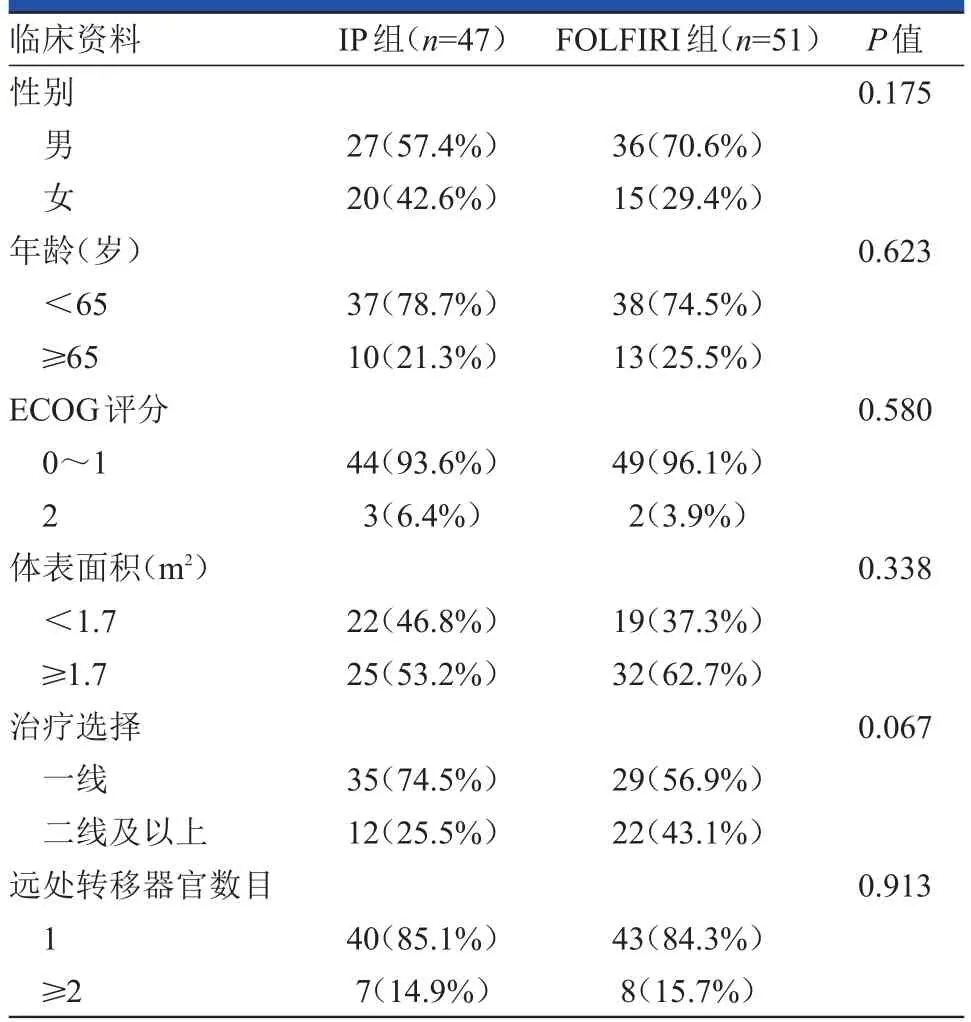
表1 两组患者的基本资料比较
2.3 接受一线和二线治疗的患者的不良反应发生情况比较
在IP组中,接受一线治疗和接受二线治疗的患者,其3~4级血液学不良反应发生率差异无统计学意义(均P<0.05)。同样,在FOLFIRI组中,接受一线治疗和接受二线治疗的患者,其3~4级迟发性腹泻和血液学不良反应的发生率差异无统计学意义(均P<0.05)。(表3)
3 讨论
UGT1A是影响CPT-11代谢灭活途径的关键酶,其中UGT1A1*28基因启动子多态性与CPT-11所致不良反应的关系最为密切。既往国内外研究主要探讨UGT1A1*28基因启动子多态性与迟发性腹泻、血液学不良反应的关系,认为UGT1A1* 28启动子野生型TA6/6患者对CPT-11的耐受性较好,不良反应发生率较低[4-5]。而对于UGT1A1*28启动子野生型TA6/6患者接受CPT-11联合顺铂和联合5-FU治疗的不良反应发生率是否存在差异,国内外相关研究尚少。
本研究除肿瘤原发部位不同外,两组间患者的其他基本资料无统计学差异,具有可比性。在不良反应方面,无论是IP组还是FOLFIRI组总体不良反应谱和既往报道一致,但发生率均低于既往类似剂量级治疗时的发生情况[10-12]。同时,本研究中FOLFIRI组不良反应要略低于既往报道[13-14]。出现以上情况的原因可能是在本研究中将UGT1A1*28杂合突变型TA7/6和UGT1A1*28纯合突变型TA7/7患者被剔除,而这两种基因型患者被认为是会明显增加3~4级毒副反应的发生。

表2 两组的不良反应发生情况的比较

表3 接受一线治疗和接受二线治疗的患者的3~4级不良反应发生情况比较
然而,两组患者毒副反应谱方面存在明显差异。首先,在3~4级迟发性腹泻及中性粒细胞减少的发生率方面两组差异明显。最有可能的原因是CPT-11联合药物的不同导致。CPT-11在体内需要转换成7-乙基-10-羟喜树碱(SN38)才能发挥抗肿瘤的活性,而SN38也是导致CPT-11相关不良反应的主要原因。Sasaki等报道持续滴注5-Fu可能减缓CPT-11转换成SN38[15];在CPT-11转换为SN38速度方面,在CPT-11联合顺铂组要明显高于CPT-11联合持续5-Fu泵入组,前者约为后者3倍,而在SN38转换成SN38G速度方面两组间并没有明显差异[16-17],因此,高浓度SN38可增加3~4级迟发性腹泻、粒细胞减少和口腔黏膜炎的发生。其次,两组患者在贫血的发生率方面也存在差异,一方面是可能和高浓度SN38对骨髓造血抑制作用更强相关;另一方面可能是和两组患者肿瘤原发部位不同相关,IP组所有患者为晚期胃癌,贫血的发生率高可能与胃癌的发生破坏胃壁细胞或者行全胃切除术后引起血红蛋白生成障碍相关,而FOLFIRI组患者主要为结直肠癌患者,因此,贫血的发生相对较少。此外,UGT1A1基因其他位点突变也可能会影响毒副反应,其中在亚洲人群中比较常见的是UGT1A1*6基因多态性。韩国学者报道,UGT1A1*6/*6基因型可能和CPT-11导致的严重不良反应相关[17];但是国内学者对于UGT1A1*6基因多态性研究的结论不一致:王等认为UGT1A1*6位点多态性和3~4级迟发性腹泻和粒细胞减少无关[5],但吕等认为UGT1A1*6位点多态性和3~4级迟发性腹泻和粒细胞减少相关[18],因此,对于UGT1A1*6位点多态性和CPT-11严重毒副反应相关性有待进一步证实。
同时,本研究还发现在CPT-11用药剂量方面IP组要明显低于FOLFIRI组(≤125 mg/m2vs 180 mg/m2),但即便如此IP组患者出现3~4级中性粒细胞减少的发生率仍明显高于常规剂量的FOLFIRI组,因此,在使用该方案时,更要密切关注患者的血象变化,以便及时给予患者必要的集落粒细胞刺激因子治疗,以免引起更严重的后果。综上可知,在UGT1A1*28野生型TA6/6患者中,CPT-11联合不同药物组合治疗所产生的严重不良反应有非常明显的差异。因此,在临床应用CPT-11时,不仅要考虑到UGT1A1*28启动子多态性对不良反应的影响,更要考虑到CPT-11联合不同药物出现不良反应情况,尤其是联合顺铂时,骨髓抑制明显而且出现早,须密切观察并及时处理。
[1]王丽焱,汤致强.抗肿瘤药伊立替康的研究进展[J].国外医学药学分册,2004,31(1):7-11.
[2]Toffoli G,Cecchin E,Gasparini G,et al.Genotype-driven phase I study of irinotecan adm inistered in combination w ith fluorouracil/leucovorin in patients w ith metastatic colorectal cancer[J].J Clin Oncol,2010,28(5): 866-871.
[3]Hoskins JM,Goldberg RM,Qu P,et al.UGT1A1*28 genotype and irinotecan-induced neutropenia:dose matters[J].JNatl Cancer Inst,2007,99(17):1290-1295.
[4]Hu ZY,Yu Q,Zhao YS.Dose-dependent association between UGT1A1*28 polymorphism and irinotecan-induced diarrhoea:ameta-analysis[J].Eur JCancer,2010, 46(10):1856-1865.
[5]王岩,徐建明,沈琳,等.中国人尿苷二磷酸葡糖苷酸转移酶1A基因多态性与伊立替康毒性的相关性[J].中华肿瘤杂志,2007,29(12):913-916.
[6]秦琼,杨林,周爱萍,等.尿苷二磷酸葡萄糖醛酸转移酶1A1*28基因多态性和伊立替康毒副反应相关性研究[J].癌症进展,2013,11(4):369-373;387.
[7]季楚舒,何义富,胡冰,等.UGT1A1*28基因多态性与晚期结直肠癌伊立替康化疗疗效及不良反应的关系[J].肿瘤,2010,30(10):870-874.
[8]杨立学,马韬,张俊,等.伊立替康化学治疗的不良反应与UGT1A1*28基因多态性的关系[J].内科理论与实践,2009,4(4):300-304.
[9]Zhang A,Xing Q,Qin S,et al.Intra-ethnic differences in genetic variants of the UGT-glucuronosyltransferase 1A1 gene in Chinese populations[J].Pharmacogenomics J,2007,7(5):333-338.
[10]Pozzo C,Barone C,Szanto J,etal.Irinotecan in combination w ith 5-fluorouracil and folinic acid orw ith cisplatin in patients w ith advanced gastric or esophageal-gastric junction adenocarcinoma:results of a random ized phase IIstudy[J].Ann Oncol,2004,15(12):1773-1781.
[11]Boku N,Yamamoto S,Fukuda H,et al.Fluorouracil versus combination of irinotecan plus cisplatin versus S-1 in metastatic gastric cancer:a randomised phase 3 study[J].Lancet Oncol,2009,10(11):1063-1069.
[12]Park SH,Nam E,Park J,et al.Randomized phase II study of irinotecan,leucovorin and 5-fluorouracil(ILF) versus cisplatin plus ILF(PILF)combination chemotherapy for advanced gastric cancer[J].Ann Oncol, 2008,19(4):729-733.
[13]Colucci G,Gebbia V,Paoletti G,et al.Phase III random ized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer:a multicenter study of the Gruppo Oncologico Dell′Italia Meridionale [J].JClin Oncol,2005,23(22):4866-4875.
[14]刘华敏,梁军,赵建东,等.伊立替康联合氟尿嘧啶/醛氢叶酸治疗晚期大肠癌[J].临床肿瘤学杂志,2006,11(5):377-379.
[15]Sasaki Y,Ohtsu A,Shimada Y,et al.Simultaneous administration of CPT-11 and fluorouracil:alteration of the pharmacokinetics of CPT-11 and SN-38 in patients w ith advanced colorectal cancer[J].J Natl Cancer Inst, 1994,86(14):1096-1098.
[16]Falcone A,Di Paolo A,Masi G,et al.Sequence effect of irinotecan and fluorouracil treatment on pharmacokinetics and toxicity in chemotherapy-naive metastatic colorectal cancer patients[J].J Clin Oncol,2001,19 (15):3456-3462.
[17]Han JY,Lim HS,Shin ES,et al.Comprehensive analysis of UGT1A polymorphisms predictive for pharmacokinetics and treatment outcome in patients w ith nonsmall-cell lung cancer treated w ith irinotecan and cisplatin[J].JClin Oncol,2006,24(15):2237-2244.
[18]吕雅蕾,刘巍,杜玉娟,等.UGT1A1基因多态性与伊立替康安全性和有效性的临床研究[J].中国肿瘤临床,2012,39(20):1542-1546.
Comparison of irinotecan plus cisplatin versus irinotecan plus infusional fluorouracil/ leucovorin inmanagementof adverseevents in patientsw ith UGT1A1*28w ild genotype
QIN Qiong1HUANG Jing2YANG Lin2ZHOU Ai-ping2TAO Yun-xia3WANG Jin-wan2#1DepartmentofOncology,Tianjin MedicalUniversity GeneralHospital,Tianjin 300052,China
2DepartmentofMedicalOncology,Chinese Academy ofMedicalSciences,CancerHospital,Beijing 100021,China3Departmentof Oncology,Xuzhou CentralHospital,Xuzhou 221009,China
ObjectiveTo investigate the difference regarding adverse events management between irinotecan (CPT-11)plus cisplatin or plus fluorouracil/leucovorin in patients w ith UGT1A1*28 w ild genotype(TA6/6).MethodGenomic DNA was extracted from peripheral blood to identify the UGT1A1*28 w ild genotype(TA6/6)in patients treated w ith both irinotecan-contained chemotherapy.Irinotecan plus cisplatin(IP group,n=47)and irinotecan plus flu-orouracil/leucovorin(FOLFIRI group,n=51)were compared in patients w ith UGT1A1*28 w ild genotype TA6/6.c2 testwas used to investigate the difference of toxicity between IP group and FOLFIRIgroup.ResultThe overall incidence of grade 3 or 4 toxicity was higher in IP group than in FOLFIRI group(61.7%vs 39.2%;HR=1.57,95%CI: 1.045-2.369;P=0.026).Serious hematological toxicity was also higher in IP group compared w ith the FOLFIRIgroup in respect of grade 3/4 neutropenia(51.1%vs 29.4%,P=0.029),grade 3/4 anem ia(8.5%vs 0,P=0.033)and grade 3/ 4 thrombocytopenia(14.9%vs 2.0%,P=0.019).However,grade 3/4 delayed diarrhea wasmore common in FOLFIRI group than in IP group(9.8%vs 0,P=0.028).ConclusionThe adverse events profile was different in IP-and FOLFIRI-treated patients w ith UGT1A1*28 w ild genotype(TA6/6).As in CPT-11 adm inistration,not only the polymorphism of UGT1A1*28 promotor,but also the adverse events profile of CPT-11 in combination w ith differentmedication should be considered.
irinotecan;cisplatin;fluorouracil;adverse events;UGT1A1*28 w ild genotype
R735.2
A
10.11877/j.issn.1672-1535.2015.13.04.13
#通信作者(corresponding author),e-mail:jwwang@csco.org.cn
2014-11-23)

