响应面法优化黑曲霉产α-葡萄糖苷酶发酵条件
陆兵,武玉莹,李志弘,梁钰婷,王超,黄桂华,梁智群,*(.广西大学生命科学与技术学院,广西南宁530004;2.广西大学亚热带农业资源保护与利用国家重点实验室,广西南宁530004)
响应面法优化黑曲霉产α-葡萄糖苷酶发酵条件
陆兵1,2,武玉莹1,2,李志弘1,2,梁钰婷1,2,王超1,黄桂华1,2,梁智群1,2,*
(1.广西大学生命科学与技术学院,广西南宁530004;2.广西大学亚热带农业资源保护与利用国家重点实验室,广西南宁530004)
摘要:在液体发酵单因素研究的基础上,通过二水平设计的Plackett-Burman试验确定3个对黑曲霉产α-葡萄糖苷酶影响的关键因素:玉米淀粉用量、装液量和温度。再通过最陡爬坡实验逼近最大酶活区。最后利用响应面法中的Box-Behnken试验设计,进行三因素三水平的响应面分析,以期获得黑曲霉产α-葡萄糖苷酶最优的发酵培养基和发酵条件。优化结果表明,黑曲霉产葡萄糖苷酶最优条件为:玉米淀粉55.8 g/L,玉米浆干粉30 g/L,接种量4%(体积分数),装液量49.3mL(500mL摇瓶),摇床转速240 r/min,初始pH4.8,发酵温度36.3℃。优化后α-葡萄糖苷酶活为375.5U/mL。
关键词:黑曲霉;α-葡萄糖苷酶;响应面法;发酵条件优化
α-葡萄糖苷酶(α-glucosidase,EC 3.2.1.20)是水解酶类中的一种,属于水解酶13类31家族[1]。它可以从多糖的非还原末端切开α-1,4糖苷键[2],产生葡萄糖,表现出水解酶活性;同时,它也可以把游离出来的葡萄糖基转移到另一个糖上形成α-1,6糖苷键[3],表现出转苷酶活性。
黑曲霉是主要产α-葡萄糖苷酶的菌株之一[4-5]。黑曲霉产生的α-葡萄糖苷酶能将麦芽糖的α-1,4糖苷键水解,然后与另一个麦芽糖形成α-1,6糖苷键或分子内转苷形成异麦芽糖[6],从而得到具有特殊生理功能的低聚异麦芽糖。低聚异麦芽糖最明显的生理功能在于它能促使肠道类有益于人体的微生物菌群生长和相比于其它糖类而言服用者不会产生肥胖和血糖升高[7]。低聚异麦芽糖以它良好的功效,越来越受到人们的青睐,低聚异麦芽糖的销量也逐年增加,所以低聚异麦芽糖的研究有一个良好的前景[8]。
制约我国低聚异麦芽糖生产的关键因素是α-葡萄糖苷酶,目前国内α-葡萄糖苷酶主要依靠进口,造成低聚异麦芽糖成本过高[9]。为了提高α-葡萄糖苷酶的活性,国内外很多学者也进行了探讨。例如,通过诱变育种选育酶活较高的菌株,基因的克隆与表达或单因素进行培养基和发酵条件的优化[10-13]。通过诱变育种和单因素优化发酵条件,虽然取得了一定的效果,但难以确定培养基组分之间和发酵条件各因素之间的相互作用关系[14]。因此,本研究在单因素试验的基础上,利用响应面法进一步深入研究各因素之间的相互作用关系,从而得到黑曲霉产α-葡萄糖苷酶的最佳发酵条件。
1 材料与方法
1.1材料与试剂
1.1.1菌种
实验室保藏菌种黑曲霉Aspergillusniger J2。
1.1.2试剂
玉米浆干粉:山东康源有限公司;玉米淀粉:山东西王淀粉厂;高温α-淀粉酶:广西南宁东恒华道生物;麸皮:中国河北省;葡萄糖等试剂均为国产分析纯。
1.2仪器与设备
METTLERTOLEDOPL303精密电子天平、320 pH计:德国METTLER公司;SPX-250恒温培养箱:上海跃进医疗器械厂;SKJH-1109超净工作台、SKY-211B振荡培养箱:上海苏坤实业有限公司;Uvmini-1240分光光度计:日本岛津公司。
1.3方法
1.3.1培养基配制
菌种斜面培养基(g/L):葡萄糖100,麸皮浸汁100,琼脂18。
孢子培养基(g/L):麸皮8,水3。
种子培养基(g/L):麸皮浸汁60,葡萄糖15,pH自然。
产酶发酵培养基(g/L):玉米淀粉60,玉米浆干粉30,pH5.5。
1.3.2培养方法
将菌株接种于菌种斜面培养基上,37℃培养48 h后,用已灭菌的生理盐水溶液冲洗斜面于装有玻璃珠的三角瓶中,30℃恒温振荡2 h,再用脱脂棉过滤,即为孢子悬液。采用血球计数板计数并调整其浓度为106个/m L。将1 m L孢子悬液接种到种子培养基中,28℃,180 r/min振荡培养16 h。将培养16 h后的种子发酵液体积按2%的接种量接种到50mL产酶发酵培养基中,34℃,220 r/min振荡培养48 h。
1.3.3α-葡萄糖苷酶酶活测定方法
取粗酶液1mL,加入40℃预热的0.2mol/L醋酸缓冲液和2%α-MG溶液各0.5mL,40℃反应1 h后,沸水浴灭酶10min。取0.2mL反应液,加2mLDNS,沸水浴2min,迅速冷却,用紫外分光光度计在550 nm测吸光值。
酶活力定义:在上述条件下,每小时由底物生成1μg葡萄糖量所需酶量为1U。
1.3.4还原糖的测定
还原糖的测定采用DNS法[15]。
1.4试验方法
1.4.1单因素试验
初始发酵条件为碳源用量60 g/L,氮源用量30g/L,摇床转速220 r/min,装液量50mL(500mL摇瓶),pH 5.5,发酵温度34℃。通过单因素试验确定最佳发酵产酶的碳源、氮源、摇床转速、装液量、初始pH和发酵温度。
1.4.2Plackett-Burman试验设计
在单因素试验的基础上,利用Plackett-Burman试验从7个因素(碳源、氮源、摇床转速、装液量、初始pH和发酵温度)中筛选出对黑曲霉产葡萄糖苷酶影响显著的因素。Plackett-Burman试验设计各因素水平见表1。
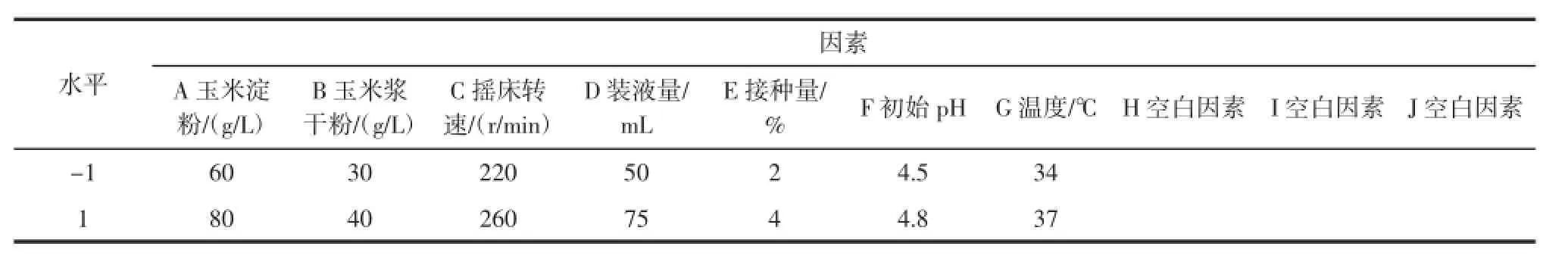
表1 Plackett-Burman试验设计各因素水平Table 1 Factors levelsof the Plackett-Bu rm an design
1.4.3最陡爬坡试验
根据Plackett-Burman试验的结果,给筛选出的显著因素设计一定的步长,其他因素呈正效应取高水平,呈负效应取低水平,进行最陡爬坡实验。
1.4.4响应面试验设计
根据Box-Behnken试验设计原理设计响应面试验[16]。响应面试验设计各因素水平见表2。
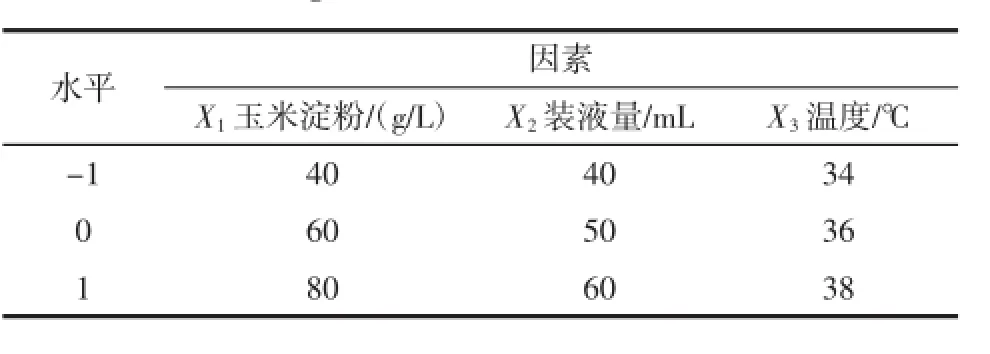
表2 响应面设计的因素和水平Tab le5 Rangeofdifferent factorsinvested in RSM
2 结果与分析
2.1单因素试验结果
2.1.1碳源优化
各单因素对黑曲霉J2产α-葡萄糖苷酶酶活的影响见图1。
由图1可以看出,在碳源为玉米淀粉,氮源为玉米浆干粉,摇床转速为240 r/min,装液量为50m L(在500mL摇瓶中),初始pH为4.5,接种量为4%,发酵温度为36℃的条件下,黑曲霉J2产α-葡萄糖苷酶酶活较高,故对各因素水平进行Plackett-Burman设计。
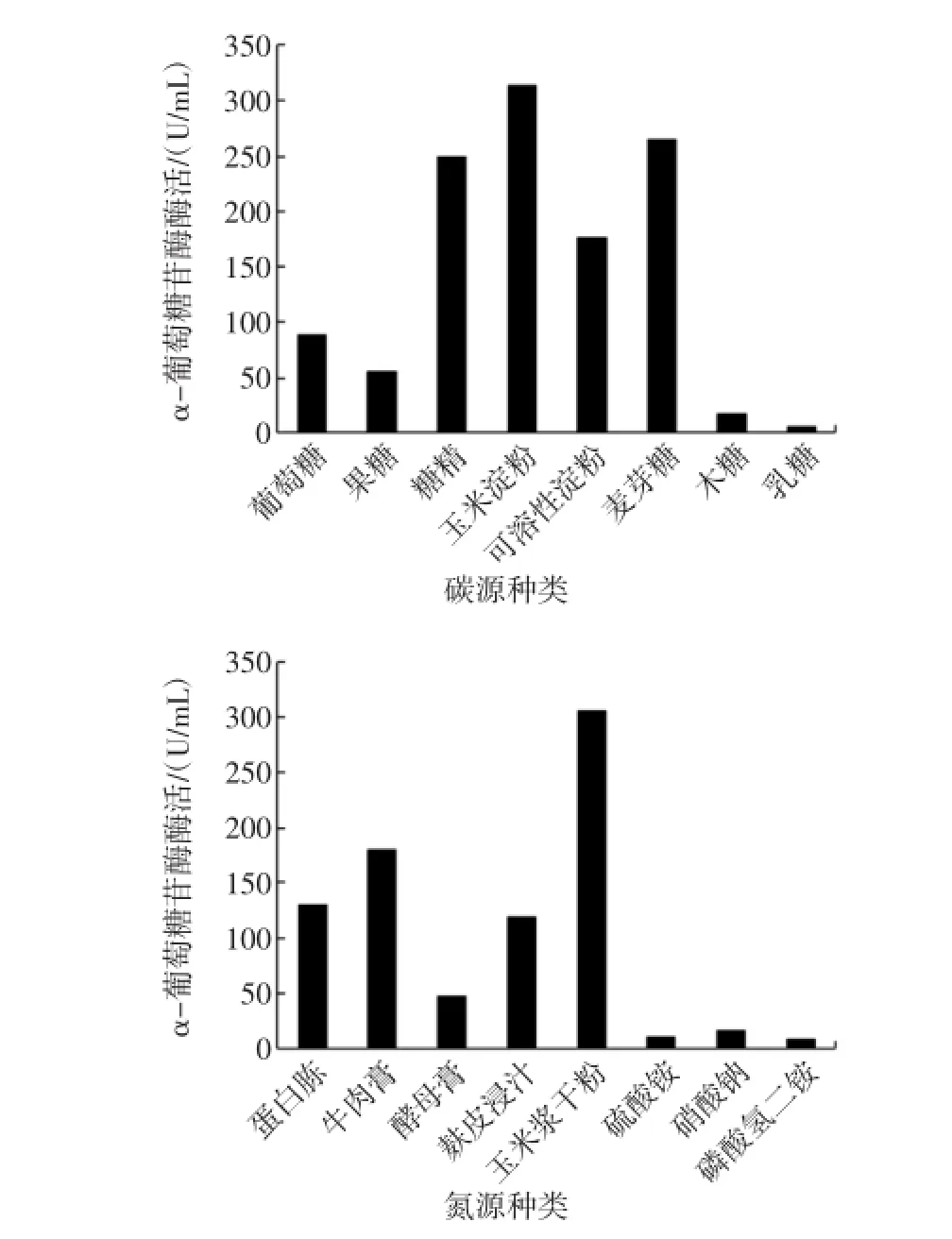
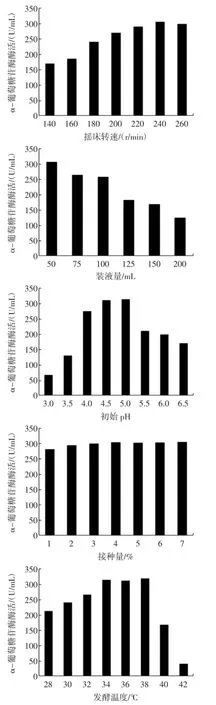
图1 各单因素对黑曲霉J2产α-葡萄糖苷酶酶活的影响Fig.1 Effectofmedium com position and fermentation conditions on theactivity ofα-glucosidaseby Aspergillusniger J2
2.2Plackett-Burman设计筛选显著影响产酶因子
根据Plackett-Burman设计原理[17],选择7个因素玉米淀粉、玉米浆干粉、摇床转速、装液量、接种量、初始pH和温度(分别标记为A、B、C、D、E、F、G)做二水平设计,即高水平(1)和低水平(-1)。依照表3每个序号所对应的试验条件进行12组试验,每组试验做3个平行。Plackett-Burman试验设计与结果如表3所示。
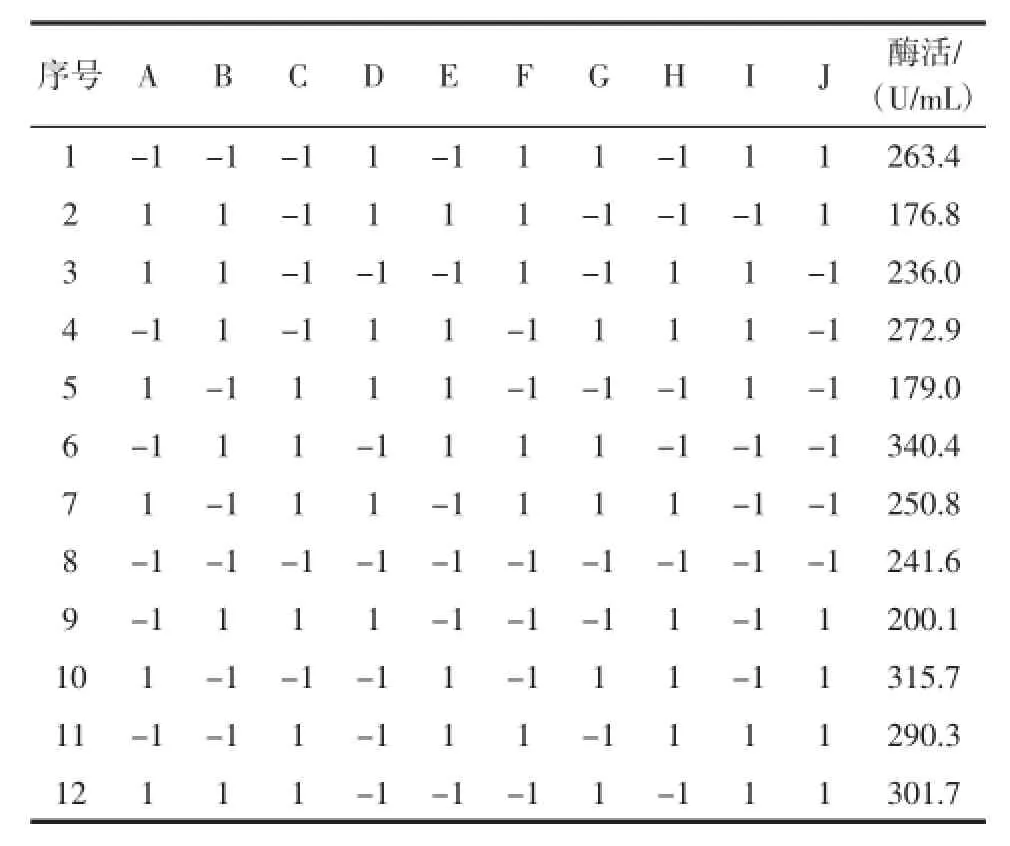
表3 Plackett-Burman试验设计与结果Tab le3 Resultsof Plackett-Burman design
对上述结果利用Design-Expert8.0分析各因素的主效应和重要性。其统计分析结果如表4所示。
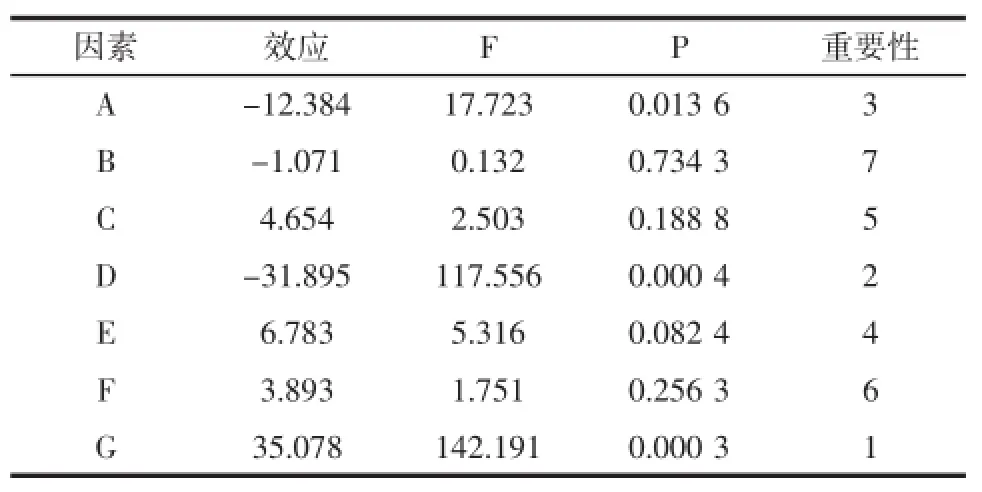
表4 Plackett-Burman试验结果对葡萄糖苷酶活力影响的统计分析Table 4 Statisticalanalysisof the Plackett-Burman experimental resultsonα-glucosidase
从上表可以看出对黑曲霉产α-葡萄糖苷酶呈正效应的是摇床转速、接种量、初始pH和温度;呈负效应的是玉米淀粉、玉米浆干粉和装液量。其中玉米淀粉、装液量和温度对黑曲霉产α-葡萄糖苷酶影响显著,可用于进行下一步实验。
2.3最陡爬坡试验
玉米淀粉和装液量对黑曲霉产α-葡萄糖苷酶呈负效应,故应该减少玉米淀粉和装液量的用量;温度对黑曲霉产α-葡萄糖苷酶呈正效应,因此应该提高发酵温度。最陡爬坡实验设计与结果如表5所示。
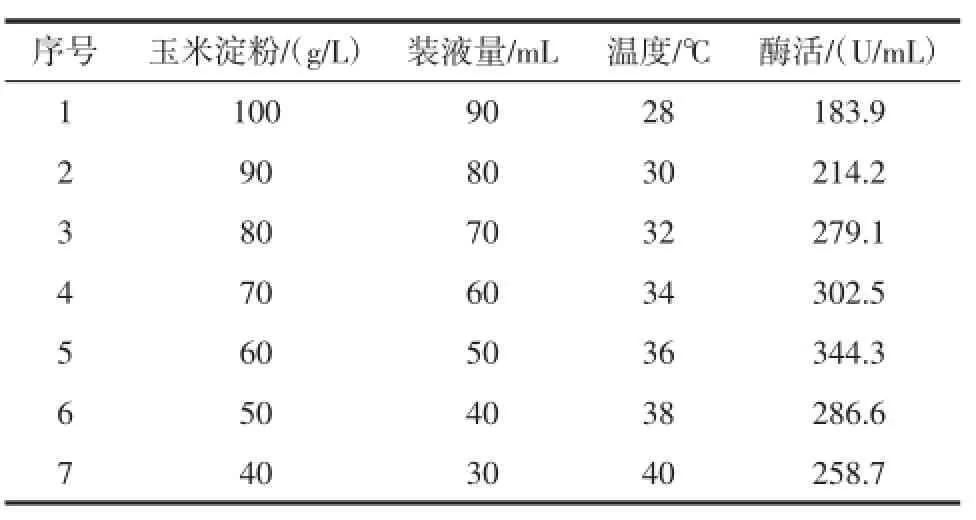
表5 最陡爬坡试验设计与结果Table5 Steepestascentpath design and results
由以上结果可知,最大酶活区在第5组实验附近,即玉米淀粉60 g/L,装液量50mL,温度36℃,故以此发酵条件为响应面的中心点进行响应面实验。
2.4响应面试验设计与结果
以对酶活影响显著的玉米淀粉,装液量和温度为自变量,α-葡萄糖苷酶酶活为响应值,试验选取17个试验点,做响应面回归分析,得到黑曲霉产α-葡萄糖苷酶的最优发酵条件。响应面Box-Behnken试验设计与结果表6所示。
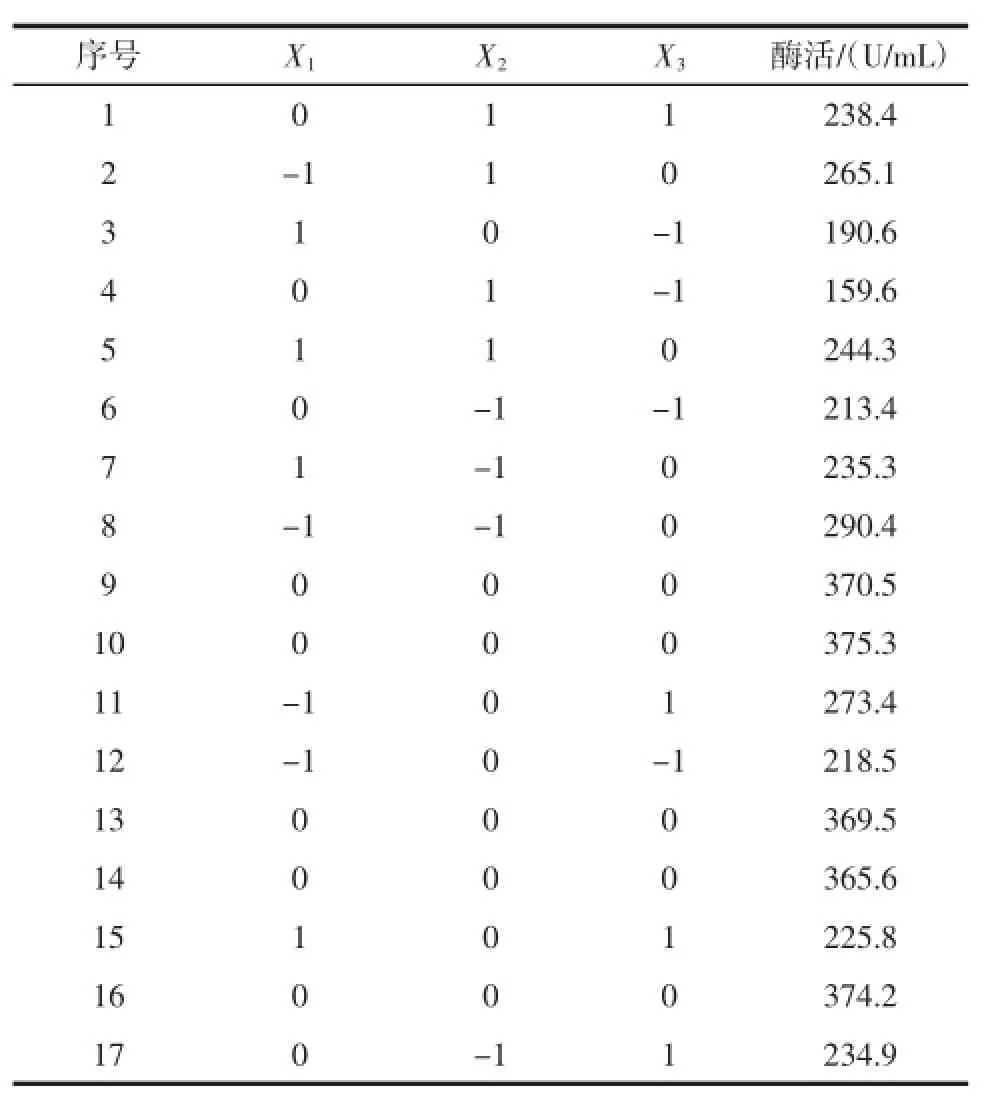
表6 Box-Behnken试验设计与结果Table6 Experimental design and respone of Box-Behnken design
根据表6的试验结果,通过Design-Expert8.0软件对数据进行二次多元回归拟合,得到回归方程:
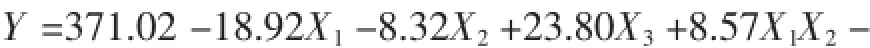
2.4.1响应面方差分析
利用软件Design-Expert8.0对回归方程进行方差分析,其分析结果如表7所示。
回归方程方差分析中,由F检验来判定,概率P值越小,表明其显著性越高。由表7的结果可知,模型P<0.000 1,表明模型极显著;失拟项P=0.129 9>0.05,表明失拟项不显著,即模型拟合性好,模型选择正确;模型的相关系数R2=0.997 3,即模型有99.73%的机会解释酶活产生的原因。X1X2,X2X3对酶活影响显著,即玉米淀粉与装液量的交互作用,装液量与温度的交互作用对酶活影响显著。
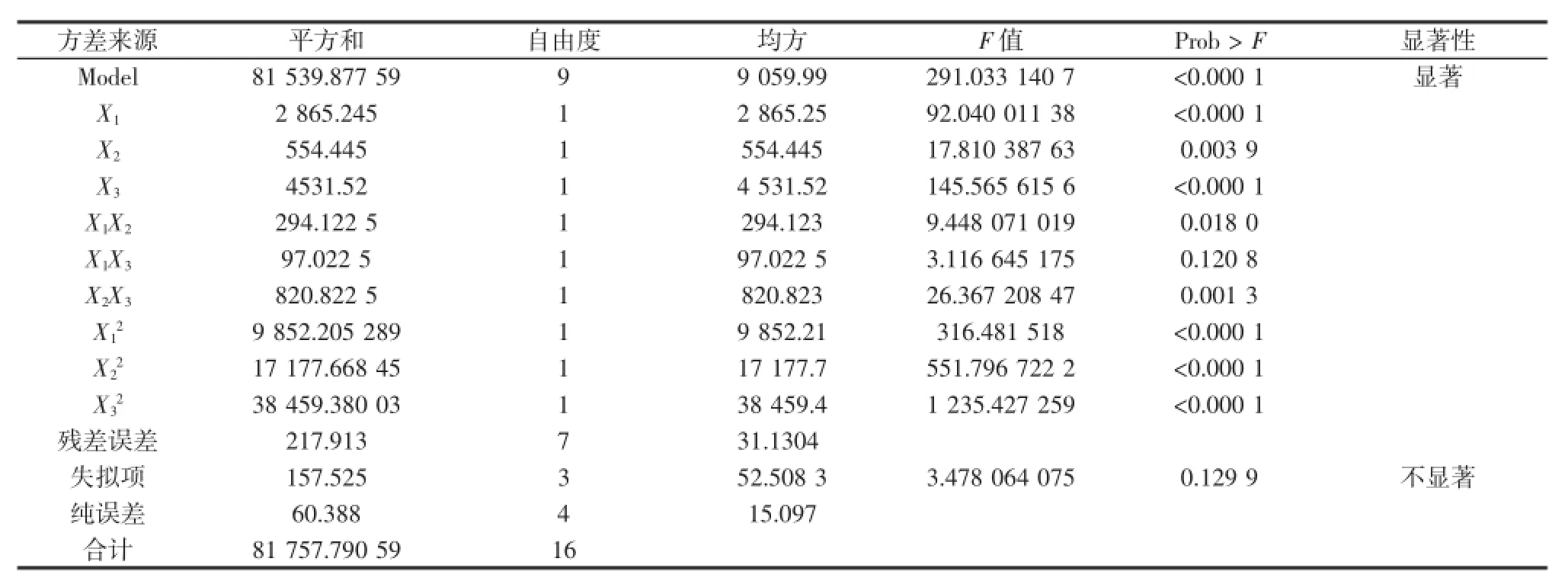
表7 回归方程的方差分析Table 7 ANOVA analysis for regression equation
2.4.2响应面曲面图及其等高线图
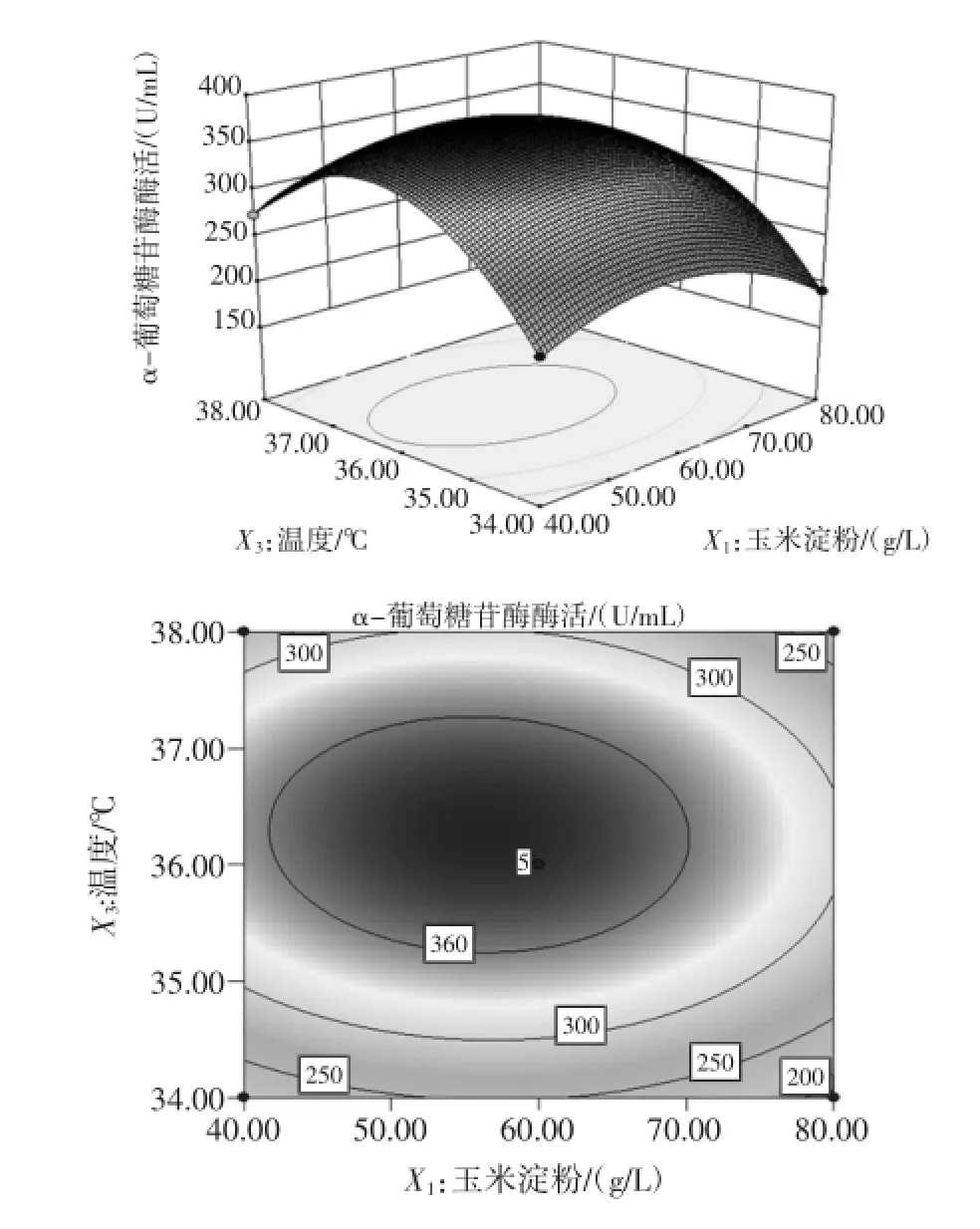
图2 温度和玉米淀粉对酶活影响的响应曲面图和等高线图Fig.2 Responsesur faceand contour plots for effectof tem perature and corn starch onα-glucosidaseactivity
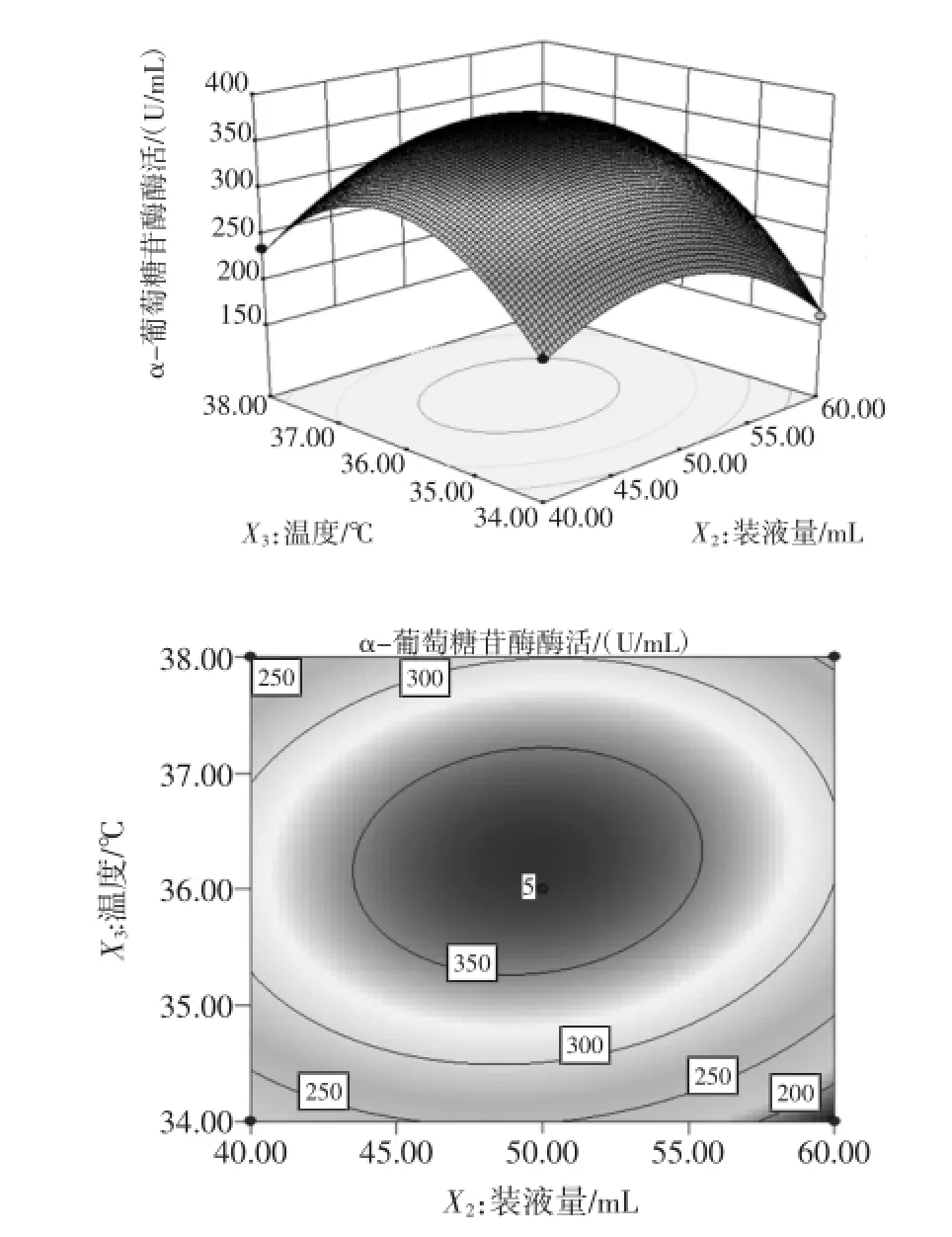
图3 温度和装液量对酶活影响的相应曲面图和等高线图Fig.3 Responsesurfaceand contour plots for effectof temperature and liquid volumeonα-glucosidaseactivity
如图2~图4所示,它们分别反映了玉米淀粉、装液量和温度这3个因素的两两交互作用对酶活的影响。从响应曲面图可以看出,每个曲面都存在最高点,通过对回归方程对各个因素求一阶偏导,得到Y极大值的条件为:X1=-0.208,X2=-0.066,X3=0.125,即在玉米淀粉,装液量和温度分别为55.84、49.34g/L,36.25℃存在最大酶活374.7U/mL。考虑到操作的可行性,确定最佳的培养条件为:玉米淀粉55.8 g/L,玉米浆干粉30 g/L,发酵温度36.3℃,接种量4%,装液量49.3mL,摇床转速240 r/min,初始pH4.8。
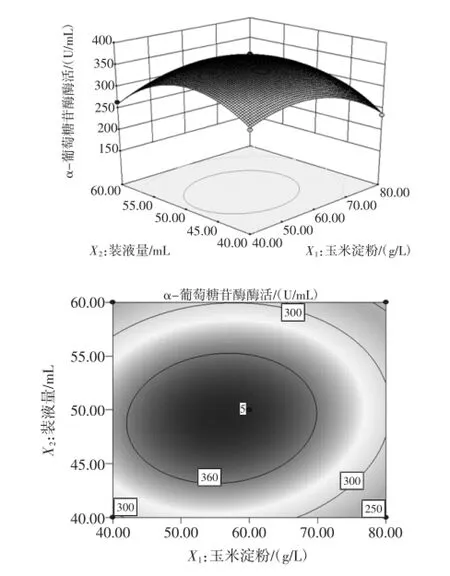
图4 装液量和玉米淀粉对酶活影响的相应曲面图和等高线图Fig.4 Responsesur faceand contour plots for effectof liquid volumeand corn starch onα-glucosidaseactivity
2.4.3模型验证
为了进一步验证模型的预测值,在最佳培养条件下进行了3次重复实验,所测酶活平均为375.5 U/m L,与预测值374.7U/mL,实际值与预测值拟合度为99.79%,证实该模型有效可靠。
3 结论
α-葡萄糖苷酶是生产低聚异麦芽糖中的关键酶,所以探求提高α-葡萄糖苷酶的方法与规律存在着重要意义。本文在单因素试验的基础上,进行了Plackett-Burman试验,最陡爬坡试验和响应面试验,最后得到了最佳的发酵条件。结果表明,黑曲霉产葡萄糖苷酶的最优发酵条件为玉米淀粉55.8g/L,玉米浆干粉30g/L,发酵温度36.3℃,接种量4%,装液量49.3m L,摇床转速240 r/min,初始pH4.8。在最优的发酵条件下,葡萄糖苷酶最大酶活达375.5U/mL。
参考文献:
[1]HenrissatB,Bairoch A.New familiesin the classification ofglycosyl hydrolases based on amino acid sequence similarities[J].Biochem Journal,1993,293:781-788
[2]Chiba S.Molecularmechanism in alpha-glucosidase and glucoamylase[J].Bioscience,biotechnology,and biochemistry,1997,61(8): 1233-1239
[3]Van Der MaarelM JE C,Van Der Veen B,Uitdehaag J,etal.Properties and applicationsof starch-converting enzymesof theα-amylase family[J].Journalofbiotechnology,2002,94(2):137-155
[4]NaokiK,YurikoM,MasashiK,etal.Isomaltose formed byalpha-glucosidases tiggers amylase induction in Aspergillusnidulans[J].Curr Genet,2002,42(1):43-50
[5]Goffin D,Wathelet B,Blecker C,et al.Comparison of the glucooligosaccharide profiles produced from maltose by two different transglucosidases from Aspergillus niger[J].Revue de Biotechnologie,Agronomie,SociétéetEnvironnement,2010,14(4):607-616
[6]黄金莲,黄秀娟,钟振声.α-转移葡萄糖苷酶的转苷作用机理探究[J].食品工业科技,2012,33(7):108-111
[7]朱路甲,贾克军,王宝军.我国功能糖产业:应用研究加快功能糖产业链纵向发展[N].中国食品报,2010-6-1(005)
[8]严晓娟,陈朋,胡先望,等.低聚异麦芽糖生产工艺研究[J].现代生物医学进展,2013,13(24):4794-4797
[9] 林亲录,符琼,周丽君.低聚异麦芽糖制备的研究进展[J].食品工业科技,2011,32(2):398-400
[10]吴孔阳,齐宗献,黄桂华,等.一株产α-葡萄糖苷酶菌株的鉴定和选育[J].食品研究与开发,2012,33(12):145-148
[11]陈朋,韩跃武,胡先望.α-葡萄糖苷酶菌株的选育及发酵条件的研究[J].工业微生物,2007,37(6):49-52
[12]杨捷琳,孟逊,黄应峰,等.阪崎肠杆菌α-葡萄糖苷酶基因克隆,表达及活性研究[J].食品科学,2008,29(2):213-217
[13]童星,唐秋嵩,吴玉飞,等.黑曲霉α-葡萄糖苷酶基因的克隆及其在毕赤酵母中的表达[J].微生物学报,2009,49(2):262-268
[14]郝学财,余晓斌,刘志钰,等.响应面方法在优化微生物培养基中的应用[J].食品研究与开发,2006,27(1):38-41
[15]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536
[16]Lee SL,ChenW C.Optimization ofmedium composition for the production of glucosyltransferase by Aspergillus niger with response surfacemethodology[J].Enzyme and Microbial Technology,1997,21 (6):436-440
[17]田泱源,李瑞芳.响应面法在生物过程优化中的应用[J].食品工程,2010(2):8-11,53
DO I:10.3969/j.issn.1005-6521.2015.19.042
收稿日期:2014-05-18
基金项目:国家“863”计划项目(2006AA10Z339);国家自然科学地区科学基金项目(20362001)
作者简介:陆兵(1988—),男(汉),硕士研究生,研究方向:微生物工程。
*通信作者:梁智群(1959—),男,教授,博士,研究方向:食品微生物。
Optim ization of Fermentation Conditions forα-glucosidase Production by Aspergillus Niger Using Response Sur face M ethodology
LUBing1,2,WU Yu-ying1,2,LIZhi-hong1,2,LIANG Yu-ting1,2,WANGChao1,HUANGGui-hua1,2,LIANGZhi-qun1,2,*
(1.Collegeof Life Science and Technology,GuangxiUniversity,Nanning 530004,Guangxi,China;2.State Key Laboratory forConservation and Utilization of Subtropical Agro-bioresources,GuangxiUniversity,Nanning 530004,Guangxi,China)
Abstract:According to the results of single experiment,three key factors influencing theα-glucosidase production in Aspergillusniger fermentationwere determined by two level factorial design of Plackett-Burman experiment.Then thebestoptimal regionswere approached by the steepestascentpath experiment.Finally,the Box-Behnken experiment design in the response surfacemethodswas used in order to optimize fermentation medium and conditions.The resultsshowed thatoptimal fermentation conditionswere corn starch 55.8 g/L,corn steep powder 30 g/L,inoculum 4%(volume fraction),shaking speed 240 r/min,initial pH 4.8,49.3 mL liquid volume in 500 mL triangular flask and temperature 36.3℃.Under the optimal condition,the enzyme activity ofα-glucosidasewas375.5U/mL.
Keywords:Aspergillusniger;α-glucosidase;responsesurfacemethodology(RMS);fermentation optimization

