表面活化甲壳素固定化Gibberella intermedia 生物转化制备 异烟酸
龚劲松,李恒,杨涛,钱建瑛,陆震鸣,许正宏,史劲松
(江南大学药学院,江苏 无锡 214122)
我国甲壳素生物质资源储量丰富,来源广泛,是仅次于纤维素的第二大高分子物质,每年仅虾蟹壳等生物质废弃物来源的甲壳素就高达1000 多万吨[1-3]。甲壳素在土壤中被微生物降解后,可改善土壤中微生物群落结构,促进植物生长,因此可作为一种潜在的土壤改良剂[4];甲壳素作为饲料添加剂也具有一定的市场前景,已获得美国FDA 批准;另外,甲壳素还具有较强的抗菌作用,因此可用于水果及肉制品的保鲜;由于安全无毒,甲壳素及其衍生物还可用于食品行业中的增稠剂和食品添加 剂[5]。但甲壳素的分子具有非常稳定的环状结构,分子间和分子内存在较强的氢键作用,使得甲壳素形成高度的结晶结构,使其溶解性能差,不易溶于水、稀酸稀碱和常规的有机溶剂中[1,3],严重限制了它的发展与应用。
据不完全统计,目前我国90%以上甲壳素用于酸水解制造氨糖,但氨糖不属于我国的原料药,因此80%以上产品主要出口至国外。然而,国际市场氨糖价格降低至10 万元/吨以下,同时随着合成生物学的发展,目前国内氨糖已可通过生物法进行大规模生产,而且生物法价格低廉,导致氨糖价格持续走低;另外,随着环保问题日益受到重视,环境污染治理成本提高,很多厂家开始减少生产。未来甲壳素加工将面临新一轮的难题,必须寻找新的突破。将甲壳素进行低成本利用、建立一种绿色工艺,不仅有利于将废弃资源变废为宝、对环境友好,而且具有潜在的经济效益和良好的研究价值。
对甲壳素进行修饰、改性,将极大的拓展甲壳素的应用范围;而对甲壳素表面进行脱乙酰活化是其中最重要的方式之一。经表面脱乙酰修饰的甲壳素可溶于稀酸,具有良好的吸附性和通透性等优点,同时还保留了甲壳素的结构框架,因此具备了更加广阔的应用前景。
腈水解酶是工业生物催化中的一种关键酶类,可一步催化腈类化合物生成有机酸及氨基酸等,该反应条件温和、催化效率高、绿色环保,从而在化工、医药、环保等领域具有重要应用[6-7]。然而,从已有文献资料来看,腈水解酶的实际应用仍受到稳定性不够高、催化剂的重复利用批次较差等因素的限制;由于具有改善稳定性、提高重复利用率、缓解细胞自身裂解等优势,固定化技术的出现可弥补上述腈水解酶应用中的缺陷[8-10]。另外,传统研究主要采用细菌来源的腈水解酶为催化剂,而有关真菌腈水解酶则相对研究较少,而且据文献报道,真菌腈水解酶在选择性和底物谱等方面相比细菌腈水解酶具有一定优势[11]。
本工作尝试采用经表面活化的甲壳素废弃物用于固定产腈水解酶的真菌Gibberella intermedia,进行4-氰基吡啶的生物转化以制备异烟酸。近年来有关修饰改性甲壳素的研究主要集中于其对重金属和有毒有害化合物的吸附功能[3,12-13],而采用表面活化改性的甲壳素固定产酶细胞则鲜有研究,利用该固定化腈水解酶催化剂制备有机酸尚属首次报道。
1 实验部分
1.1 仪器和试剂
立式离心机,日本HITACHI 公司;UV-2100紫外分光光度计,上海UNICO 仪器有限公司;高压灭菌锅,日本三洋公司;DK-8D 型电热恒温水槽,上海精宏实验设备有限公司;集热式恒温加热磁力搅拌器,巩义市予华仪器有限公司;生化培养箱,上海博讯医疗仪器有限公司;甲壳素制备原料由扬州日兴生物科技股份有限公司提供;4-氰基吡啶、异烟酸和异烟酰胺为分析纯,购自阿拉丁试剂公司;酵母粉和胰蛋白胨,由Oxoid 公司生产;其他化学试剂均为分析纯。
1.2 菌种培养
产腈水解酶真菌G. intermedia 由本实验室筛选获得[14],已保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No. 4903。将斜面上的菌种接种至种子培养基,30℃、200r/min条件下培养36h;再将新鲜的种子转接至发酵培养基中,30℃、200r/min 培养60h。离心收集菌体 备用。
种子培养基(g/L):蔗糖30,硝酸钠3,磷酸氢二钾1,硫酸镁0.5,氯化钾0.5,硫酸亚铁0.01;发酵培养基(g/L):葡萄糖10,酵母粉7.5,磷酸二氢钾2.72,硫酸亚铁0.014,氯化钠1.16,己内酰胺3.39,pH 值 7.0。
1.3 表面活化甲壳素制备
将蛋白酶处理过的虾壳用水洗涤3 次、过滤、烘干备用;采用4%的盐酸对预处理样品进行脱钙处理,随后将样品洗涤至中性;在微波(高火)条件下,采用40%氢氧化钠溶液对其进行脱乙酰,微波处理时间30min,此时脱乙酰度达到约80%,随后水洗至中性,收集滤渣108℃烘干至恒重;用密封式粉碎机将样品粉碎成60~150 目左右细粉 备用。
1.4 固定化细胞制备
收集培养获得的絮状菌体制成菌悬液,将用2%乙酸溶液溶解的表面活化甲壳素,与一定浓度的菌液均匀混合。利用带有针头的医用注射器稳定地将混合液滴入到不同浓度的三聚磷酸钠溶液中固化成球。在4℃条件下固化4h。采用pH 值7.0 的磷酸钠缓冲液(10mmol/L)洗涤固定化细胞至中性后分别测定酶活,在确定最优的甲壳素浓度、三聚磷酸钠浓度及菌体浓度后,优化固定化时间。
1.5 固定化细胞的生物转化
以4-氰基吡啶为底物,固定化细胞为催化剂,进行固定化和游离细胞合成异烟酸的生物转化过程研究。将反应体系中各组分分别置于30℃下温浴10min 后转入锥形瓶中,转化反应在30℃旋转式摇床上进行,用2mol/L HCl 终止反应,取一定量转化液进行酶活检测。该腈化合物转化过程中,产物酸与氨是1∶1 生成。一个酶活单位的定义为:在测定条件下,1min 时间内转化生成1μmol 氨所对应的酶量为1U。
1.6 检测方法
氨含量检测方法:采用苯酚-次氯酸钠法[15]。根据碱性条件下亚硝基铁氰化钠可催化氨与苯酚和次氯酸钠反应生成蓝色可溶性物质的特点,通过紫外分光光度法测定该蓝色物质。在反应液中依次加入苯酚钠溶液2.0mL、亚硝基铁氰化钠和次氯酸钠溶液各3.0mL,用除氨水定容至10mL,充分摇匀后置于27℃水浴中反应15min,取出后于630nm 处测定其吸收值。
底物及产物的HPLC 检测方法:色谱柱为Atlantis dC 18 柱,5.0µm,150mm×4.6mm;流动相为甲醇/0.01%磷酸(体积比5∶95);波长268nm;柱温30℃;流速0.7mL/min。
2 结果与讨论
2.1 固定化过程各因素对细胞酶活的影响
2.1.1 甲壳素浓度对固定化细胞酶活的影响
当经表面活化的甲壳素浓度(质量分数,下同)为3%时比酶活达到最高,提高或降低浓度均导致比酶活降低[图1(a)]。可能由于甲壳素的使用浓度越高,其分子沉淀形成的固化膜越致密,且固化速度过快容易出现拖尾,底物分子进出细胞难度增加,故酶活降低;另一方面,当甲壳素浓度过低时它与凝结剂三聚磷酸钠的接触无法形成稳定的固化膜,不能得到高质量、高机械强度的固定化细胞。

图1 甲壳素浓度、三聚磷酸钠浓度、固定化时间和菌体浓度对固定化细胞酶活的影响
2.1.2 三聚磷酸钠浓度对酶活的影响
三聚磷酸钠浓度影响凝结液的pH 值和阴离子浓度,从而影响固定化小球的形成速度和稳定性。在低浓度三聚磷酸钠溶液中,固定化小球生成速度慢,所制得小球机械强度差,易变形、破碎;不过随着三聚磷酸钠浓度提高,小球生成速度加快,产品机械强度和稳定性提高。但三聚磷酸钠浓度过高则会导致小球生成速度过快,不能形成完全的孔膜,小球呈椭圆形,有气孔,机械强度差。由图1(b)可知,三聚磷酸钠质量分数由4%升高到7%时,固定化细胞的比酶活逐渐提高,三聚磷酸钠质量分数提升至12%时,比酶活则开始逐渐降低。最终选择7%三聚磷酸钠为固定化细胞的最适凝结剂浓度。
2.1.3 固定时间对酶活的影响
固定时间对固定化细胞酶活的影响如图1(c)所示。固化时间太短,所形成的固化膜结构松散,固定化小球机械强度差,细胞逃逸量较大。当固化时间为5h 时,凝胶网络具有较高的机械强度,固化膜致密程度适中,固定化细胞具有最大酶活。因此选择固定化细胞的最佳固定时间为5h。
2.1.4 菌体包埋量的选择
催化剂在固定化细胞体系中的含量将直接影响其催化反应速率。如图1(d)所示,在所采用的细胞浓度由6g/L 提高至20g/L 的范围内,随细胞浓度增加酶活也相应提高。但当菌体浓度从20g/L 增加到24g/L 时,比酶活却随着菌体加入量的增加而减小,出现这种现象的原因可能归于活细胞间对营养物质的相互竞争所造成的[16]。故综合考虑,将该体系的菌体浓度确立为20g/L。
2.2 固定化细胞转化过程各因素对细胞酶活的 影响
2.2.1 温度对酶活的影响
采用上述条件制备的固定化细胞用于4-氰基吡啶的生物转化。首先考察了温度对固定化细胞酶活力的影响。一般温度的影响主要分两方面:在一定范围内随着温度的升高,酶活力提高;但当温度继续升高酶则逐渐变性失活,反应速率下降。
图2(a)为温度对甲壳素固定化细胞酶活的影响。结果显示固定化细胞的最适反应温度为50℃;而实验室前期研究已发现相应游离细胞最适反应温度为40℃[14]。随着反应温度升高,酶促反应速率加快,但酶蛋白也会失活变性,使得酶活力降低。
2.2.2 转化pH 值对酶活的影响

图2 转化温度和pH 值对固定化细胞酶活的影响
微生物酶均在一定的pH 值条件下才显示出最佳反应活性,当高于或低于此pH 值时酶活都会受影响而活力降低。酶活力受pH 值变化影响的原因是,当pH 值发生微小偏移,酶活性部位的基团离 子发生变化而导致酶活降低;pH 值发生较大偏移的时候,会导致酶蛋白的变性。目前,生物催化反应多数在中性环境中进行,在此条件下催化反应速率一般能达到最大值。如图2(b)所示,固定化细胞的最适反应pH 值为7.0;游离细胞的最适反应pH 值为7.6[14],基本保持稳定。固定化细胞酶活随pH值变化趋势较缓,说明甲壳素固定化对细胞有一定的保护作用。本实验室前期还尝试过采用壳聚糖-聚乙烯醇复合材料进行G.intermedia固定化,结果表明固定化细胞最适反应温度和pH 值分别为45℃和7.0[17]。与本实验结果基本一致。
2.2.3 底物浓度对酶活的影响
底物浓度能够显著影响底物转化速率和细胞酶活力,尤其对于腈化合物这类对细胞有毒性的底物。在酶浓度恒定条件下,当底物浓度较小时,酶未被底物饱和,这时反应速率取决于底物浓度;随着底物浓度增加,中间复合物生成也越多,而反应速率取决于中间复合物的浓度,故反应速率也随之增高。当溶液中的酶全部被底物饱和,溶液中无多余的酶,尽管提高底物浓度也不会再有更多的中间复合物生成,这时反应速率达到最大。但当底物浓度过高时会对酶产生抑制作用。
实验结果表明[图3(a)],固定化细胞转化选取底物浓度为125mmol/L 时酶活最高,当底物浓度在125~200mmol/L 时,酶活虽有所降低,但降低幅度较缓慢。而游离细胞在低于50mmol/L 底物浓度时具有较高酶活,当浓度高于50mmol/L,游离细胞的酶活受到抑制,而200mmol/L 底物甚至使游离细胞酶活几乎丧失[14]。可以看出甲壳素的固定对菌体具有保护作用,使催化剂的底物耐受性有显著提高。G. intermedia 复合固定化细胞的最适转化底物浓度为300mmol/L[17],相比甲壳素固定化细胞有进一步提高。因此后续研究将继续摸索该固定化工艺以期进一步改善甲壳素固定化细胞的催化潜力。
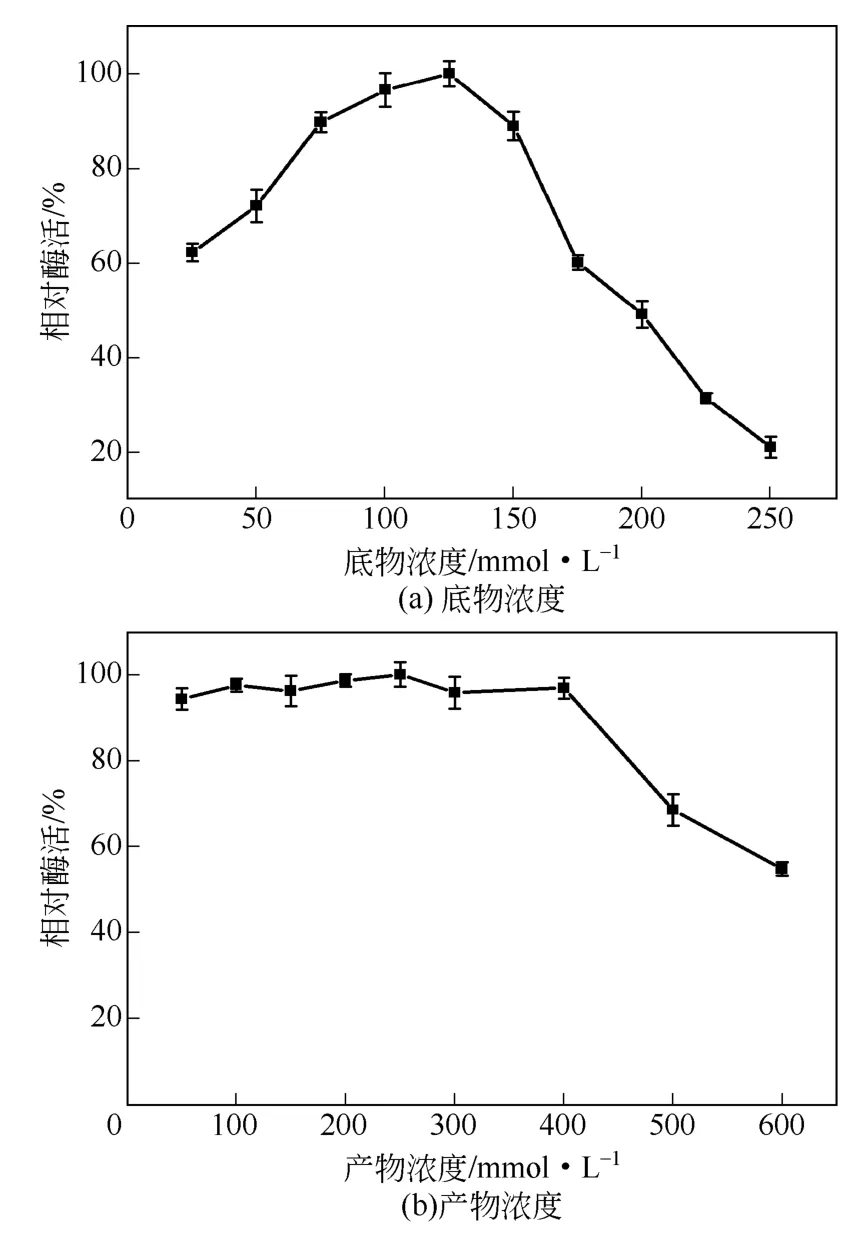
图3 底物浓度和产物浓度对固定化细胞酶活的影响
2.2.4 产物浓度对酶活的影响
产物酸的高浓度及所造成的pH 值环境对于转化反应的进一步进行具有一定抑制作用。因此本研究考察了产物异烟酸的浓度对酶活的影响,分别选取50~600mmol/L 产物浓度进行实验。由图3(b)可知,固定化细胞在产物浓度小于400mmol/L 时,酶活基本保持稳定,且有小幅度提升。而游离细胞在高于150mmol/L 浓度时酶活则快速降低。这可能归因于在固定化细胞中,产物浓度增加后,细胞的通透性增强,促进了底物和产物的扩散,使酶催化速率提升。虽然产物对酶有抑制作用,但细胞的通透性增强的效果略大于产物对酶的抑制效应,所以酶活也有一定上升。但当产物浓度继续增大时,抑制作用增强,酶迅速失活。
2.2.5 重复利用批次对底物转化率的影响
在以上优化的最适条件下,以125mmol/L 4-氰基吡啶为底物,比较固定化细胞和游离细胞对底物4-氰基吡啶的转化过程。如图4(a)所示,游离细胞和固定化细胞分别在100min 和80min 内将底物转化完全,并生成相应的异烟酸,同时反应体系中会检测到微量的异烟酰胺同时生成。在此基础上,进行批次转化实验。如图4(b)所示,固定化细胞可以重复利用14 个批次,菌体转化能力为45.5g(4-氰基吡啶)/g(dcw);而游离细胞可重复利用3 个批次,菌体转化能力为9.75g(4-氰基吡啶)/g(dcw)。这充分证明固定化细胞具有良好的稳定性。不过在转化后期,固定化小球不断吸水膨胀,会出现少部分破碎。

图4 4-氰基吡啶的转化过程及批次转化
3 结 论
异烟酸是合成抗结核病药物的重要中间体,在医药化工等领域具有重要应用。传统研究主要采用化学方法进行合成;由于具备反应条件温和、催化特异性高等特点,采用腈水解酶介导的生物催化合成途径近年来逐步受到重视。但目前已报道的对4-氰基吡啶具有高特异性的产腈水解酶菌株仍非常有限,而且主要集中于细菌来源的菌株。本研究采用实验室前期筛选获得的一株对4-氰基吡啶转化效率较高的真菌G. intermedia 为催化剂,首次尝试通过表面活化的甲壳素为包埋材料对游离细胞进行固定化,优化了固定化过程的基本参数,并将制备的固定化细胞应用于4-氰基吡啶生物转化合成异烟酸。甲壳素及其衍生物主要来源于虾蟹等海产品的外壳,来源丰富、而且具有生物安全性,本研究针对废弃生物质资源高效利用,拓展了工农业生产中生物质的资源化领域,并为异烟酸的规模化生物合成奠定了基础;具有良好的经济价值和理论意义。
[1] 蒋小姝,莫海涛,苏海佳,等. 甲壳素及壳聚糖在农业领域方面的应用[J]. 中国农学通报,2013,29(6):170-174.
[2] 张群. 甲壳生物质资源生态高值加工关键技术及其应用[J]. 食品与生物技术学报,2014,33(3):336.
[3] Huang C-M,Chen L-C,Yang H-C,et al. Preparation of acrylic acid-modified chitin improved by an experimental design and its application in absorbing toxic organic compounds[J]. J. Hazard Mater.,2012,241-242:190-196.
[4] 赵云强,方伊. 甲壳素、壳聚糖的综合应用及其发展前景[J]. 贵州化工,2001,26(1):10-13.
[5] 苏广宇,刘四新,李从发. 甲壳素/壳聚糖的研究与应用概况[J]. 广东农业科学,2008,2:107-111.
[6] Gong J-S,Lu Z-M,Li H,et al. Nitrilases in nitrile biocatalysis:Recent progress and forthcoming research[J]. Microb. Cell Fact.,2012,11:142.
[7] Martínková L,Křen V. Biotransformations with nitrilases[J]. Curr. Opin. Chem. Biol.,2010,14(2):130-137.
[8] Ni K,Wang H,Zhao L,et al. Efficient production of(R)-(-)-mandelic acid in biphasic system by immobilized recombinant E. coli[J]. J. Biotechnol.,2013,167(4):433-440.
[9] Pawar S,Meena V,Kaushik S,et al. Stereo-selective conversion of mandelonitrile to(R)-(-)-mandelic acid using immobilized cells of recombinant Escherichia coli[J]. 3 Biotech.,2012,2:319-326.
[10] Gong J-S,Lu Z-M,Li H,et al. Metagenomic technology and genome mining:Emerging areas for exploring novel nitrilases[J]. Appl. Microbiol. Biotechnol.,2013,97(15):6603-6611.
[11] Vejvoda V,Kubác D,Davidová A,et al. Purification and characterization of nitrilase from Fusarium solani IMI196840[J]. Process Biochem.,2010,45(7):1115-1120.
[12] Kousalya G N,Gandhi M R,Meenakshi S. Preparation of modified chitin for the removal of chromium(Ⅵ)[J]. Bioremediat. J.,2010,14(4):208-218.
[13] Yong S K,Bolan N S,Lombi E,et al. Sulfur-containing chitin and chitosan derivatives as trace metal adsorbents:A review[J]. Crit. Rev. Env. Sci. Technol.,2012,43(16):1741-1794.
[14] Wu Y,Gong J-S,Lu Z-M,et al. Isolation and characterization of Gibberella intermedia CA3-1,a novel and versatile nitrilase- producing fungus[J]. J. Basic Microbiol.,2013,53(11):934-941.
[15] Gong J-S,Lu Z-M,Shi J-S,et al. Isolation,identification,and culture optimization of a novel glycinonitrile - hydrolyzing fungus—— Fusarium oxysporum H3[J]. Appl. Biochem. Biotechnol.,2011,165(3):963-977.
[16] Hegge AB,Andersen T,Melvik JE,et al. Formulation and bacterial phototoxicity of curcumin loaded alginate foams for wound treatment applications:Studies on curcumin and curcuminoides XLII[J]. J. Pharm. Sci.,2011,100(1):174-185.
[17] 杨涛,李恒,龚劲松,等. 固定化Gibberella intermedia 转化3-氰基吡啶制备烟酸[J]. 化工进展,2014,33(9):2432-2437.

