补中益气汤对阿霉素诱导的大鼠肾病的作用
郭继光,张海燕,李朝鹏,高飒,李芸
(1.河北大学 基础医学院,河北 保定 071000;2.保定市安新县医院 神经内科,河北 保定 071600;3.华北制药金坦生物技术股份有限公司 质量保证部,河北 石家庄 050035;4.高碑店市医院 儿科,河北 高碑店 074000;5.保定市第三医院 护理部,河北 保定 071000)
补中益气汤出自金元四大家的李杲所著的《脾胃论》,具有调补脾胃、升阳益气的作用.药物组成为黄芪、党参、白术、陈皮、升麻、炙甘草、当归、柴胡.方中的黄芪作为君药健脾补气,而它与党参和白术联合使用则在补气之余兼具养阴之功效,也就是说具有补气固精的效果,实际上按照现代中医理论,这种效果的实际作用就包含对尿蛋白的排泄的抑制作用.已经有许多现代药理研究表明黄芪能够改善肾小球疾病患者的蛋白质、脂质代谢,改善肾功能[1].当归是一味常用的补血和血药,能够改善血液循环[2-3];陈皮能够理气健脾,加强消化和吸收;炙甘草具有气血双补的功效,能够提高机体的免疫功能,抗炎止痛;升麻具有清热解毒和升阳举陷的功效,其作用和柴胡类似.目前,已经有数个临床实验表明补中益气汤可能对肾病起到一定的治疗作用[4-6],但是之前的工作中,都存在样本数量低、缺乏严格的定量测定的问题.本研究根据Deschenes等[7]尾静脉注射阿霉素的方法建立肾病大鼠模型,并使用此模型检测补中益气汤对阿霉素肾病的作用,从而进一步揭示其作用机理.
1 材料与方法
1.1 实验动物
Sprague Dawley大鼠60 只,雄性,体质量约200g,购自河北医科大学实验动物中心.给药前,先进行适应性饲养约7d,使用普通饲料喂养,并保证充足的饮水.
1.2 试剂和设备
盐酸阿霉素(Adriamycin,ADR),Sigma公司,使用时新鲜配置成5mg/mL.
代谢笼,Tecniplast,意大利;考马斯亮蓝G-250,Sigma公司;Albumin Bovine V,Sigma公司.
1.3 补中益气汤水提取液的制备
补中益气汤组方:黄芪15g,党参10g,白术9g,陈皮6g,升麻6g,当归10g,柴胡6g,炙甘草9g.
水提取液制法:按处方比例加10倍量水浸泡30min,加热煎煮1h,滤过,滤液备用.药渣再加8倍量水,煎煮30min,滤过,滤液合并,浓缩至生药质量浓度1g/mL,静置沉降24h,滤取上清夜,加热浓缩至生药质量浓度2g/mL,即得.
1.4 阿霉素肾病大鼠模型的建立方法
按6mg/kg的剂量,初次大鼠尾静脉注射阿霉素溶液,1周后,进行第2次尾静脉阿霉素的注射,剂量为3mg/kg.如果在30d左右大鼠尚未死亡,则可认为已经成功建立了阿霉素肾病大鼠模型.
1.5 动物分组及给药
将60只大鼠分为6组,即对照组、模型组、激素组和补中益气汤低剂量、中剂量及高剂量治疗组,每组各10只.
补中益气汤治疗组大鼠,在首次尾静脉注射阿霉素溶液后,立即进行补中益气汤灌胃,每日1次,持续6周.
对照组和模型组使用同补中益气汤等量的生理盐水进行灌胃,同样每日1次,持续6周.
补中益气汤成人1日剂量(生药)约为1g/kg(以人的体质量为70kg计算).依据Meeh-Rubner公式,换算200g大鼠1日的等效剂量(生药)大约是人的6倍,即6g/kg.为了涵盖汤剂的有效给药剂量范围,本实验以此估算剂量为基础,进行了梯度给药.详细的分组给药方式见表1.

表1 动物分组和给药方式Tab.1 Drug administrations in different rat groups
1.6 24h 尿蛋白定量测定
以首次尾静脉注射阿霉素溶液后第7,21,42d,按照分组给药方式给药结束后,将大鼠转移至代谢笼内,收集24h的大鼠尿液.用Bradford法测定尿蛋白浓度,并依此计算24h 尿蛋白(24-hour urine protein,24HUP).
1.7 大鼠血液生化指标的检测
在首次尾静脉注射阿霉素后第42天,大鼠眼眶静脉丛取血.通过自动生化分析仪检测血液生化指标,包括SCR 和BUN.
1.8 大鼠肾组织病理改变检测
给药第42 天末,取出肾脏组织,在体积分数10%的福尔马林溶液中固定,之后进行石蜡包埋和切片,切片的染色采用苏木精-伊红染色法(hematoxylin-eosin staining,HE staining),最后将染好的切片置于光镜下观察并拍摄肾脏组织的病理形态改变.
1.9 统计分析
数据按照均数和标准差的方式进行表示,即Mean±SD.由于实验分组较多(6组),因此采用了单因数方差分析(One-Way ANOVA),分析软件使用的是SPSS,P<0.05认为有统计学意义.
2 结果
2.1 给药后大鼠体质量、精神和毛发变化
造模1周后,注射阿霉素的大鼠开始显得精神委靡、食欲减退、体毛凌乱无光,且出现脱毛现象,并随着时间延长而加剧,尾部出现红肿;在3周后个别大鼠尾部甚至产生了糜烂,且身体开始出现水肿,随着时间的延长水肿也逐渐加剧.相对而言,补中益气汤组虽然较对照组的大鼠在体质量、精神和毛发上都出现了不良反应,但是较模型组则显得更为活跃,食量更多,体质量也要偏高,脱毛和水肿也较为轻微;激素组体质量、精神、食量、水肿和毛发状况则与补中益气汤的中剂量组十分接近.
在对大鼠状态进行定性观察和记录的基础上,对大鼠的体质量变化进行定量地跟踪测定.结果表明,在各个时间点注射过阿霉素的大鼠,包括了给药组、激素组和模型组,体质量都明显小于对照组(P<0.01);从造模后第2周开始相对模型组,给药组和激素组大鼠体质量均有显著增加(P<0.01),见表2和图1.
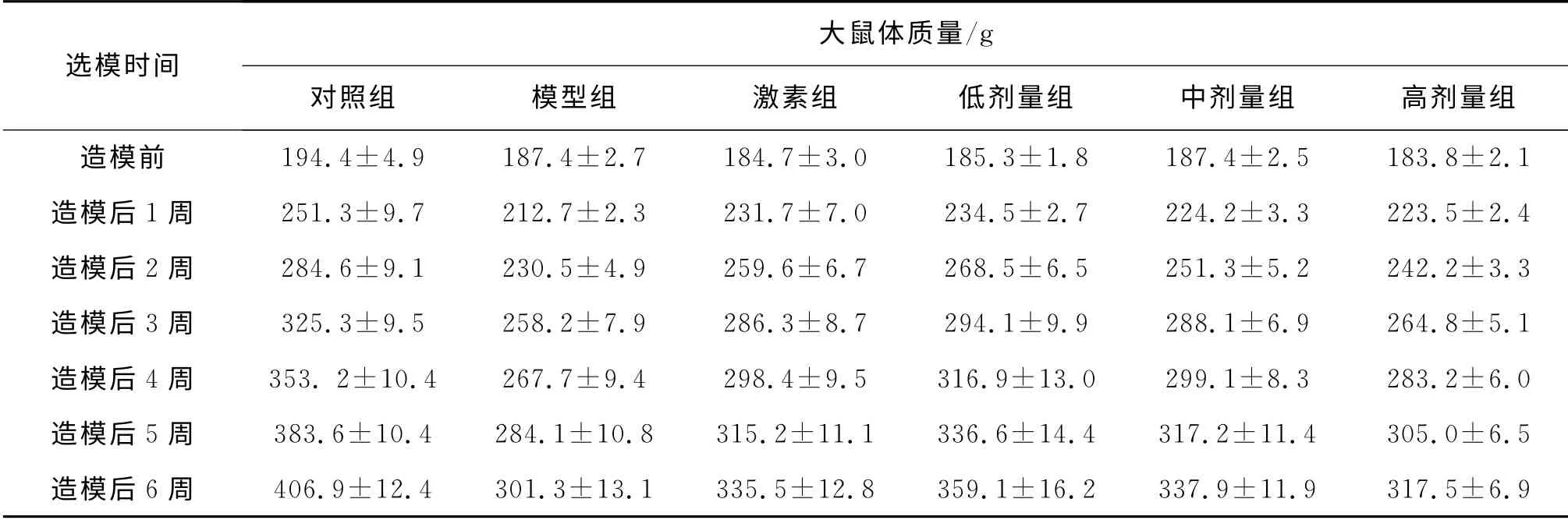
表2 各组大鼠体质量变化比较(Mean±SD,n=10)Tab.2 Mass changes of rats before and after drug administration(Mean±SD,n=10)
由图1可知,从第2周开始相对模型组,低中高剂量组和激素组均有显著增加(P<0.01),其中低剂量组的体质量增加最多.
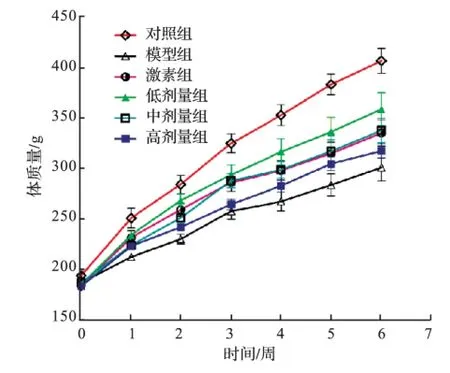
图1 各组大鼠体质量变化趋势Fig.1 Variation trend of rat weight in different groups
2.2 各组大鼠24HUP的比较
在初始随机分组后,各组大鼠的24 HUP并无统计学差异.在给药后1周、3周和6周末,模型组大鼠24HUP与对照组相比,出现显著增加(P<0.01),而补中益气汤治疗组与模型组大鼠24HUP相比,出现显著减少(P<0.05),见表3和图2.
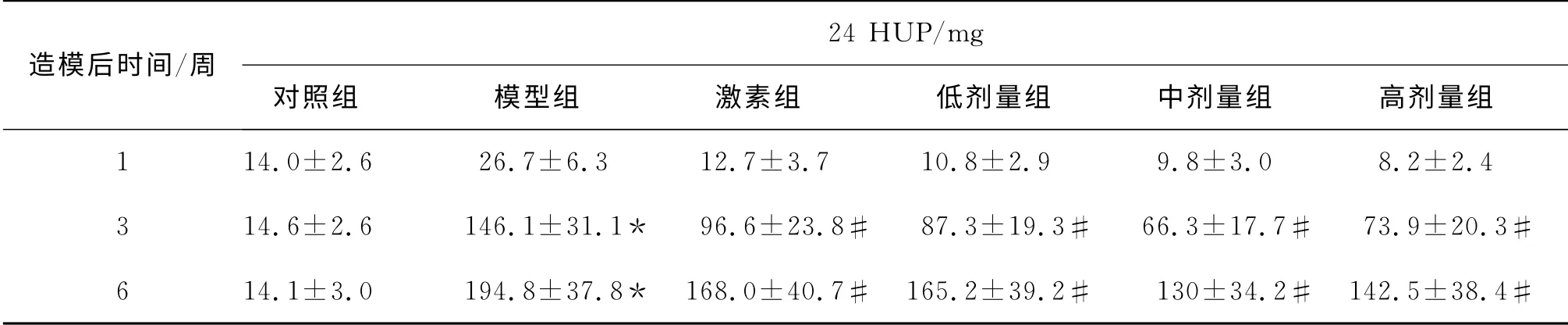
表3 各组大鼠24HUP变化(Mean±SD,n=10)Tab.3 Total 24-hour urine protein changes in different groups(Mean±SD,n=10)
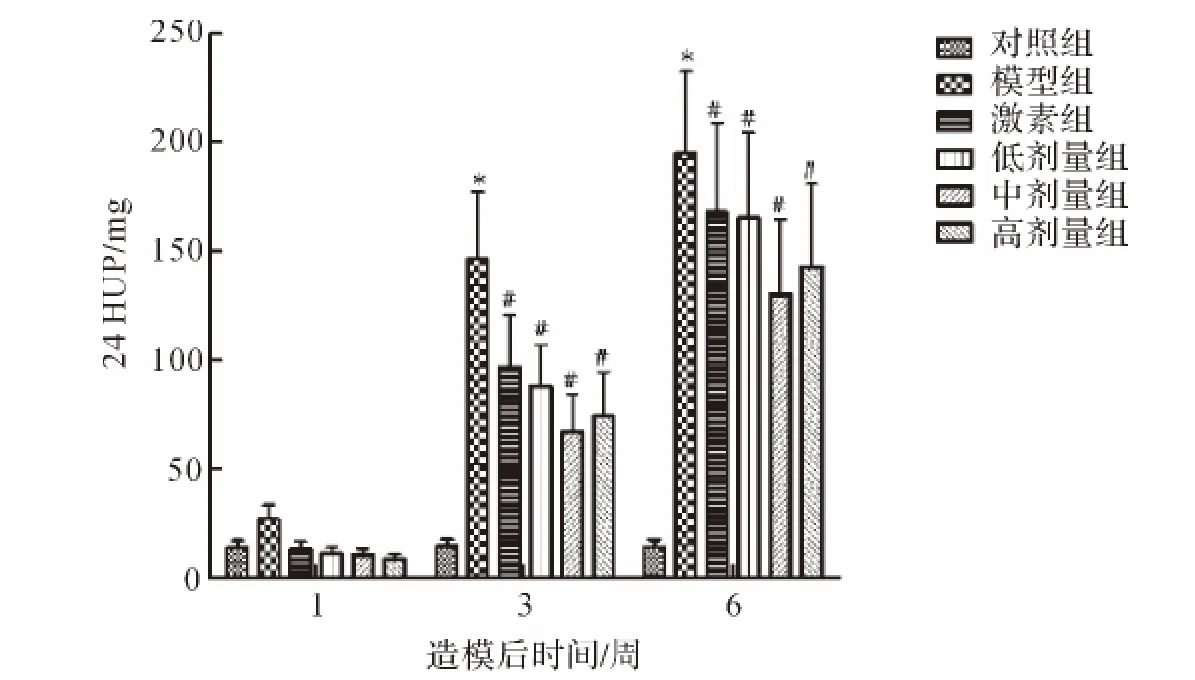
图2 造模后1周,3周和6周24HUP变化趋势Fig.2 Variation of the 24HUP tested in 1week,3weeks and 6weeks after the first adriamycin injection
2.3 各组大鼠肾功能指标的检测
给药6周后,各组大鼠血清SCR 和BUN 水平较正常对照组无显著性差异,见表4.

表4 各组大鼠肾功能比较(Mean±SD,n=10)Tab.4 Comparison of the renal functions between different drug groups
2.4 各组大鼠肾组织病理学改变
光镜下模型组大鼠肾小球系膜硬化及玻璃样变、细胞外基质增生、肾小球细胞空泡样变性、毛细血管丛萎陷及闭塞、肾小球纤维化等,均较正常对照组明显.补中益气汤治疗组大鼠肾小球形态结构较完整,细胞空泡样变性及纤维化程度较模型组轻,见图3.
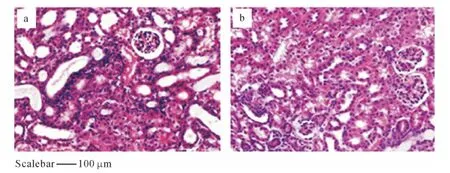
图3 模型组和治疗组大鼠肾脏组织的HE染色结果Fig.3 Rat kidney tissue with HE staining of model group and the treatment group
3 讨论
本课题组采用了大鼠二次尾静脉注射阿霉素方式,成功制作出了阿霉素肾病的大鼠模型.阿霉素肾病大鼠模型是一种经过深入研究的啮齿动物慢性肾炎模型,并且已经为揭示深藏其中的病理机制提供了诸多便利[8].阿霉素肾病有多种造模方式,而本课题组选择的方法是二次尾静脉注射阿霉素法.与单次给药造模方式相比此法有不少优点.首先,二次给药法造成的肾脏病理改变复合人的微小病变肾病(minimal change nephropathy,MCN),在第5周肾脏上皮细胞会出现空泡样变性,采用电镜观察还可以进一步看到足细胞的融合和裂隙的消失.其次,与单次给药类似,此方法在用药很短的时间内就可以造成肾脏损伤,并产生持续的尿蛋白分泌,这种损伤十分稳定,在实验中,所有注射阿霉素的大鼠都出现了尿蛋白分泌的增多.此外,二次给药法造模对大鼠的损伤相对和缓,在实验中除了个别大鼠在后期萎靡不振以外并无一例死亡,这一点给实验带来很好的保障.
对大鼠在造模过程中的体质量变化进行了跟踪记录(表2和图1),结果表明:模型组和给药组大鼠体质量的增加速度始终明显低于对照组(P<0.01),而且模型组大鼠的健康活跃度降低最为显著,并且出现明显的脱毛和食欲不振的现象.这说明阿霉素对大鼠机体的损伤是十分显著的.而给药组和模型组相比,给药组的大鼠体质量在整个6周内都明显高于模型组,这表明补中益气汤的灌胃对大鼠有一定的保护作用,在一定程度上减轻了阿霉素造成的损伤.
蛋白尿是肾脏疾病最常见的临床症状之一,也是阿霉素肾病的典型症状,肾小球滤过屏障破坏是临床上最为常见的引发蛋白尿的因素,其发生与肾小球滤过屏障的结构功能异常有关.近年来的研究揭示出,这层滤过屏障,实际上是由肾小球足细胞(podocyte)形成的足突间的裂隙隔膜(slit diaphragm,SD)来控制滤过功能的.肾小球滤过膜能够根据分子的大小进行选择性地过滤的主要根源就是这层裂隙隔膜.换句话说,SD是肾小球滤过功能的主要结构基础,它的结构的任何程度的损伤和破坏都会严重影响肾小球的滤过功能,从而产生蛋白尿[9].有研究通过电镜观察阿霉素肾病模型中病理改变发现,肾脏毛细血管内皮细胞和足细胞出现肿胀和融合,粗面内质网增大,系膜区有轻微的扩张,并且随着时间的延长,肾小球上皮细胞足突部分融合增多,致使隔膜裂隙的消失[10].蛋白尿不仅是肾脏疾病的病理产物,对肾脏也能造成进一步的损害,可引起系膜细胞损伤、增生,甚至肾小球的硬化,并且它对近曲小管细胞也有毒性作用,可导致小管基底侧释放PDGF,FN 和MCP-1,诱导纤维化过程[11].目前,已经有多篇文章在临床上初步验证了补中益气汤加味或者结合其他药物对于肾病具有一定的治疗作用,并能够降低蛋白尿,改善临床症状[12-13],但是这些工作都没有对使用的补中益气汤进行严格的质量控制;此外在这些工作中引入其他的中西药辅助治疗虽然在临床上有不错的疗效,但也模糊了补中益气汤在治疗过程中起到的作用.在本课题组的工作中,首先在药材上使用的都是同一批次大批量制作出来的生药,保证了重复性,而且并未使用补中益气汤以外的任何药材,以此得出的结论能够很好地证明纯粹的补中益气汤对于肾病的疗效.
为了检测补中益气汤具体对阿霉素肾病中典型的蛋白尿的症状的作用,采集并记录了造模开始后1周、3周和6周时的24 HUP.结果表明,在二次注射阿霉素后,大鼠开始表现出明显的尿蛋白分泌增多,其24HUP在2~6周的时间内随着时间的延长而不断地增多.相对于模型组,补中益气汤治疗组的尿蛋白分泌明显低于模型组(P<0.01).这些实验结果表明,补中益气汤能够对阿霉素肾病导致的蛋白尿产生显著的抑制作用,提示此方可能通过抑制蛋白尿起到对肾脏的保护作用.
在本研究中,首次观察到了补中益气汤对肾脏组织病变的改善作用.通过对6周末大鼠肾脏病理组织切片的形态学观察表明,模型组与正常组相比,肾小球系膜出现纤维化,系膜基质出现增生;可见空泡样变性的肾小球细胞;毛细血管出现毒性症状,如闭塞或呈结节状;在局部出现了肾小球硬化;在间质内有大量的炎症细胞浸润;肾小管病理改变明显,其结构出现肿胀和坏死,并在其腔内观察到凝聚的大量蛋白管型(图3).在给药后,可以看出补中益气汤,尤其在中剂量下,能够在一定程度上恢复阿霉素造成的肾脏组织病理改变,这也再次表明了补中益气汤对阿霉素肾病的缓解和治疗作用.已有的研究表明,除了补中益气汤外还有其他的药物能改善肾组织病理改变,比如:六味地黄汤合黄连解毒汤[14]和南洋参[15].
综上所述,本研究首次发现并证明补中益气汤能够抑制阿霉素肾病中尿蛋白的分泌,明显减轻肾小球及肾小管间质病变,而起作用机制可能是通过减少尿蛋白分泌,从而减轻了尿蛋白对系膜细胞和肾小管上皮细胞的刺激,最终起到了对肾脏的保护作用.
[1] 卢晓峰,黄海燕.黄芪治疗肾脏疾病的药理研究进展[J].现代中西医结合杂志,2008,27:4369-4370.
[2] 董超,黄威,耿兆辉,等.血府逐瘀汤对动脉粥样硬化大鼠细胞间黏附分子和脂质过氧化物的影响[J].河北大学学报:自然科学版,2012,32(6):650-654.DONG Chao,HUANG Wei,GENG Zhaohui,et al.Effects of Xuefu Zhuyu decoction on intercellular adhesion molecule and lipid peroxidation of experimental atherosclerosis rats[J].Journal of Hebei University:Natural Science Edition,2012,32(6):650-654.
[3] 赵木昆,刘春蕾.血府逐瘀汤加减治疗崩漏的应用[J].医学研究与教育,2013,30(4):23-25.ZHAO Mukun,LIU Chunlei.Study on Xuefu Zhuyu Decoction in curing metrorrhagia and metrostaxis[J].Journal of Hebei Medical College for Continuing Education,2013,30(4):23-25.
[4] 武铁岩,李丽.补中益气汤在肾病中的应用[J].中国民间疗法,2009,03:33.
[5] 祝晶.补中益气汤联合高通量血液透析治疗透析后低热20例[J].光明中医,2013,01:152-153.
[6] 李勇坚,丁木.加味补中益气汤治疗原发性肾病综合征临床观察[J].湖北中医杂志,2009,31(5):19-20.
[7] DESCHENES G,DOUCET A.Collecting duct Na+/K+-ATPase activity is correlated with urinary sodium excretion in rat nephritic syndromes[J].Journal of the American Society of Nephrology,2000,11(4):604-615.
[8] 郭继光,白杨,周广滨.阿霉素肾病动物模型的研究进展[J].江苏大学学报:医学版,2014,24(2):181-184.
[9] JARAD G,MINER J H.Update on the glomerular filtration barrier[J].Current Opinion in Nephrology and Hypertension,2009,18(3):226-232.
[10] 邢燕,丁洁,范青锋,等.三种不同药物作用下足细胞分子的变化[J].中华肾脏病杂志,2006,22(5),275-281.XING Yan,DING Jie,FAN Qingfen,et al.Changes of podocyte molecules in the intervention of three different drugs[J].Chinese Journal of Nephrology,2006,22(5),275-281.
[11] SIMERVILLE J A,MAXTED W C,PAHIRA J J.Urinalysis:a comprehensive review[J].Erratum in American Family Physician,2005,71(6):1153-1162.
[12] 吴祖金.应用玉屏风散加补中益气汤治疗慢性肾炎的临床疗效观察[J].求医问药,2013,11(8):149-150.
[13] 李勇坚,丁木.加味补中益气汤治疗原发性肾病综合征临床观察[J].湖北中医杂志,2009,31(5):19-20.
[14] 沈岚,俞立强,熊佩华.六味地黄汤合黄连解毒汤对糖尿病肾病大鼠的肾脏保护作用及相关机制[J].南京中医药大学学报,2013,29(6):553-557.SHEN Lan,YU Liqiang,XIONG Peihua.Protective effect and mechanism of Liuwei Dihuang combined with Huanglian Jiedu decoction on diabetic nephropathy rats[J].Journal of Nanjing University of Traditional Chinese Medicine,2013,29(6):553-557.
[15] 韩鹏勋,易无庸,孙惠力,等.南洋参对阿霉素肾病大鼠肾脏保护作用的初步研究[J].中国中西医结合肾病杂志,2013,14(11):963-965.HAN Pengxun,YI Wuyong,SUN Huili,et al.A preliminary study on the renal protective effect of adriamycin nephropathy rats polyscias fruticosa[J].Chinese Journal of Integrated Traditional and Western Nephrology,2013,14(11):963-965.

