高考“化学计算”试题分类例析
师殿峰
一、有关物质的量的计算
例1(2010年全国理综卷Ⅰ)一定条件下磷与干燥氯气反应,若0.25 g磷消耗掉314 mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于( ).
A.3∶1 B.5∶3 C.2∶3 D.1∶2
解析设产物中PCl3与PCl5的物质的量分别为n(PCl3)和 n(PCl5).因n(P)=0.25 g÷31 g/mol=0.008mol,n(Cl2)=0.314L÷22.4L/mol=0.014 mol,由P原子和Cl原子的物质的量守恒原则分别得,n(PCl3)+n(PCl5)=0.008 mol……①,3n(PCl3)+5n(PCl5)=0.014 mol×2……②,解方程组①②得:n(PCl3)=0.006 mol,n(PCl5)=0.002 mol;则n(PCl3)∶n(PCl5)=0.006 mol∶0.002 mol=3∶1.故答案为A.
例2(2013年海南化学卷,节选)BaCl2·xH2O中结晶水数目可通过重量法来确定:①称取1.222 g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;②过滤并洗涤沉淀;③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165 g.计算BaCl2·xH2O中的x= (要求写出计算过程).
解析由题意可知,样品中BaCl2的物质的量n(BaCl2)=n(BaSO4)=1.165 g÷233 g/ mol=
5.000×10-3 mol,其质量为m(BaCl2)=5.000×10
-3 mol×208 g/mol=1.040 g;则样品中H2O的物质的量n(H2O)=(1.222 g-1.040 g)÷18 g/mol=0.0101 mol;从而得n(H2O)∶n(BaCl2)=0.0101 mol∶5.000×10-3 mol=2.02≈2,即x=2.故答案为:2(计算过程见解析).
二、有关物质的量与粒子数的计算
例3(2014年广东理综卷)设NA为阿伏加德罗常数的数值.下列说法正确的是( ).
A.1 mol甲苯含有6NA个C-H键
B.18 g H2O含有10NA个质子
C.标准状况下,22.4 L氨水含有NA个NH3分子
D.56 g铁片投入足量浓硫酸中生成NA个SO2分子
解析甲苯(C6H5-CH3)分子中含有8个C-H键,则1 mol甲苯含有8 mol C-H键,即1 mol甲苯含有8NA个C-H键;H2O分子中含有10个质子,18 g H2O的物质的量为1 mol(即18 g÷18 g/mol=1 mol),则18 g H2O含有10NA个质子;标准状况下氨水为液体,22.4 L氨水的物质的量不是1 mol,其含有的NH3分子不是NA个;铁在常温下遇浓硫酸产生钝化现象,在加热时与足量的浓硫酸反应生成Fe3+(Fe-3e-→Fe3+),56 g铁的物质的量为1 mol(即56 g
÷56 g/mol=1 mol),根据得失电子守恒原则可知56 g铁片与足量浓硫酸反应生成SO2(H2SO4+
2e-→SO2)的物质的量为1.5 mol,即56 g铁片投入足量浓硫酸中生成1.5NA个SO2分子.故答案为B.
例4(2014年江苏化学卷)设NA为阿伏加德罗常数的值.下列说法正确的是( ).
A.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.0.1 mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2 L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA
解析氧气和臭氧都是由氧原子形成的单质,1.6 g由氧气和臭氧组成的混合物中含氧原子的物质的量为0.1 mol(即1.6 g÷16 g/mol=0.1 mol),其含有氧原子的数目为0.1NA;丙烯酸(CH2=CH-COOH)分子中含有2个双键,则0.1 mol丙烯酸中含有双键的数目为0.2NA;标准状况下苯为液体,11.2 L苯的物质的量不是0.5 mol,其含有分子的数目不为0.5NA;在过氧化钠与水的反应(2Na2O2+2H2O4NaOH+O2↑)中,Na2O2既是氧化剂又是还原剂,氧元素的化合价部分从-1价升高到0价(生成O2),部分从-1价降低到-2价,即生成1 mol氧气转移2 mol电子,则每生成0.1 mol氧气转移电子的数目为0.2NA.故答案为A.
三、有关物质的量浓度的计算
例5(2010年海南化学卷)把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( ).
A.[(b-a)/V]mol/LB.[(2b-a)/V]mol/L
C.[2(b-a)/V] mol/L D.[2(2b-a)/V]mol/L
解析在MgSO4和K2SO4的混合溶液中,根据电荷守恒原则得,c(Mg2+)×2+c(K+)=
c(SO2-4)×2;因Mg2++2OH-Mg(OH)2↓,则c(Mg2+)=a mol/2×2÷V L=(a/V)mol/L;因SO2-4+Ba2+BaSO4↓,则c(SO2-4)=b mol×2÷V L=(2b/V)mol/L;从而可得,(a/V)mol/L×2+c(K+)=
(2b/V)mol/L×2,解得c(K+)=[2(2b-a)/V]mol/L.故答案为D.
例6(2010年全国理综课标卷)把500 mL 有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( ).
A.0.1(b-2a)mol/L B.10(2a-b)mol/L
C.10(b-a)mol/L D.10(b-2a)mol/L
解析在500 mL混合溶液中,n(Ba2+)=n(SO2-4)=5a mol,则c(Ba2+)=5a mol÷0.5 L=10a mol/L;n(Cl-)=n(Ag+)=5b mol,则c(Cl-)=5b mol÷0.5 L=10b mol/L.由电荷守恒原理得,c(Ba2+)×2
+c(K+)=c(Cl-),即10a mol/L×2+c(K+)=10b mol/L,解得c(K+)=10(b-2a)mol/L.故答案为D.
四、有关氧化还原反应的计算
例7(2012年海南化学卷)将0.195 g锌粉加入到20.0 mL的0.100 mol/L MO+2溶液中,恰好完全反应,则还原产物可能是( ).
A.M B.M2+ C.M3+ D.MO2+
解析设还原产物中M的化合价为x.因Zn-2e-→Zn2+,MO+2+(5-x)e-→Mx;则根据得失电子守恒原则得,(0.195 g÷65 g/mol)×2=0.100 mol/L×20.0×10-3L×(5-x),解得x=+2,即还原产物可能为M2+.故答案为B.
例8(2014年上海化学卷)含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气.若砷的质量为1.50mg,则( ).
A.被氧化的砒霜为1.98mg
B.分解产生的氢气为0.672 mL
C.和砒霜反应的锌为3.90mg
D.转移的电子总数为6×10-5NA
解析砒霜(As2O3)中砷的化合价为+3价,砷化氢(AsH3)中砷的化合价为-3价,即砒霜被还原,A项错误.因题中没有给出温度和压强的条件,不能确定产生氢气的体积,B项错误.因As2O3+6e-→2AsH3,而n(As)=1.50×10-3 g÷75 g/mol=2×10-5mol,则砒霜转化为砷化氢得到电子的物质的量为2×10-5mol×6=1.2×10-4mol;因Zn-2e-→Zn2+,根据得失电子守恒原则可知,Zn失去电子的物质的量为1.2×10-4mol,则65 g∶2mol=m(Zn)∶1.2×10-4mol,解得m(Zn)=3.90×10-3 g=3.90 mg,C项正确;因AsH3-3e-→As,由AsH3转化为As转移电子
的物质的量为2×10-5mol×3=6×10-5mol,从而可知,转移的电子总数为(1.2×10-4mol+6×10-5
mol)×NA mol-1=1.8×10-4NA,D项错误.故答案为C.
五、有关溶液pH的计算
例9(2010年海南化学卷)常温下,将0.1 mol/L氢氧化钠溶液与0.06 mol/L硫酸溶液等体积混合,该混合溶液的pH等于( ).
A.1.7 B.2.0 C.12.0 D.12.4
解析设氢氧化钠溶液与硫酸溶液的体积均为1 L.由题意可知酸过量,则混合溶液中c(H+)=(0.06 mol/L×2×1 L-0.1 mol/L×1 L)÷2 L=0.01 mol/L;由公式pH=-lg{c(H+)}得,pH=-l g 0.01=2.故答案为B.
例10(2013年全国理综课标卷Ⅱ)室温时,
M(OH)2(s)M2+(aq)+2OH-(aq),Ksp=a;c(M2+)=b mol/L时,溶液的pH等于( ).
A.12lg(ba) B.12lg(ab)
C.14+12lg(ba)
D.14+12lg(ab)
解析因Ksp=c(M2+)·c2(OH-)=b·c2(OH-)=a,解得c(OH-)=(ab)12 mol/L;则c(H+)=1×10-14(ab)12mol/L=1×10-14×(ab)-12mol/L,pH=
-lg{1×10-14×(ab)-12}=14+12lg(ab).故答案为D.
六、有关反应热的计算
例11(2013年海南化学卷)已知下列反应的热化学方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)2C3H5(ONO2)3(l)ΔH1
②2H2(g)+O2(g)2H2O(g) ΔH2
③C(s)+O2(g)CO2(g) ΔH3
则反应④4C3H5(ONO2)3(l)12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为( ).
A.12ΔH3+5ΔH2-2ΔH1 B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5ΔH2-2ΔH1 D.ΔH1-5ΔH2-12ΔH3
解析将题给四个热化学方程式依次编号为①、②、③、④;根据盖斯定律,将③式×12+②式×5-①式×2得④式:4C3H5(ONO2)3(l)12CO2(g)+10H2O(g)+O2(g)+6N2(g)ΔH=12ΔH3+5ΔH2-2ΔH1.故答案为A.
例12(2014年重庆理综卷)已知:
C(s)+H2O(g)CO(g)+H2(g)
ΔH=a kJ/mol
2C(s)+O2(g)2CO(g)
ΔH=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为( ).
A.-332 B.-118 C.+350 D.+130
解析将题给2个热化学方程式依次编号为①、②,根据盖斯定律,②式-①式×2得2H2(g)+O2(g)2H2O(g)ΔH=-(220+2a)kJ/mol;因反应热=反应物键能之和-生成物键能之和,则(2×436 kJ/mol+496 kJ/mol)-2×2×462 kJ/mol=-(220+2a)kJ/mol,解得a=+130.故答案为D.
七、有关沉淀溶解平衡的计算
例13(2010年海南化学卷)已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( ).
A.AgCl>AgI>Ag2CrO4
B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl
解析因AgCl(s)Ag+(aq)+Cl-(aq),Ksp(AgCl)=c(Ag+)· c(Cl-)=1.8×10-10,则c(Ag+)=Ksp(AgCl)mol/L=
1.8×10-10mol/L=1.8
×10-5mol/L;AgI(s)Ag+(aq)+I-(aq),Ksp(AgI)=c(Ag+)·c(I-)=1.5×10-16,则c(Ag+)=
Ksp(AgI)mol/L=
1.5×10-16mol/L=1.5×
10-8mol/L;Ag2CrO4(s)2Ag+(aq)+CrO2-4(aq),Ksp(Ag2CrO4)=c2(Ag+)· c(CrO2-4)=2.0×10-12,设在Ag2CrO4饱和溶液中,Ag+的浓度为2x,则CrO2-4的浓度为x;则Ksp(Ag2CrO4)=c2(Ag+)·c(CrO2-4)=(2x)2·x=2.0×10-12,解得x=30.5×10-12
mol/L=30.5×10-4mol/L,即
c(Ag+)
=2x=230.5×10-4mol/L;从而可知Ag+浓度大小顺序为Ag2CrO4>AgCl>AgI.故答案为C.
例14(2014年全国理综课标卷I)已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4) =9×10-11.某溶液中含有Cl-、Br-和CrO2-4,浓度均为0.010 mol/L,向该溶液中逐滴加入0.010 mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( ).
A.Cl-、Br-、CrO2-4 B.CrO2-4、Br-、Cl-
C.Br-、Cl-、CrO2-4 D.Br-、CrO2-4、Cl-
解析设Cl-、Br-、CrO2-4 刚开始沉淀时所需银离子的浓度分别为x mol/L、y mol/L
、z mol/L.根据Ksp可得:Ksp(AgCl)=0.01x=1.56×10-10,Ksp(AgBr)=0.01y=7.7×10-13,Ksp(Ag2CrO4)=0.01z2=9×10-11,解得x=1.56×10-8,y=7.7×10-11,z=3×10-4. 5,即y 八、有关混合物的计算 例15(2013年四川理综卷)1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到 2.54 g沉淀,下列说法不正确的是( ). A.该合金中铜与镁的物质的量之比是2∶1 B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L C.NO2和N2O4的混合气体中,NO2的体积分数是80% D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL 解析对于A项,向反应后的溶液中加入NaOH溶液,生成Mg(OH)2和Cu(OH)2沉淀,则m[Mg(OH)2+Cu(OH)2]=m(铜镁合金)+m(OH-)=1.52 g+m(OH-)=2.54 g;且根据电荷守恒原理可知,铜镁失去电子的物质的量n(e-)= n(OH-)=m(OH-)÷17 g/mol=(2.54 g-1.52 g)÷17 g/mol= 0.06 mol;设合金中铜和镁的物质的量分别为n(Cu)和n(Mg),则n(Cu)×64 g/mol+n(Mg)×24 g/mol=1.52 g(合金的质量)……①,n(Cu)×2+n(Mg)×2=0.06 mol(合金失去电子的物质的量)……②,解方程组①②得,n(Cu)=0.02 mol,n(Mg)=0.01 mol,从而得n(Cu)∶n(Mg)=0.02 mol∶0.01 mol=2∶1,A项正确.对于B项,c(HNO3)=(1000 mL×1.40 g/ mL×63%)÷63 g/mol=14.0 mol/L,B项正确.对于C项,因n(NO2+N2O4)=1.12 L÷22.4 L/mol=0.05 mol,设NO2和N2O4 的混合气体中NO2的物质的量为n(NO2),则N2O4的物质的量为[0.05 mol-n(NO2)];根据得失电子守恒原则得,n(NO2)×1+[0.05mol-n(NO2)]×2=0.06 mol,解得n(NO2)=0.04 mol,根据阿伏加德罗定律得混合气体中NO2的体积分数为(0.04 mol÷0.05 mol)×100%=80%,C项正确.对于D项,得到2.54 g沉淀时,溶液中的溶质只有NaNO3,根据Na+离子和N原子守恒原则得n(NaOH)=
n(NaNO3)=n(HNO3)-n(NO2)-n(N2O4)×2=14.0mol/L×0.050 L-0.04 mol-0.01 mol×2=0.64 mol,从而得V(NaOH)=0.64 mol÷1.0 mol/L=0.64 L=640 mL,D项不正确.故答案为D.
例16(2013年上海化学卷)一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO2-4)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为( ).
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
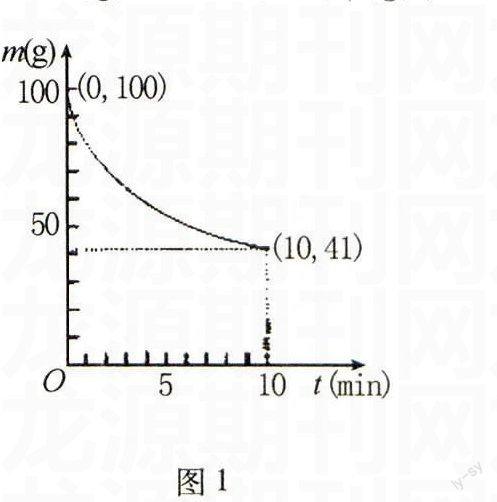
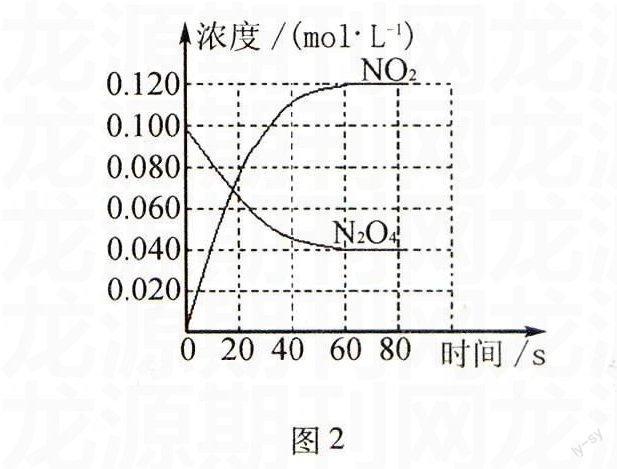
解析若全部是CuS,其物质的量为n(CuS)=n(CuO)=12 g÷80 g/mol=0.15 mol;设生成NO和NO2的物质的量均为x(下同).因HNO3+3e-→NO,HNO3+e-→NO2,CuS-8e-→SO2-4;则根据得失电子守恒原则得,3x+x=0.15 mol×8,解得x=0.3 mol;从而得气体体积V=(0.3 mol+0.3 mol)×22.4 L/mol=13.44L.若全部是Cu2S,其物质的量为n(Cu2S)=1/2×n(CuO)=1/2×(12 g÷80 g/mol)=0.075 mol;因HNO3+3e-→NO,HNO3+e-→NO2,Cu2S-10e-→Cu2++SO2-4;则根据得失电子守恒原则得,3x+x=0.075 mol×10,解得x=0.1875 mol;从而得气体体积V=(0.1875 mol+0.1875 mol)×22.4 L/mol=8.4 L.因实际是CuS和Cu2S的混合物,则8.4 L 九、有关化学反应速率的计算 例17(2013年上海化学卷,节选)制备 Ni(CO)4的反应为Ni(s)+4CO(g)50℃ Ni(CO)4(g),已知在一定条件下的2L密闭容器中制备Ni(CO)4, 图1 粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时 间的关系如图1所示.Ni(CO)4在0~10min的平均反应速率 为 . 解析由图像信息可知,10 min时参加反应的Ni的物质的量 为(100 g-41 g)÷59 g/mol=1 mol;由反应可知,生成Ni(CO)4的物 质的量为1 mol,即Δc[Ni(CO)4]=1 mol÷2 L=0.5 mol/L;则由公式 v=Δc/Δt得,v[Ni(CO)4]=0.5 mol/L÷10 min=0.05 mol/(L·min).故 答案为:0.05 mol/(L·min). 例18(2014年全国理综课标卷Ⅱ,节选)在容 积为1.00 L的容器中,通入一定量的N2O4,发生反 应:N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深.100℃时,体系中各物质浓度随时间变化如 图2所示.在0~60 s时间段,反应速率v(N2O4)为 mol/(L·s). 图2 解析在0~60 s时间段,N2O4浓度的变化 Δc(N2O4) =(0.100-0.040)mol/L=0.060 mol/L,则由公式v=Δc/Δt得 ,v(N2O4)=0.060 mol/L÷60 s=0.001 mol/(L·s).故答案为:0.001. 十一、有关化学平衡的计算 例19(2014年重庆理综卷,节选)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢. (g)FeSO4/Al2O3高温(g)+3H2(g) 在某温度下,向恒容容器中加入环己烷,其起始浓度为a mol/L,平衡时苯的浓度为b mol/L,该反应的平衡常数K=. 解析因为 (g)FeSO4/Al2O3高温(g)+3H2(g) 起始物质的量浓度(mol/L) a 0 0 转化物质的量浓度(mol/L) b b 3b 平衡物质的量浓度(mol/L) a-b b 3b 则平衡常数K=c(苯)·c3(H2)c(环己烷)=b mol/L×(3b mol/L)3(a-b)mol/L=27b4a-bmol3/L3. 故答案为27b4a-b mol3/L3. 例20(2014年福建理综卷,节选)已知t℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25. (1)t℃时,反应达到平衡时n(CO)∶n(CO2)=. (2)若在1 L密闭容器中加入0.02 mol FeO(s),并通入x molCO,t℃时反应达到平衡.此时FeO(s)的转化率为50%,则x= . 解析(1)设容器的体积为V L.由题意可知, K=c(CO2)c(CO)=n(CO2)/Vn(CO)/V=0.25, 解得n(CO)︰n(CO2)=4︰1. (2)由题意可知,达到平衡时参加反应的FeO(s)的物质的量为0.02 mol×50%=0.01mol.则 FeO(s)+CO(g)Fe(s)+CO2(g) 起始物质的量(mol) 0.02x 0 0
转化物质的量(mol)
0.01 0.01 0.01 0.01
平衡物质的量(mol) x-0.01 0.01
从而得,n(CO)︰n(CO2)=(x-0.01) mol︰0.01 mol=4︰1,解得x=0.05.
故答案为:(1)4︰1;(2)0.05.
十二、有关化学反应速率与化学平衡的计算
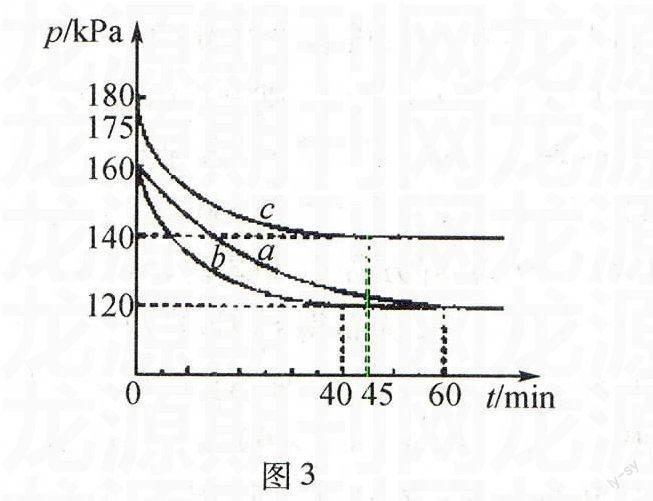
例21(2014年全国理综大纲卷,节选)反应AX3(g)+X2(g)AX5(g)在容积为10 L的密闭容器中进行.起始时AX3和X2均为0.2 mol.反应在不同条件下进行,反应体系总压强随时间的变化如图3所示.
图3
(1)列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)= .
(2)用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 ;实验a和c的平衡转化率: αa为、 αc为.
解析开始时总物质的量n0=0.2 mol+0.2 mol=0.4 mol,总压强为p0,平衡时总压强为p,设平衡
时总物质的量为n.则p/p0=n/n0=n/0.4,
解得n=0.4 mol×p/p0.设达到平衡时参加反应的AX3的物
质的量为x mol.则
AX3(g)+X2(g)AX5(g)
开始物质的量(mol)0.2 0.2 0
转化物质的量(mol) x x x
平衡物质的量(mol) 0.2-x 0.2-x x
平衡时的总物质的量为:(0.2-x)mol+(0.2-x)mol+x mol=(0.4-x)mol=0.4 mol×p/p0,解得x=0.4(1-p/p0).
(1)对于实验a,p=120 kPa,p0=160 kPa,则x=0.4(1-p/p0)=0.4(1-120 kPa/160 kPa)=0.1;由公式v=Δc/Δt得,v(AX5)=(0.1 mol÷10 L)÷60 min=1.7×10-4mol/(L·min).
(2)根据转化率的概念可得,α=x mol÷0.2 mol,将x=0.4(1-p/p0)代入得,α=2(1-p/p0);对于实验a,p=120 kPa,p0=160 kPa,则α=2(1-120 kPa/160 kPa)=50%;对于实验c,p=140 kPa,p0=175 kPa,则c=2(1-140 kPa/175 kPa)=40%.
故答案为:(1)1.7×10-4mol/(L·min);
(2)2(1-p/p0),50%,40%.
十三、考查有机物燃烧的计算
例22(2010年全国理综卷Ⅱ)在一定的温度、压强下,向100 mL CH4和Ar的混合气体中通入400 mL O2,点燃使其完全反应,最后在相同条件下得到干燥气体460 mL,则反应前混合气体中CH4和Ar的物质的量之比为( ).
A.1︰4B.1︰3 C.1︰2 D.1︰1
解析设混合气体中CH4的体积为V(CH4).则
CH4+2O2点燃CO2+2H2O气体体积差量
1 mL ︰ 2 mL
V(CH4) ︰ 40 mL
1 mL︰2 mL=V(CH4)︰40 mL,解得V(CH4)=20 mL;从而得V(Ar)=100 mL-20 mL=80 mL,
n(CH4)︰n(Ar)=V(CH4)︰V(Ar)=20 mL︰80 mL=1︰4.故答案为A.
例23(2011年四川理综卷)25℃和101 kPa时,乙烷、乙炔和丙烯组成的混合烃32 mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72 mL,原混合烃中乙炔的体积分数为( ).
A.12.5% B.25% C.50% D.75%
解析设混合烃的平均分子式为CnHm.则
CnHm+(n+m/4)O2nCO2+m/2H2O 气体体积差量(减少)
1 mL∶(1+m/4)mL
32 mL∶72 mL
1 mL︰(1+m/4) mL=32 mL︰72 mL,解得m=5,即平均氢原子数是5.由于乙烷和丙烯分子中均含有6个氢原子,可把乙烷和丙烯看作一种物质,乙炔分子中含有2个氢原子.则
C2H6(C3H6):65C2H2:231,
即C2H6(C3H6)与C2H2的体积比为3︰1;从而得乙炔
的体积分数为1/4×100%=25%.故答案为B.
十四、有关综合计算
例24(2014年上海化学卷)硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用.在实验室,浓硫酸是常用的干燥剂.完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸.若将445 g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 mol/L.
(2)若以浓硫酸吸水后生成的H2SO4·H2O计算,250 g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料.硫铁矿氧化焙烧的化学反应如下:3FeS2+8O2→Fe3O4+6SO2,4FeS2+11O2→2Fe2O3+8SO2.
若48 mol FeS2完全反应耗用氧气2934.4 L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比.
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法.硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体).(已知空气组成:N2体积分数0.79、O2体积分数0.21)
解析(1)445 g焦硫酸的物质的量为445 g÷178 g/mol=2.5 mol,其中H2SO4和SO3的物质的量均为2.5 mol,2.5 mol SO3与水反应又可生成
2.5 mol H2SO4,则溶液中H2SO4的物质的量为
2.5 mol+2.5 mol=5.0 mol.故硫酸的物质的量浓度c(H2SO4)=5.0 mol÷4.00 L=1.25 mol/L.
(2)250 g质量分数为98%的硫酸中,H2SO4的质量为250 g×98%=245 g,则溶剂水的质量为250 g-245 g=5 g;H2SO4的物质的量为245 g÷98 g/mol=2.5 mol,2.5 mol H2SO4可以结合水的物质的量为2.5 mol,即可以结合水的质量为2.5 mol×18 g/mol=45 g,因此还可以吸收水的质量为m(H2O)= 45 g-5 g=40 g.
(3)反应耗用氧气的物质的量为2934.4 L÷22.4 L/mol=131 mol.设Fe3O4与Fe2O3的物质的量分别为x和y.由反应3FeS2+8O2→Fe3O4+6SO2可知,生成Fe3O4消耗O2的物质的量为8x,由反应4FeS2+11O2→2Fe2O3+8SO2可知,生成Fe2O3消耗O2的物质的量为5.5y,则8x+5.5y=131 mol……①;由铁元素守恒原则得,3x+2y=48 mol……②;解方程组①②得,x=4 mol,y=18 mol,从而得Fe3O4与Fe2O3物质的量之比=x︰y=4 mol︰18 mol=2︰9.
(4)设混合气体体积为1体积.由H2S完全燃烧的反应2H2S+3O2点燃2SO2+2H2O可知,0.84体积的H2S完全燃烧消耗1.26体积O2、生成0.84体积SO2和0.84体积水蒸气,因反应中空气过量77%,因此所需空气的体积为(1.26÷0.21)×177%=10.62体积,则产物气体中SO2的体积分数为[0.84体积÷(10.62-1.26+0.84+0.84+0.16)体积]×100%=7.5%.
故答案为:(1)1.25;(2)40;(3)2︰9;(4)7.5%(或0.075).
(收稿日期:2015-02-10)

