CuCl2对石油稠油O
—H…X(X=N,O,S)氢键削弱的量化计算研究
刘红飞宁夏大学物理电气信息学院 (宁夏银川 750021)
科研开发
CuCl2对石油稠油O
—H…X(X=N,O,S)氢键削弱的量化计算研究
刘红飞
宁夏大学物理电气信息学院 (宁夏银川750021)
摘要稠油分子间存在大量O—H…X(X=N,O,S)氢键,造成其分子间作用力和黏度较大,以过渡金属化合物为催化剂来削弱氢键是降低分子间作用力的主要方法。采用密度泛函理论B3LYP方法,使用Gaussian 03程序,以CuCl2作催化剂,对稠油间CuCl2—O—H…X(X=N,O,S)氢键的攻击削弱进行了计算。结果表明,CuCl2不仅增加了氢键的键长,使N,O,S的净电荷发生了转移,还使得系统的前线能隙下降,从而有效削弱了氢键。
关键词键长氢键密度泛函理论能量
石油是当今世界最主要的能源之一,随着现代工业的高速发展,常规石油储量急剧减少,石油危机已成为制约社会发展的重要因素之一。为了保障社会的可持续发展,作为常规石油替代品的稠油成为研究的重点[1-3]。相对于常规石油而言,稠油主要由沥青质和胶质组成,相对分子质量大、黏度大、不易开采和运输,但其储量丰富,是常规原油的三倍;组成多为含烷基支链和含杂原子的多环芳核和环烷芳核形成的三维缔合网络结构,含有大量的O,N,S等杂原子,广泛地分布在羟基、酯基、氨基、巯基等基团中,与稠油中富含的酸类化合物中的羧基形成O—H…N,O—H…O,O—H…S等氢键和其他非常规氢键,其中O—H…N,O—H…O,O—H…S键的强度最大,造成分子间内聚力增大,使稠油表现出黏度大的性质[4-7]。由于稠油组成比较复杂,用简单分子吡啶中的N原子、呋喃中的O原子、噻吩中的S原子作为氢键的质子受体,丙酸中羧基上的O—H基团作为供体,可以构成O—H…N,O—H…O,O—H…S氢键,以CuCl2作为催化剂去削弱氢键,运用密度泛函理论(DFT)对所选定的系统构建模型,并进行计算研究,解释其削弱氢键达到降低稠油黏度的机理。
1 计算方法
采用基于DFT的B3LYP方法,计算软件使用Gaussion 03程序[8]。在基组方面,Cu原子使用Lanl2dz基组[9-10],C,H,O使用6-31+G*基组,该方法在过渡金属开壳层体系电子结构的相关计算中,具有效率高、能满足精度要求等优点。
2 结果及讨论
以键长来分析:对比添加CuCl2前后氢键的几何结构(见图1)和表1中的键长,可以看出加入CuCl2后,O14—H22…N3形成的氢键发生了明显变化,其H22…N3的键长由1.728 Å变为3.944 Å,N3和H22的作用距离明显增加,作用力显著减小。而同时O14—H22的键长由1.010 Å变为0.982 Å,变化不大。因此从键长上看O14—H22…N3氢键强度大幅削弱。从图1中的a和d可以看出,加入CuCl2后,C5H5N的位置相对没有发生变化,CH3CH2COOH中的H22—O14逆时针方向向右偏转,同时二者之间距离拉开。N3,H22,O14构成的键角也由之前接近直线的179.29°变为53.7°,H22…N3和O14—H22作用力的合力也大为降低。O19—H20…O5形成的氢键键长发生了明显变化,H20…O5的键长由1.956 Å变为4.371 Å,O5和H20之间的距离明显增加,作用力显著减小。而同时H20—O19的键长由0.974 Å变为0.973 Å,变化不大,因此从键长上看O19—H20…O5氢键大为削弱。同时对比图1中的b和e可以看出,加入CuCl2后,C4H4O顺时针旋转导致O5向左旋转,CH3CH2COOH中的H20—O19逆时针方向向右偏转,同时二者之间距离拉开。CH3CH2COOH和C4H4O的距离增加,作用力减小。O19—H20…S5氢键发生了明显变化,其H20…S5的键长由2.588 Å变为4.457 Å,S5和H20的作用距离明显增加,作用力减小显著。而同时H20—O19的键长由0.977 Å变为1.008 Å,变化不大,因此从键长上看O19—H20…S5氢键的强度大为削弱。加入的CuCl2,C4H4S位置基本没有变化,CH3CH2COOH中的H20—O19相对于C4H4S逆时针方向偏转,同时二者之间距离拉开。以上分析表明:O—H…N,O—H…O,O—H…S键长明显增加,氢键被削弱。
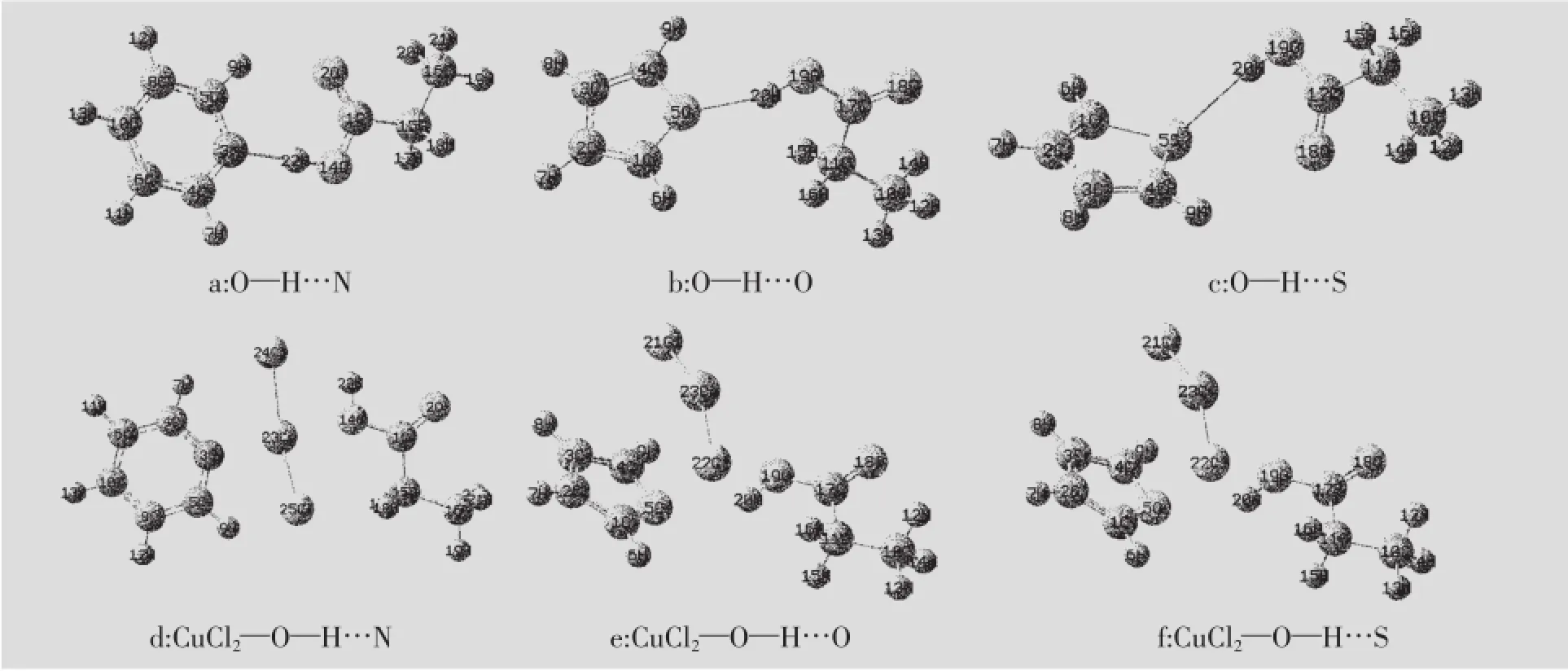
图1 CuCl2—O—H…X(X=N,O,S)的优化结构
以净电荷来分析:O14—H22…N3氢键中N3所带的净电荷由-0.174变为0.076,减少了0.250;H22所带的净电荷由0.624变为0.539,降低了0.085;O14所带的净电荷由-0.434变为-0.632,增加了0.198。N3减少的净电荷比O14增加的净电荷要多0.052,结合键长增加的情况,键长的变化是主要因素,因而整体表现出氢键削弱的状况。O19—H20…O5氢键中O5所带的净电荷由-0.280变为-0.187,减少了0.093;H20所带的净电荷由 0.477变为 0.510,降低了0.067;O19所带的净电荷由-0.432变为-0.547,增加了0.115。在加入CuCl2之前,O19—H20…O5氢键两端的O5和O19均带负净电荷,对H20产生吸引作用,使氢键将CH3CH2COOH和C4H4O紧密地结合在一起;加入CuCl2后,O5带正净电荷,与H20产生排斥作用,将H20推向O19,O19净电荷小幅增加,对H20的吸引作用增强,使氢键削弱并趋于断裂。O19—H20…S5氢键中S5所带的净电荷由-0.025变为0.352,S原子的净电荷向周围的C4,C3,C2,C1转移;H20所带的净电荷由0.386变为0.405,O19所带的净电荷由-0.369变为-0.526,可知在加入CuCl2之前,O19—H20…S5氢键两端的S5和O19均带负净电荷,对H20产生吸引作用,使氢键将CH3CH2COOH和C4H4S紧密地结合在一起;加入CuCl2之后,S5带正净电荷,与H20产生排斥作用,将H20推向O19,而O19净电荷小幅增加,将H20向自己吸引,使氢键趋于断裂。
以能量来分析(见表2):在O—H…X(X=O,N,S)氢键中,O—H…O键强度最大,其能隙高达612.1 kJ/mol,最不易被削弱。原因在于,一方面O的电负性为3.44,大于N和S的电负性(3.04和2.58)。在O—H…N系统中,其Homo(最高占据分子轨道)能量为-690.8 kJ/mol,Lumo(最低未占分子轨道)能量为-143.2 kJ/mol,前线能隙为547.6 kJ/mol。加入CuCl2后,Homo和Lumo能量均增大,但是前线能隙下降了44.4 kJ/mol,因此系统中电子更容易发生跃迁。O—H…O系统Homo能量为-680.4 kJ/mol,Lumo能量为-68.2 kJ/mol,前线能隙为612.1 kJ/mol,加入CuCl2后,Homo能量没发生明显变化,Lumo能量增加到-162.9 kJ/mol,前线能隙下降了101.7 kJ/mol。O—H…S系统Homo能量为-646.4 kJ/mol,Lumo能量为-76.6 kJ/mol,前线能隙为569.8 kJ/mol,CuCl2—O—H…S中,前线能隙为535.1 kJ/mol,比O—H…S系统的前线能隙下降了34.7 kJ/mol。对O—H…X (X=O,N,S)而言,加入CuCl2后,系统的能隙大幅降低,电子更容易发生跃迁,系统的稳定度降低,更加活跃,氢键明显弱化,达到了对其削弱的目的。
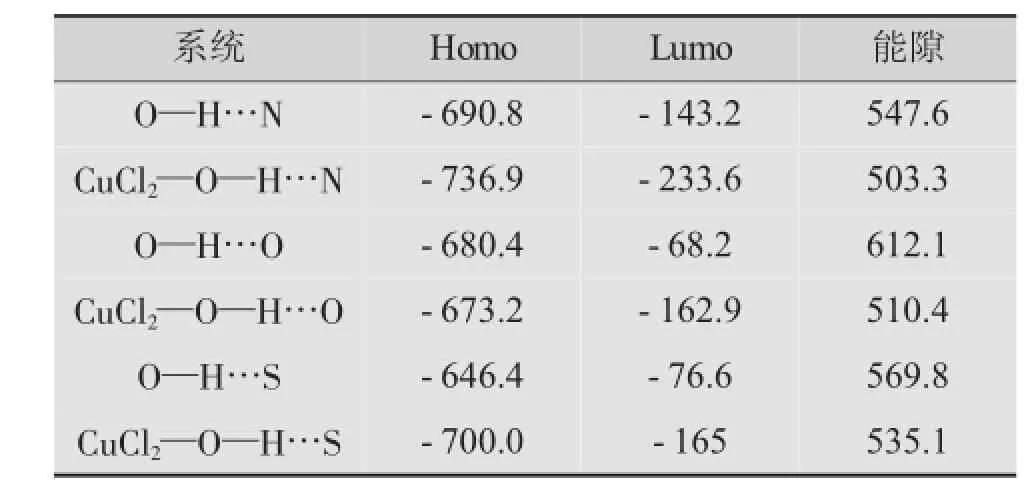
表2 O—H…X(X=N,O,S)能量变化情况 kJ/mol
3 结论
CuCl2的加入使氢键键长明显增加、净电荷发生转移,同时系统的前线能隙大幅降低,电子更容易发生跃迁,系统的稳定度降低,达到了削弱氢键的目的,进而表明CuCl2具有较好的削弱氢键的能力。
参考文献:
[1]刘永建,钟立国,范洪富,等.稠油的水热裂解反应及其降粘机理 [J].大庆石油学院学报,2002,26(3):95-98, 122.
[2]李美蓉,向浩,马济飞.特稠油乳化降黏机理研究 [J].燃料化学学报,2006,34(2):175-178.
[3]刘永建,胡绍彬,闻守斌,等.地质催化稠油水热裂解反应可行性研究[J].特种油气藏,2007,14(5):84-87.
[4]Wilburn B E,Heilman W J.Methacrylate pour point depressants and compositions:US,07/301397[P].1989-01-25.
[5]Mishra MK,Saxton R G.Pour point depressants via anionic polymerization of(meth)acrylic monomers:US,08/957046 [P].1997-10-24.
[6]Fischer J.Terpolymer ofethylene,vinyl acetate and isobutylene useful as pour point depressants in distillate oils:US, 07/368122[P].1989-06-16.
[7]Ritter Z,Zoellner W.Esters of unsaturated carboxylic acids, preparation of their oil-soluble homo-and copolymers and use thereof as pour point depressants:US,07/187183[P]. 1988-04-28.
[8]Frisch MJ,Trucks G W,Schlegel H B,et al.Gaussian 03, Revision B.05[Z].Pittsburgh,PA:Gaussian,Inc.,2003.
[9]Hay P J,Wadt W R.Ab inito effective core potentials for molecular calcuations.Potentials for K to Au including the outer most core orbitals[J].Journal of Chemical Physics, 1985,82(1):290-310.
[10]Hay P J,Wadt W R.Ab inito effective core potentials for molecular calcuations:potentials for the transition metal atoms Sc to Hg[J].Journal ofChemical Physics,1985,82(1): 270-283.
中图分类号TE 624.4
收稿日期:2015年6月
基金项目:宁夏大学科学研究基金资助(ZR1314)
第一作者简介:刘红飞男1973年生博士副教授从事石油化工及材料化学计算方面研究工作已发表论文20余篇
Study on Quantum Chemistry Calculation of Weakening O—H…X(X=N,O,S)Hydrogen Bonds in Heavy Oil by CuCl2
Liu Hongfei
Abstract:There are large number of O—H…X(X=N,O,S)intermolecular hydrogen bonds in heavy oil,which leads to the high intermolecular forces and high viscosity.Using transition metal compounds as catalysts to weaken the hydrogen bonds is the primary method of reducing the intermolecular forces.Taking CuCl2as a catalyst and using the Gaussian 03 program,calculated the results of weakening O—H…X(X=N,O,S)hydrogen bonds by using density functional theory (DFT)at the B3LYP/6-31+G*level.The results showed that the addition of CuCl2increased the bond lengths of hydrogen bonds,transferred the net charges of N,O and S atoms,and decreased the frontier energy gap of the system,thus weakening the hydrogen bonds effectively.
Key words:Bond length;Hydrogen bond;Density functional theory;Energy

