7种肉类线粒体DNA的提取及鸭源性成分检测
曲 莉,李潇涵,王雪松,高丽君,艾金霞,李明成(.北华大学公共卫生学院,吉林吉林303;.北华大学医学检验学院,吉林吉林303)
检测分析
7种肉类线粒体DNA的提取及鸭源性成分检测
曲莉1,李潇涵2,王雪松2,高丽君2,艾金霞2,李明成2
(1.北华大学公共卫生学院,吉林吉林132013;2.北华大学医学检验学院,吉林吉林132013)
摘要:探讨肉类线粒体DNA(mitochondrial DNA,mtDNA)提取方法,对7种生肉中的鸭肉成分进行鉴别。应用改良盐析法和柱层析法提取肉类mtDNA,紫外分光光度计检测mtDNA的浓度和纯度,设计鸭肉cyt b特异性引物,采用PCR对7种生肉中的鸭肉成分进行鉴别。结果:两种提取肉类mtDNA的方法均能保证DNA的浓度及纯度达到PCR的要求,柱层析法成本略高于改良盐析法;鸭引物可以从7种生肉中鉴别出鸭源性成分,经过多次重复试验证明了鸭肉引物的特异性,为肉制品质量监控的应用提供了实验基础。
关键词:改良盐析法;柱层析法;线粒体DNA;PCR;鸭肉
近年来,肉类市场中以价格低廉的肉类掺假到价格较高肉类的欺骗行为较为常见,鸭肉作为价格低廉肉类常掺杂到牛肉、羊肉中销售,这不仅损害了消费者的利益,更威胁了少数民族的宗教信仰。因此,建立一种快速、简便、准确的鉴别肉类的方法十分必要。
目前,肉类品种的鉴定方法主要为蛋白质鉴定和核酸鉴定。当肉类经过蒸煮、煎烤等加工后,蛋白质结构被破坏,所以通过蛋白质鉴定肉类品种的方法有很大的局限性。而经过加工后核酸的结构不发生改变,因此,应用分子生物学技术对肉制品的DNA检测成为可靠的鉴定方法。Arslan A[1]研究证明,高温的水烹调肉如烹煮、蒸烤、压力处理等烹饪过的牛肉制品可以提取其线粒体DNA片段,而后经PCR扩增可以鉴别出来。2013年欧洲的“马肉风波”引发消费者的烦感,欧盟正拟订方案,要求所有成员国对加工牛肉开展脱氧核糖核酸(DNA)抽检,可见肉类品种鉴定的DNA检测为必然趋势。
线粒体DNA(mitochondrial DNA,mtDNA)比核DNA进化快,因此,物种间基因差异更大,且mtDNA拷贝数高(每个细胞中约1 600~6 000个拷贝),可有效降低食品加工造成的DNA损失[2],因此在熟肉制品和饲料等的鉴别上具备独特的优势。
在目的基因的选择上,动物线粒体编码的细胞色素b基因(cytochromeb,cytb)、12srRNA基因、16srRNA基因等均成为设计物种特异性扩增引物的良好靶标。
本研究采用两种方法提取肉类mtDNA,测定其浓度及纯度;筛选出鸭特异性引物,可以将鸭与市场上常见肉类品种区别开来。
1 材料与方法
1.1材料、试剂与仪器
采集吉林市江南菜市场新鲜的鸭、鸡、猪、牛、羊、马、驴肉(各500 g);裂解液[10 mmol/L Tris-HCl(pH= 8.0),10 mmol/L Na2EDTA,50 mmol/L NaCl],消化液[裂解液200 μL,0.5 mol/L乙二胺四乙酸二钠溶液50 μL,蛋白酶K(20 μg/mL)20 μL,RNA酶溶液5 μL],洗脱液[5 mol/L醋酸钾溶液26 μL,1 mol/LTris-HCl溶液(pH 7.5)18 μL,0.5mol/L乙二胺四乙酸二钠溶液(pH 8.0)3 μL,无水乙醇480 μL,灭菌双蒸水273 μL],十二烷基硫酸钠SDS(10%),蛋白酶K(20 μg/mL),Taq DNA Polymerase。
H-2050R低温高速离心机:长沙湘仪离心机仪器有限公司;PCRSystem9700基因扩增仪:美国ABI公司;DYY-8B型稳压稳流电泳仪:北京市六一仪器厂;UV WHITE-2020D紫外凝胶成像分析仪:美国Biorad公司。
1.2方法
1.2.1肉类mtDNA的提取
1.2.1.1改良盐析法
取样品0.5g,充分研磨备用,称取前处理的肉类0.1g,加入500μL裂解液、30μLSDS(10%)和15μL蛋白酶K(20 μg/mL),56℃水浴震荡过夜(约16 h~18 h)。取出加饱和乙酸钠500μL,震荡10 min,11 000 r/min,离心10 min。取出后取上清加入异丙醇(等体积),-20℃放置至少1 h。取出后离心11 000 r/min,10 min,弃上清,沉淀中加入70%乙醇500 μL,轻轻振荡1 min。10 000 r/min,离心10 min。留沉淀,干燥乙醇(20 min)。加80 μL ddH2O溶解DNA,-20℃保存备用。
1.2.2.1柱层析法
取样品0.5 g,置乳钵中,加液氮适量,充分研磨备用,取0.1 g置1.5 mL离心管中,加入消化液275 μL,在55℃水浴保温1 h,加入裂解缓冲液250 μL,混匀,加到DNA纯化柱中,离心10 000 r/min 3 min;弃去过滤液,加人洗脱液800 μL,离心10 000 r/min 1 min;弃去过滤液,用上述洗脱液反复洗脱3次,每次离心10 000 r/min 1 min;弃去过滤液,再离心2 min,将DNA纯化柱转移人另一离心管中,加入无菌双蒸水100 μL,室温放置2 min后,离心10 000 r/min 2 min,取上清液,作为供试品溶液,置于-20℃保存备用。
1.2.2mtDNA的纯度、浓度的检测
取DNA提取液3 μL,用超微量紫外分光光度计测量260 nm和280 nm处的吸光度A260和A280,以A260/ A280的比值确定DNA的纯度并计算浓度。
1.2.3mtDNA琼脂糖凝胶电泳
将mtDNA样品与6×上样缓冲液(Loading Buffer)以5∶1的比例混匀后点在0.8%的琼脂糖凝胶上,电压为85 V~90 V,大约35 min后,经紫外检测并拍照。1.2.4肉类中鸭源成分PCR检测
1.2.4.1引物设计
在GenBank中下载绿头鸭线粒体细胞色素b (AY676201.1)基因序列,采用Primer 5.0进行设计,利用NCBI中的在线软件Primer-BLAST对设计的引物进行评估,最后确定特异性引物序列,由上海生工生物工程公司完成合成。
上引:CTGTCCGATGTATGGGAGGGCATCGTTCTGAGGAGCTACCG
下引:AACCCTAACCCGATTCTTCGCCAGTGGAC TAGGGTGATTCCT
扩增产物长度:223bp
1.2.4.2PCR扩增及产物检测
PCR反应体系:总体积为25 μL,10×PCR buffer(含Mg2+)3 μL,dNTP 2.4 μL,DNA模板2 μL,每条引物都加1 μL,TaqDNA聚合酶2 μL。循环参数:94℃预变性5 min,94℃变性30 s,62℃退火30 s,72℃延伸30 s,30个循环后72℃延伸10 min,4℃保存。
PCR产物检测:将PCR产物与6×Loading Buffer 以5∶1的比例混匀后点在2%的琼脂糖凝胶上,电压为85 V~90 V,大约85 min后,经紫外检测拍照。
2 结果
2.17种肉类mtDNA的提取
7种肉类样品mtDNA琼脂糖凝胶电泳图谱如图1所示。

图1 7种肉类样品mtDNA琼脂糖凝胶电泳图谱Fig.1 Agarose gel electrophoresis of mtDNA in seven meat samples
由图1可知,分别使用改良盐析法和柱层析法提取鸭肉、鸡肉、猪肉、牛肉、羊肉、马肉和驴肉mtDNA,结果显示两种方法均成功提取了7种肉类的mtDNA,由于柱层析法应用了DNA纯化柱,所以图像更清晰。
2.2mtDNA浓度及纯度
两种方法提取7种肉类DNA的比较见表1。
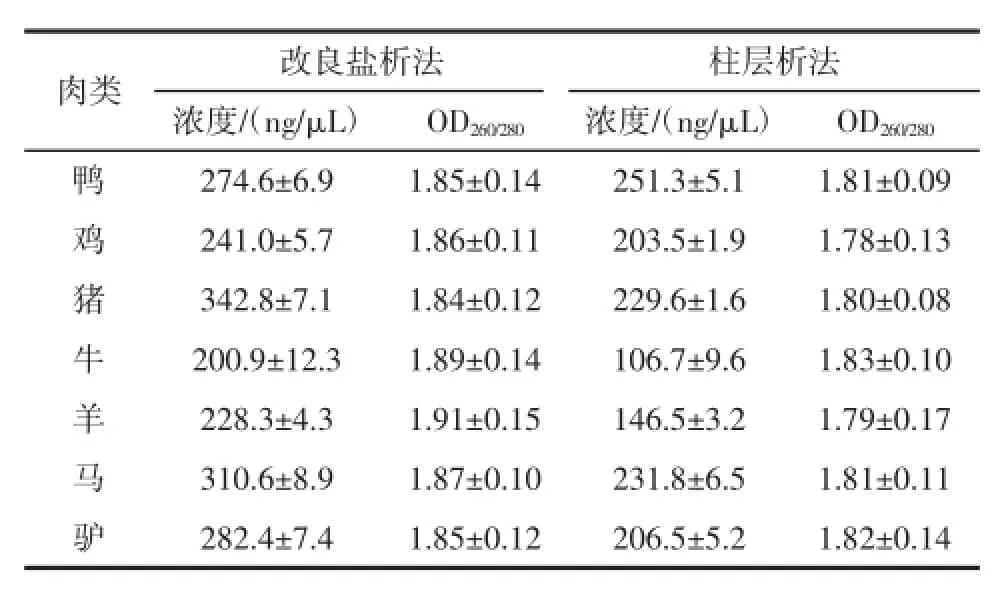
表1 两种方法提取7种肉类DNA的比较(x±s,n=6)Table 1 Comparison of two DNA extraction methods
由表2可知,改良盐析法和柱层析法提取的mtDNA处于同一数量级,纯度方面两者相差不大,均能保证后续试验PCR的要求。
2.3PCR鉴定结果
鸭引物对7种肉类PCR鉴定结果如图2所示。

图2 鸭引物对7种肉类PCR鉴定结果图Fig.2 Agarose gel electrophoresis of PCR in seven meat samples
通过反复梯度PCR试验,确定最佳退火温度为62℃。使用7种目标肉类mtDNA为模板,对设计的鸭肉引物进行特异性验证。由图2可见,设计的一对鸭肉引物仅在鸭模板上,预扩增片段223 bp出现明显的PCR扩增,其余6种生肉则无PCR反应发生,证明成功建立了一种肉中鸭源性成分鉴定的PCR方法。
3 讨论
鸭肉由于其价格低廉,成为市场上最常用掺假肉类之一。本研究采用两种不同方法提取了7种生肉的mtDNA。样品前处理均采用液氮进行研磨,避免了研磨产热而导致的DNA链断裂,保证了DNA的完整性。改良盐析法所用试剂均为分子生物学实验室常用试剂,除去水浴时间,只需2 h就可完成mtDNA的提取过程;柱层析法所用的试剂也均为常用试剂,提取过程在1.5 h可完成,在提取过程中需用到DNA纯化柱,略增加了试验成本。在对提取的mtDNA的浓度及纯度测定的结果显示,两种方法提取的DNA均能达到PCR的要求,可作为PCR反应模板,为后续试验的顺利进行奠定了基础。目前,多种商品化的DNA提取试剂盒广泛用于科研和检验工作中,但在大规模样品检测中,试剂盒存在提取时间长、成本高等不足。而本研究所采用的改良盐析法和柱层析法提取时间短、成本低廉、DNA结构完整,均可应用于大样本的DNA提取。
国内外对肉类掺假、掺杂的研究对象主要集中在市场上常见的羊肉、牛肉、猪肉和鸡肉。如侯东军[3]以猪细胞色素b基因组为模板,设计了一对可在牛羊肉中特异并灵敏地检测出所掺杂猪肉成分的引物,特异性扩增出130 bp的目的片段,建立了一种鉴定牛羊肉中掺杂猪肉的检测方法。孙艳华[4-5]通过进行基因序列的比对及查阅国内外的相关文献,确定了市场上常见肉类猪、牛、羊、鸡的特异性引物,同时对PCR法的灵敏度进行了研究,建立了判别肉制品中肉类来源的PCR法。巩红霞[6]提取生山羊肉和生绵羊肉的基因组DNA后,在同一反应体系内对生山羊肉和生绵羊肉的基因组DNA进行扩增,产物分别为293 bp和292 bp,应用多重PCR方法鉴别生羊肉的真假。高琳[7]应用PCR-RFLP法鉴别肉制品中的猪和牛源性成分。以动物mtDNA中cyt b区段的保守序列为目的基因设计通用引物,所有样品扩增均产生359 bp的片段,采用Alu I限制性酶切可区分猪肉和牛肉。而目前市场常见鸭肉掺杂、掺假的现象。
本研究选取绿头鸭mtDNA cyt b基因序列,在此目的基因上设计长引物进行PCR扩增。在退火温度的确定上,经过大量反复试验摸索,将退火温度定为62℃,在该温度下,223 bp的目的基因条带最清晰。仔细观察PCR鉴定结果图会发现,在鸭223 bp目的基因条带上有3条非特异性扩增,考虑原因为设计的长引物不可避免会与目的模板发生非特异性扩增。但这种扩增也仅出现在鸭模板上,其他6种肉类均无PCR反应,且非特异性扩增不影响目的基因的位置和清晰度,故可以忽略不计。该引物仅针对鸭模板发生了PCR扩增,而其余6种生肉模板均无PCR反应发生,显示了引物非常好的特异性。可满足一般实验室肉类品种鉴定,并可为质检部门推广应用。
本研究是国内首次设计长引物,通过比较不同肉类mtDNA序列差异进行鸭源性成分鉴别的研究。相比于目前常见的多重PCR、PCR-RFLP方法,本方法反应体系更简单,且检测结果可靠,所有试剂、仪器在分子生物学实验室均常见,成本低廉,检测时间短,结果准确。在后续工作中,可针对加工肉制品如香肠、火腿、速冻水饺中的肉类组分进行分析;也可应用荧光定量PCR技术进一步开发不同肉类组分的定量检测。
下一步需要验证PCR方法的敏感性,以期将该方法应用于纯肉、肉卷、肉丸等肉类的检测工作。
参考文献:
[1]Arslan A,Ilhak O I,Calicioglu M.Effect of method of cooking on identification of heat processed beef using polymerase chain reaction (PCR)technique[J].Meat Science,2006,72(2):326-330
[2]李文静.分子学方法鉴定肉制品种属来源的研究进展[J].国外医学卫生学分册,2009,36(3):151-158
[3]侯东军,杨红菊,姜艳彬,等.PCR鉴定牛羊肉中掺杂猪肉的方法建立[J].食品工业科技,2009,30(3):328-330
[4]孙艳华,张智禹,牛晋阳,等.PCR法检测肉制品中肉类来源的灵敏度研究[J].食品工业,2010(3):93-94
[5]孙艳华,张智禹,牛晋阳,等.PCR法快速检测熟肉制品中肉类来源[J].食品研究与开发,2010,31(5):139-142
[6]巩红霞,任永宏,巩强.用多重PCR方法鉴别生羊肉的真假[J].中国畜牧兽医,2006,33(8):38
[7]高琳,徐幸莲,周光宏.应用PCR-RFLP法鉴别肉制品中的猪和牛源性成分[J].南京农业大学学报,2008,31(2):135-138
DOI:10.3969/j.issn.1005-6521.2015.20.029
收稿日期:2015-03-12
基金项目:吉林省科技发展计划项目(20140307008YY)
作者简介:曲莉(1978—),女(汉),讲师,硕士,研究方向:食品分子鉴定。
Extraction of Mitochondrial DNA in Seven Kinds Meat and Detection of Duck Meat Composition
QU Li1,LI Xiao-han2,WANG Xue-song2,GAO Li-jun2,AI Jin-xia2,LI Ming-cheng2
(1.College of Public Health,Beihua University,Jilin 132013,Jilin,China;2.College of Laboratory Medicine,Beihua University,Jilin 132013,Jilin,China)
Abstract:Two methods were used to extract the mtDNA in meat,the best method was determined through comparing the concentration and purity of mtDNA.The specific primers of duck cyt b was designed to identify the most common adulterated meat on the market,duck compositions were identified in 7 kinds of raw meat by PCR technology.The results show that the two methods of extracting meat mtDNA can achieve the requirement of the PCR in the concentration and purity of DNA.The cost of column chromatography was higher than the improved salting out method.Duck source composition can be identified from 7 kinds of raw meat by duck primer,the specificity of the duck primers was proved through the repeating experiment.This test provides the experimental basis for the application for the meat products quality monitoring.
Key words:improved salt fractionation;column chromatograph;mitochondrial DNA;PCR;duck

