表面增强拉曼光谱技术在微生物鉴定中的应用进展
贾潇潇,李晶,秦天,邓爱华,刘文军
表面增强拉曼光谱技术在微生物鉴定中的应用进展
贾潇潇1,2,李晶1,秦天3,邓爱华4,刘文军1
1 中国科学院微生物研究所病原微生物与免疫学重点实验室,北京 100101 2 中国科学院大学,北京 100049 3 中国疾病预防控制中心传染病预防控制所传染病预防控制国家重点实验室,北京 102206 4 中国科学院微生物研究所微生物生理与代谢工程重点实验室,北京 100101

贾潇潇, 李晶, 秦天, 等. 表面增强拉曼光谱技术在微生物鉴定中的应用进展. 生物工程学报, 2015, 31(5): 611–620.Jia XX, Li J, Qin T, et al. Current views on surface enhanced Raman spectroscopy in microbiology. Chin J Biotech, 2015, 31(5): 611–620.
拉曼光谱自20世纪20年代被发现以来,经过近90年的发展,产生了许多分支。其中表面增强拉曼光谱是利用被测物质与粗糙金属表面的相互作用来提高拉曼光谱的信噪比,从而得到敏感度和精确度更高的图谱,可以将样品在不经过预处理的情况下对其进行快速检测。本文综述了表面增强拉曼光谱技术的原理、分类及鉴定特点,总结了该技术在食品、化学、医药、工业、病原等微生物学科的临床应用,进一步阐述了研究该技术的必要性和应用前景,旨在为从事该领域的科研人员提供参考依据。
表面增强拉曼光谱,微生物,应用
拉曼散射是光散射现象的一种,单色光束的光子与分子相互作用时可发生弹性碰撞和非弹性碰撞,拉曼散射是由光子的非弹性碰撞产生的[1]。发生弹性碰撞的散射过程又称为瑞利散射,碰撞过程中分子和光子之间没有发生能量的交换,碰撞后分子只改变了运动方向而不改变运动频率。与弹性碰撞不同,这种非弹性碰撞过程中光子与分子之间发生能量交换,即光子将一部分能量传递给了分子,或分子的振动和转动能量传递给光子,因此光子在改变运动方向的同时也改变了运动的频率。自1928年被印度科学家拉曼(Raman C.V.) 在实验中首次发现[2],随后逐渐应用到物质结构的测定中(表1)。
拉曼光谱分为表面增强拉曼效应[15]、共振拉曼光谱、表面增强共振拉曼光谱、自发性拉曼光谱、光学钳拉曼光谱、空间补偿拉曼光谱[16]、同调anti-Stokes拉曼光谱、拉曼光学活性[17]、受激拉曼增益光谱、逆拉曼光谱、针尖增强拉曼光谱等。
随着科学技术的发展,一种基于纳米结构的表面增强拉曼光谱(Surface enhanced Raman spectroscopy,SERS) 被发明,这种技术通过使用金属颗粒与被测分子间的相互作用来提高图谱的信噪比,从而使得实验结果更加显著。SERS技术作为一种新兴的光学分析手段,已经应用于环境分析、材料分析和化学品检测等领域[18],在微生物研究领域初步探索了在食品微生物鉴定中的应用,对病原微生物的相关研究甚少。

表1 拉曼光谱发展关键点
1 表面增强拉曼光谱
1.1 表面增强拉曼光谱的定义
当一些分子被吸附到某些粗糙的金属(金、银等) 表面,借助于两者之间的相互作用,可以很大程度地增强拉曼信号,从而得到高信噪比的图谱,即产生了表面增强拉曼散射效应,是一种特殊的表面光学现象。
1.2 表面增强拉曼光谱的原理及特点
SERS的基本原理是利用不同的金属纳米颗粒或核酸分子杂交等技术[19]增强拉曼信号,从而得到更好的检测图谱[20]。由于拉曼光谱强度太弱,且没有找到较合适的激发光源,因此没有得到较大范围的应用。直至20世纪70年代激光作为高强度的激发光源被应用到拉曼光谱的检测中,拉曼光谱技术才逐渐被使用于各专业的科学研究中。
1.3 表面增强拉曼光谱技术
表面增强拉曼光谱技术是基于表面增强拉曼光谱的原理结合显微共焦激光拉曼光谱仪等先进的仪器设备将待测样品进行快速检测并进行图像化处理的手段。该技术的应用可以为科研人员提供更多参考依据,在实验方案的选择和设计上具有启发意义。
2 SERS技术在食品、化学、医药、工业等学科的应用
由于具有检测快速方便、所需样品少且不损坏样品以及灵敏度高等特点,近些年来SERS技术在食品、化学、医学、工业等领域都得到了广泛的应用。
2.1 在食品学科的应用
在我们日常摄入的食品中,可能存在着多种农药、杀虫剂残留物,利用SERS技术可以实现对这些残留物的快速检测。Müller等[21]使用便携式拉曼光谱仪对香蕉和柑橘类中可能存在的噻苯咪唑(驱虫剂) 进行了SERS的检测,结果显示市场中噻苯咪唑(驱虫剂) 在香蕉中的使用量在安全范围以内,而在柑橘类中的含量超标严重。此外,Wijaya等[22]使用未经处理的苹果表皮和苹果汁作为研究对象,针对一种新型碱类杀虫剂啶虫脒在食品中的残留量进行了SERS的快速检测。样品都未经过预处理,实验发现在苹果汁中至少有3 μg/mL的啶虫脒,而在苹果皮中发现啶虫脒的浓度为2.5 μg/kg,远低于最高限定浓度1 000 μg/kg。
不法分子在食品的生产加工过程中可能掺入多种违禁成分,快速地鉴别食品中是否含有禁止使用的添加成分对食品安全的保障具有重要意义,SERS技术的使用满足了这一检测的需求。例如Roy等[23]将金纳米颗粒制成20–30 nm作为增强剂,对牛奶中的三聚氰胺含量进行了检测。除使用金纳米颗粒外,研究发现在石墨与银纳米颗粒共同作用下可以进一步优化SERS的效果[24]。通过这一方法研究人员对几种在食品中被禁止使用的色素进行了SERS的检测,证明这种技术可以将多种混合的色素成分通过各自的特征峰进行快速区别,这为食品的安全检测工作提供了有力的技术支撑。
2.2 在化学学科的应用
人们较早地将SERS应用于化学领域,随着纳米制备和表征技术的发展,研究发现若干金属离子可显著提高拉曼光谱技术的实验效果。Dasary等[25]利用SERS技术对存在于水和盐中的碘离子进行了高选择性和高敏感性的测定,结果显示金纳米颗粒的表面吸引了众多带电的Rh6G分子并且以聚合体的形式显著诱导了热点数量的增加,另外利用过氧化氢(H2O2) 将I–氧化为I2这一方法被成功用来进行针对在高浓度下会产生严重干扰的溴离子(Br–) 的筛选。除金纳米颗粒以外,银溶胶也可以作为表面增强剂应用于实验中,Temiz等[26]利用4种在大分子边缘被1,8-萘二甲酰亚胺进行了化学修饰的新合成的聚(丙烯胺) 树枝状分子作为配体进行对重金属离子的SERS检测。在这些大分子和银溶胶的共同作用下可以检测到低浓度重金属离子的拉曼光谱,得到的数据与主成分分析结果相符。
2.3 在医药、工业中的应用
SERS技术在医药、工业领域中也发挥重要的作用,研究人员可通过对药品快速检测,来鉴定其中是否含有违禁成分,同时也可以对药品进行筛选来保证市场中药物的安全。Zhang等[27]利用银溶胶为基底的SERS技术对中国传统专利药品中的违禁成分进行了分析,发现了盐酸罗格列酮、盐酸苯乙双胍、盐酸二甲双胍、盐酸吡格列酮和盐酸西布曲明等非法药物成分,这些药物成分可以使患者的病症短时间内得到好转,但是会带来不可预测的副作用。此外SERS技术也被用于疾病如尿道疾病、癌症诊断和体外癌细胞的检测,MUC4作为早期胰腺癌的一个血清标记[28],可以利用表面拉曼增强光谱进行定量检测,而对多种生物标记物的检测使得人们对肺癌的诊断更加准确[29]。另外,通过建立DNA-金纳米颗粒探测技术,人们在3种不同的乳腺癌细胞系中都发现了CD44+/CD24-细胞,表明SERS技术可以通过检测细胞表面标记蛋白来鉴定乳腺癌干细胞中CD44+/CD24-的含量[30]。在工业学科领域,芽胞杆菌由于它强大的生产胞外酶的能力而备受关注,因而对其进行快速鉴别就显得尤为重要。Deng等[31]利用SERS将从中国西藏分离得到的14种芽胞杆菌进行了检测,多元分析清晰地将这些菌株分为了3类(图1),这与它们的16S rRNA的系统发育学分析结果完全一致。
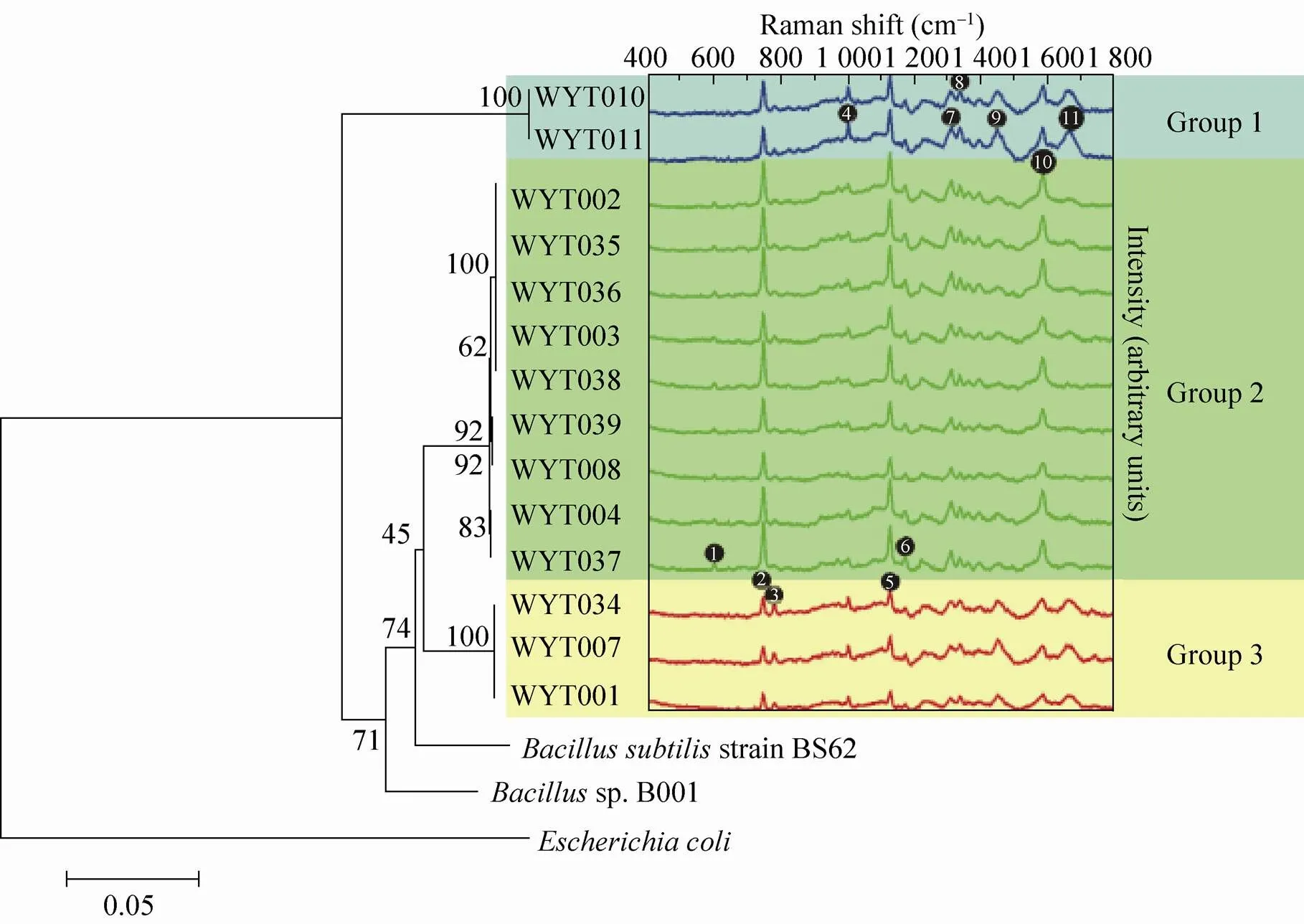
图1 工业微生物中14株芽胞杆菌SERS分离鉴定[31]
3 SERS技术在病原微生物学科中的研究
3.1 在病原细菌学中的研究
3.1.1 利用SERS对混合菌种进行鉴定
SERS技术在病原微生物中的一个重要应用是在不依赖培养基的情况下对从环境中或患者体内直接分离的病原菌进行快速检测和鉴定,从而提高效率、节省成本。该方法不仅可以进行单一菌种的鉴定,也可以对混合菌种进行准确地筛选。Xu等[32]发现由于细菌细胞膜表面有大量的生化成分,它们可以作为菌种快速识别和鉴定的标志。他们利用SERS对从美国华盛顿临床病人和环境中分离获得的4种基因型的7株副溶血弧菌进行了鉴定,结果显示7株细菌都有可区别于其他菌株的特征峰。他们还将编号为551和3652的两株菌按照2∶1、1∶1、1∶2的体积比分别混合进行SERS的检测,发现两种细菌从各自的特征峰图中被明显区分出来,其中551号副溶血弧菌的特征峰出现在1 002 cm–1、 1 177 cm–1、1 532 cm–1处,而3652号副溶血弧菌的特征峰则出现在525 cm–1、738 cm–1、1 319 cm–1、1 639 cm–1处,表明该方法在单个菌种样品和多菌种混合物样品中都能得到良好的鉴定结果。吕璞等[33]将大肠杆菌和志贺氏菌与纳米银颗粒混合后用SERS进行了检测,发现这两种细菌产生了完全不同的特征图谱,大肠杆菌的拉曼振动峰出现在658 cm–1、728 cm–1、960 cm–1等处,而志贺氏菌的振动峰出现在670 cm–1、820 cm–1、1 330 cm–1等处。实验分别进行了3次重复,检测结果均具有良好的重现性。研究人员发现在使用化学计量法的基础上,SERS可以用于区分细菌的种类和血清型,他们用银纳米颗粒作为基底对绿豆芽中的古沙门氏菌、斯坦利沙门氏菌、表皮葡萄球菌等6种食源性致病菌进行了SERS的鉴定和区分[34]。
Meisel等[35]对19种主要的食源性致病菌进行了SERS的检测,得到的数据被分等级鉴定,第一等级为将测定菌分为革兰氏阴性菌和革兰氏阳性菌,再通过另外两个重要的节点区分病原细菌的种属,实验结果表明每级的鉴定结果准确度在90.6%–99.5%的范围内。
3.1.2 利用SERS对常见病原菌的快速检测
金黄色葡萄球菌是最常见的病原菌之一,Lu等[36]利用微流体芯片与SERS技术结合对耐甲氧西林金黄色葡萄球菌进行了快速鉴定,黄玉坤等[37]也利用金纳米颗粒与样品混合对食品中的金黄色葡萄球菌、表皮葡萄球菌、白色葡萄球菌等进行了SERS的快速检测,研究表明整个检测过程耗时非常短,检测过程只需要十几秒的时间,并且与传统的聚合酶链式反应、菌落分离、血清学鉴别实验等方法得到同样准确的结果,可以作为食品卫生监管中的快速诊断方法。
尿路感染是一种常见的病症,目前对于感染病菌检测的金标准是传统的培养法[38],但这种方法耗时较长。Kloß等[38]针对尿道感染的患者样本进行了SERS与化学计量学结合的检测,实验结果表明SERS技术可在2 h内不需要培养基的情况下对患者体内的尿液样本进行准确检测,并且可以确定感染的主要菌群,精确度可以达到92%以上。
大肠杆菌、葡萄球菌、沙门氏菌等常见的病原菌的快速鉴定和区分也都相继应用SERS技术来实现。将菌体与银纳米颗粒共同作用后的SERS可以达到单细胞检测的水平。Fan等[39]利用银纳米颗粒对常见的食源性致病菌如大肠杆菌O157:H7、表皮葡萄球菌、单核细胞增多性李斯特菌和肠球菌等进行了SERS的鉴定,结果发现在500–1 800 cm–1区间不同菌种的峰图差别最明显。Wang等[40]利用反向微乳液法 (溴化十六烷基三甲铵为表面活性剂、原硅四乙酯为二氧化硅先导) 制成直径100 nm内的二氧化硅包裹的磁性探针,为了验证它的敏感度,研究人员将金黄色葡萄球菌混于PBS缓冲液中,实验发现探针能检测到的最低浓度为102CFU/mL,证明这种基于SERS的探针具有高度的敏感性。Sundaram等[41]利用银纳米颗粒对鼠伤寒、大肠杆菌、金黄色葡萄球菌以及李斯特菌进行了SERS的检测,发现革兰氏阳性和阴性菌菌体细胞壁和细胞膜结构没有明显区别,而主要的区别在于核苷酸和氨基酸,各自的特征峰主要集中在1 200–1 700 cm–1和400–700 cm–1之间。
目前利用SERS针对病原菌的快速检测主要集中在肠道病原菌,但是针对呼吸道病原菌的快速区别鉴定研究还较少,并且也缺少一个完善的可供参考的数据系统。
3.2 在病原微生物中病毒学及其他学科中的研究
在SERS技术的优化方面,除与金属离子共同作用之外,利用SERS技术也可以实现病毒的检测。Cao等[19]采用核酸分子杂交技术同时检测了A/B型肝炎病毒、艾滋病病毒、埃博拉病毒、天花病毒和炭疽杆菌抗原等6种病原微生物。结构简单的单个球形金纳米颗粒可被用于定量的抗原检测,而二聚化的金纳米颗粒可以降低检测浓度的最低限度。Lee等[42]利用双功能病毒SERS探针在一端作为抗体,与金纳米颗粒结合的方式共同用于SERS的检测。
Zhao等[43]利用银纳米颗粒作为基底,对流感病毒的3种不同毒株A/HKx31、A/WSN/33和A/PR/8/34进行了SERS的鉴定。在病毒样品体积小于5 μL的情况下拉曼光谱仪1 min内完成了收集,并且根据峰图之间的区别 (图2灰色区域) 可以清楚地鉴别出不同种毒株,结果显示SERS可以用来鉴别同一病原菌的不同种毒株。
除了常见的致病细菌及病毒外,一些支原体、衣原体等微生物也对农业等发展产生了严重危害。目前美国家禽中的支原体检测主要依靠技术工人,并且不能保证检验结果的准确性。Hennigan等[44]利用NA-SERS对家禽中的莱式无胆甾原体、鸡败血性支原体、滑液支原体、泰乐菌素等进行了快速检测,结果表明此方法对检测条件要求较低并且比标准PCR和Real-time PCR检测效果更好。

图2 流感病毒不同毒株的SERS鉴定[43]
SERS在判断正常结肠组织与恶性肿瘤中也可以发挥重要作用,Lopes等[45]对11个人体结肠样本进行了测定,获得55张图谱,观察到了蛋白质、脂质、氨基酸的峰图,其中根据条带强度差异所得到的差别较大的条带可能是关键的区别点。随后对条带强度和强度比率进行的线性分析表明此方法的精确度达到了81%。目前针对结肠癌主要倾向于利用一些小分子进行靶向治疗。对靶向分子及其代谢物的探测一般都需要携带荧光标签,而这些标签中可能带有毒素,对患者造成伤害。目前有研究人员利用SERS技术对细胞内药物的空间分布进行了研究,结果发现药物聚集在细胞膜表皮生长因子受体上并且诱导受体内在化,这项研究在细胞内的原子水平上阐释了药物分子的靶向作用机制[46]。
4 小结
4.1 研发微生物检测与鉴定用试剂盒
SERS技术由于光谱的特有性质,不同微生物的SERS存在着一定的差异,如同进行人的指纹鉴定一样,利用不同微生物的“光谱指纹”差异即可对不同微生物进行区分。这一方法的第一个特点是不需要对样本进行标记,检测过程快速,通常一个拉曼光谱在30 s内即可完成;第二个特点是其检测成本较低,纳米基质价格较低且可以反复使用,除拉曼光谱仪外基本无其他消耗品的需求,所以整套设备价格相对较低,有市场推广性;第三个特点是拉曼光谱仪可以实现小型化、便携化,可实现现场、野外的检测。目前国内外没有将该技术应用于临床鉴定的使用,尤其是针对病原微生物的鉴定与检测中,对其及时、准确地预报预警在疾病预防控制中有着较为重要的作用。将SERS技术进行临床产品的检验,进一步摸索灵敏度、重现性、特异性、成本分析等条件和指标,将其进行微生物检测与鉴定用试剂盒或试纸条的研发和推广,以上所述为我们下一步的研究重点。
4.2 建立SERS技术网络数据库平台
目前的研究现状显示,SERS技术仅对某些微生物进行了检测和鉴定,没有广泛地将微生物进行SERS技术图像收集和汇总,建立可搜索、可操作的数据库和共享的网络平台。建立多种微生物的“拉曼光谱指纹”数据库与网络共享平台将可跨越时间和地区的界限,实现多研究机构资源共享。分析拉曼光谱图,确定特征峰,通过对已知微生物进行拉曼光谱指纹的获取,并与利用传统方法鉴定的微生物信息进行匹配,从而建立特异的光谱指纹数据库,是我们下一步工作的切入点。
综上所述,SERS技术的应用可实现对微生物高精度与快速的鉴定,并逐步完成相关产品的研发与成果转化,同时可完成多种微生物“拉曼光谱指纹”库的建立,完成相关技术储备,发展成具有国际领先水平的快速鉴定网络共享平台,满足微生物领域中对临床样品快速、现场的需求。
REFERENCES
[1] Li R, Zhou JC, Lu CF. Application of Raman scattering technology in biology. Biotech Bull, 2009, 12: 62–64 (in Chinese).李睿, 周金池, 卢存福. 拉曼光谱在生物学领域的应用. 生物技术通报, 2009, 12: 62–64.
[2] Zhao Y, Jackson SD. Passively Q-switched fiber laser that uses saturable Raman gain. Opt Lett, 2006, 31(6): 751–753.
[3] Wu TY. Depolalization of Raman line of tetrachlorethylene. J Chin Chem Sco, 1936, 4: 402.
[4] Placzek G. Rayleigh streeung und Raman effekt. Hdb Der Radiologie, 1934, 6(2): 209.
[5] Maiman TH. Stimulated optical radiation in ruby. Nature, 1960, 187: 493–494.
[6] Paschotta R. Comment on ‘passively Q-switched fiber laser that uses saturable Raman gain’. Opt Lett, 2006, 31(18): 2737–2738.
[7] Fleischmann M, Hendra PJ, Mc Quillan AJ. Raman spectra of pyridine adsorbed at a silver electrode. Chem Phys Lett, 1974, 26(2): 163–165.
[8] Jeanmaire DL, van Duyne RP. Surface Raman spectroelectrochemistry: Part I. Heterocyclic, aromatic, and aliphatic amines adsorbed on the anodized silver electrode. J Electroanal Chem, 1977, 84(1): 1–20.
[9] Albrecht MG, Creighton JA. Anomalously intense Raman spectra of pyridine at a silver electrode. J Am Chem Soc, 1977, 99(15): 5215–5217.
[10] Efrima S, Bronk BV, Czege J. Surface enhanced Raman spectroscopy of bacteria coated by silver. SPIE, 1999, 3602: 164–171.
[11] Tissa RH, Theresa AS, Igor VE, et al. Non-Invasive Raman spectroscopic detection of carotenoids in human skin. J Invest Dermatol, 2000, 115(3): 441–448.
[12] Teh SK, Wei Z, Ho KY, et al. Diagnostic potential of near-infrared Raman spectroscopy in the stomach: differentiating dysplasia from normal tissue. Brit J Cancer, 2008, 98(2): 457–465.
[13] Ferrari AC, Basko DM. Raman spectroscopy as a versatile tool for studying the properties of graphene. Nat Nanotechnol, 2013, 8(4): 235–246.
[14] Brauchle E, Thude S, Brucker SY, et al. Cell death stages in single apoptotic and necrotic cells monitored by Raman microspectroscopy. Sci Rep-UK, 2014, 4: 4698.
[15] Stetciura IY, Markin AV, Bratashov DN, et al. Nanoencapsulated and microencapsulated SERS platforms for biomedical analysis. Curr Opin Pharmacol. 2014, 10(18):149–58
[16] Matousek P, Clark IP, Draper ERC, et al. Subsurface probing in diffusely scattering media using spatially offset Raman spectroscopy. Appl Spectrosc, 2005, 59(4): 393–400.
[17] Barron LD, Hecht L, McColl IH, Blanch EW. Raman optical activity comes of age. Molec Phys, 2004, 102(8): 731–744.
[18] Gong JL, Lv P, Zeng GM. Recent advancements in environmental analysis based on suface-enhanced Raman spectroscopy. Chemi Sensors, 2009, 29(3): 8–12 (in Chinese).龚继来, 吕璞, 曾光明. 表面增强拉曼光谱在环境分析中的研究进展. 化学传感器, 2009, 29(3): 8–12.
[19] Cao YC, Jin R, Mirkin CA. Nanoparticles with Raman spectroscopic fingerprints for DNA and RNA detection. Science, 2002, 297(5586): 1536–1540.
[20] Duan T, Peng TJ, Tang YJ. Advances of surface-enhanced Raman spectroscopy in nano materials science. Meterials View, 2008, 22(11): 93–97 (in Chinese).段涛, 彭同江, 唐永建. 表面增强拉曼光谱技术在纳米材料研究中的新进展. 材料导报, 2008, 22(11): 93–97.
[21] Müller C, David L, Chiş V, et al. Detection of thiabendazole applied on citrus fruits and bananas using surface enhanced Raman scattering. Food Chem, 2014, 145: 814–820.
[22] Wijaya W, Pang S, Labuza TP, et al. Rapid detection of acetamiprid in foods using surface-enhanced Raman spectroscopy (SERS). J Food Sci, 2014, 79(4): 743–747.
[23] Roy PK, Huang YF, Chattopadhyay S. Detection of melamine on fractals of unmodified gold nanoparticles by surface-enhanced Raman scattering. J Biomed Opt, 2014, 19(1): 11002.
[24] Xie Y, Li Y, Niu L, et al. A novel surface-enhanced Raman scattering sensor to detect prohibited colorants in food by graphene/silver nanocomposite. Talanta, 2012, 100: 32–37.
[25] Dasary SS, Ray PC, Singh AK, et al. A surface enhanced Raman scattering probe for highly selective and ultra sensitive detection of iodide in water and salt samples. Analyst, 2013, 138(4): 1195–1203.
[26] Temiz HT, Boyaci IH, Grabchev I. Surface enhanced Raman spectroscopy as a new spectral technique for quantitative detection of metal ions. Spectrochim Acta A Mol Biomol Spectrosc, 2013, 116: 339–347.
[27] Zhang Y, Huang XY, Liu WF, et al. Analysis of drugs illegally added into Chinese traditional patent medicine using surface-enhanced Raman scattering. Anal Sci, 2013, 29(10): 985–990.
[28] Wang GF, Lipert RJ, Jain M, et al. Detection of the potential pancreatic cancer marker MUC4 in serum using surface-enhanced Raman scattering. Anal Chem, 2011, 83(7): 2554–2561.
[29] Chon H, Lee S, Yoon SY, et al. Simultaneous immunoassay for the detection of two lung cancer markers using functionalized SERS nanoprobes. Chem Commun, 2011, 47(46): 12515–12517.
[30] Lee K, Drachev VP, Irudayaraj D, et al. DNA–gold nanoparticle reversible networks grown on cell surface marker sites: application in diagnostics. ACS Nano, 2011, 5(3): 2109–2117.
[31] Deng AH, Sun ZP, Zhang GQ, et al. Rapid discrimination of newly isolatedwith industrial applications using Raman spectroscopy. Laser Phys Lett, 2012, 9(9): 636.
[32] Xu J, Tuner JW, Idso M, et al. In situ strain-level detection and identification ofusing surface-enhanced Raman spectroscopy. Anal Chem, 2013, 85(5): 2630–2637.
[33] Lv P, Gong JL. Discrimination ofandusing surface-enhanced Raman spectroscopy. China Environ Sci, 2011, 31: 1523–1527 (in Chinese).吕璞, 龚继来. 表面增强拉曼光谱用于鉴别大肠杆菌和志贺氏菌的研究. 中国环境科学, 2011, 31: 1523–1527.
[34] Wu X, Xu C, Tripp RA, et al. Detection and differentiation of foodborne pathogenic bacteria in mung bean sprouts using field deployable label-free SERS devices. Analyst, 2013, 138(10): 3005–3012.
[35] Meisel S, Stockel S, Rosch P, et al. Identification of meat-associated pathogens via Raman microspectroscopy. Food Microbiol, 2014, 38: 36–43.
[36] Lu X, Samuelson DR, Xu Y, et al. Detecting and tracking nosocomial methicillin-resistantusing a microfluidic SERS biosensor. Anal Chem, 2013, 85(4): 2320–2327.
[37] Huang Y, Wang Y, Wang P, et al. Rapid identification ofby surface-enhanced Raman spectroscopy in food. Chin J Health Lab Technol, 2011, 21: 2824–2827 (in Chinese).黄玉坤, 王毅谦, 汪鹏, 等. 表面增强拉曼光谱快速鉴别食品中的金黄色葡萄球菌. 中国卫生检验杂志, 2011, 21: 2824–2827.
[38] Kloß S, Kapme B, Sachse S, et al. Culture independent Raman spectroscopic identification of urinary tract infection pathogens: a proof of principle study. Anal Chem, 2013, 85(20): 9610–9616.
[39] Fan C, Hu Z, Mustapha A, et al. Rapid detection of food and waterborne bacteria using surface-enhanced Raman spectroscopy coupled with silver nanosubstrates. Appl Microbiol Biotechnol, 2011, 92(5): 1053–1061.
[40] Wang Y, Ravindranath S, Irudayaraj J. Separation and detection of multiple pathogens in a food matrix by magnetic SERS nanoprobes. Anal Bioanal Chem, 2011, 399(3): 1271–1278.
[41] Sundaram J, Park B, Kwon Y, et al. Surface enhanced Raman scattering (SERS) with biopolymer encapsulated silver nanosubstrates for rapid detection of foodborne pathogens. Int J Food Microbiol, 2013, 167(1): 67–73.
[42] Lee HE, Lee HK, Chang H, et al. Virus templated gold nanocube chain for SERS nanoprobe. Small, 2014, 10(15): 3007–3011.
[43] Zhao Y, Shanmukh S, Liu Y, et al. Silver nanorod arrays can distinguish virus strains. Phys Rev Lett, 1997, 78: 1667–1670.
[44] Hennigan SL, Dkriskell JD, Ferguson-Noel N, et al. Detection and differentiation of avian mycoplasmas by surface-enhanced Raman spectroscopy based on a silver nanorod array. Appl Environ Microbiol, 2012, 78(6): 1930–1935.
[45] Lopes PC, Moreira JA, Almeida A, et al. Discriminating adenocarcinoma from normal colonic mucosa through deconvolution of Raman spectra. J Biomed Opt, 2011, 16(12): 127001–12700112.
[46] El-Mashtoly SF, Petersen D, Yosef HK, et al. Label-free imaging of drug distribution and metabolism in colon cancer cells by Raman microscopy. Analyst, 2014, 139(5): 1155–1161.
(本文责编陈宏宇)
Current views on surface enhanced Raman spectroscopy in microbiology
Xiaoxiao Jia1,2, Jing Li1, Tian Qin3, Aihua Deng4, and Wenjun Liu1
1 Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China 2 University of Chinese Academy of Sciences, Beijing 100049, China 3 State Key Laboratory for Infectious Disease Prevention and Control, National Institute for Communicable Disease Control and Prevention,Chinese Center for Disease Control and Prevention, Beijing 102206, China 4 Key Laboratory of Microbial Physiological and Metabolic Engineering, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
Raman spectroscopy has generated many branches during the development for more than 90 years. Surface enhanced Raman spectroscopy (SERS) improves SNR by using the interaction between tested materials and the surface of rough metal, as to quickly get higher sensitivity and precision spectroscopy without sample pretreatment. This article describes the characteristic and classification of SERS, and updates the theory and clinical application of SERS. It also summarizes the present status and progress of SERS in various disciplines and illustrates the necessity and urgency of its research, which provides rationale for the application for SERS in microbiology.
surface enhanced Raman spectroscopy, microbiology, application
August 19, 2014; Accepted: October 15, 2014
Jing Li. Tel/Fax: +86-10-64807503; E-mail: lj418@163.com
Supported by:National Key Technologies Research and Development Program of China (No. 2013ZX10004-610), National Natural Science Foundation of China (Nos. 31402216, 81101253), Key Research Program of the Chinese Academy of Sciences (No. KSZD-EW-Z-005-001).
“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项 (No. 2013ZX10004-610),国家自然科学基金(Nos. 31402216, 81101253),中国科学院重点部署项目 (No. KSZD-EW-Z-005-001) 资助。

