不同热处理时间对污泥厌氧发酵产氢的影响
昌盛,李建政,刘枫,王淑静
1.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京 100012
2.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150090
氢气具有热值高、燃烧无污染及不产生温室气体的特性,被认为是最具发展前景的清洁能源之一,但因缺乏经济高效的制氢技术而制约了氢能的推广应用[1-2]。与传统的物理化学方法相比,基于活性污泥混合菌群的厌氧发酵制氢技术优势明显,其能以有机废物为原料[2-3],且厌氧发酵系统操作简单,管理方便,工业化前景广阔。近年来,厌氧发酵制氢技术研究发展十分迅速。为提高发酵制氢反应系统的产氢效能,研究者在高效反应设备、控制条件的优化以及生物强化技术等方面进行了广泛研究[3]。加快发酵产氢系统的启动进程,提高活性污泥的产氢效能,获得具有较高产氢效能的微生物种质资源,显得尤为关键。
对种泥进行适宜的预处理,以淘汰接种污泥中不产芽孢的非产氢菌群以及产甲烷菌耗氢菌群,富集产氢混合菌种,成为近年研究的重点方向[4-6]。其中,应用种泥热处理方法最为多见[6-8],但厌氧发酵系统的产氢特性,还会受到种泥类别与性质、底物种类和反应pH 等控制条件的影响,报道采用的热处理温度为60 ~120 ℃,热处理时间为30 ~120 min[7-9]。在前期研究中,以城市污水处理厂剩余污泥为种泥,通过间歇发酵试验,考察了热处理温度对活性污泥发酵产氢特性的影响,发现热预处理温度为65 ℃时,系统获得的产氢性能最佳[10]。笔者在前期研究基础上,通过摇瓶发酵试验,比较种泥在65 ℃下经不同热处理时间处理后的产氢性能,探讨适宜的热处理条件,以期为发酵产氢菌群的富集提供技术依据。
1 材料与方法
1.1 种泥及预处理
种泥来自城市污水处理厂二沉池,取回实验室后,经淘洗过滤获得,其悬浮固体浓度(MLSS)和挥发性悬浮固体浓度(MLVSS)分别为27.3 和16.0 g/L。取混匀污泥50 mL 8 份,分别置于8 个100 mL烧杯中,将带有污泥的烧杯置于65 ℃的水浴锅中,分别加热0、15、30、45、60、75、90 和120 min;其中0 min 作为空白对照试验。
1.2 摇瓶发酵试验
采用130 mL 的血清瓶进行厌氧发酵。发酵试验步骤:用注射器取10 mL 污泥分别放入血清瓶中,于每支血清瓶中加入60 mL 培养液,用NaOH 或HCl 溶液将pH 调至7.0;充高纯氮气3 min 并用胶塞密封。将密封后的血清瓶置于35 ℃恒温摇床中,140 ~150 r/min 下恒温培养64 h。试验所用培养液的组分与文献[10]相同。各种预处理条件下的发酵试验用3 支血清瓶同时进行,相关数据取平均值进行分析。
1.3 分析方法
pH 和生物量参照国标方法测定[11],葡萄糖浓度采用DNS 法测定[12]。发酵系统的累计产氢量采用Owen 法计算得到[13]。培养64 h 后,从反应瓶中抽取1.5 mL 反应液,10 000 r/min 下离心1 min,取上清液测定葡萄糖和液相末端发酵产物浓度。试验中的气体组分和液相发酵产物采用气相色谱仪(型号分别为SP-6801T 和SP-6890,山东鲁南瑞虹化工仪器有限公司)测定[14]。
采用改进的Gompertz 模型对累计产氢曲线进行拟合,以求解发酵系统产氢的动力学参数。
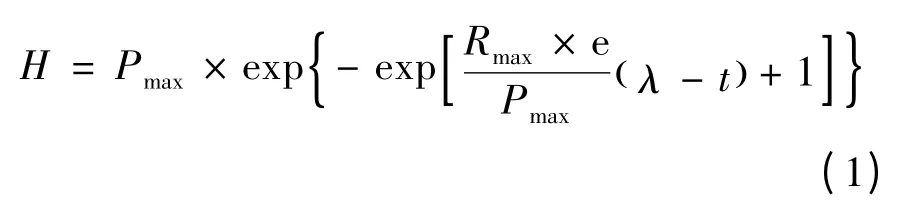
式中:H 为累计产氢量,mL;Pmax为最大产氢量,mL;Rmax为最大产氢速率,mL/h;λ 为延滞时间,h;t 为培养时间,h。
2 结果与讨论
2.1 累计产氢量
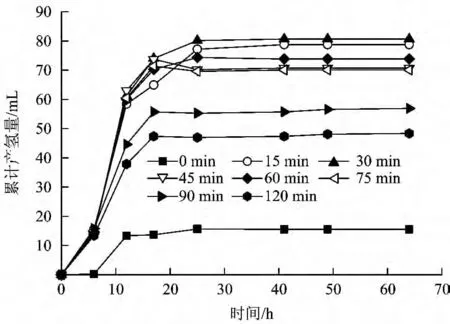
图1 不同热处理时间下各发酵体系的累计产氢量Fig.1 Cumulative hydrogen production for batch fermentative system with different heat time
图1 为不同热处理时间下各发酵体系的累计产氢量。由图1 可见,各发酵体系的累计产氢量变化均经历了延滞期、指数增长期、平台期3 个阶段。未经热处理的发酵体系累计产氢量最小,仅为15.5 mL。经15 和30 min 热处理的发酵体系累计产氢量最大,分别为79 和81 mL。经45 ~75 min 热处理的发酵体系累计产氢量相当,为70 ~74 mL。而经90和120 min 热处理的发酵体系累计产氢量相对较小,为48 和57 mL。这说明适宜的热处理时间能有效富集产氢菌群,而过长时间的热处理可能使得部分产氢菌群的活性受限。
对累计产氢曲线进行非线性拟合,求得的动力学参数如表1 所示。

表1 不同热处理时间下污泥发酵体系的产氢动力学参数Table 1 Kinetic parameters of fermentative hydrogen production for the pretreated activated sludge
由表1 可见,经过65 ℃热处理后的污泥,其发酵葡萄糖的最大产氢量和最大产氢速率均远大于未处理污泥,这与前期研究结果一致[10]。经15 和30 min 热处理的发酵体系的最大产氢速率最佳,约为10 mL/h;经45、60 和75 min 热处理的污泥发酵体系最大产氢速率均在9 mL/h 以上;而当热处理时间大于75 min 时,发酵体系中无论是最大产氢量还是最大产氢速率均有明显下降,这说明污泥产氢活性较低。分析认为这可能是由于过长的热处理时间抑制了产氢发酵细菌的活性所致,经热处理90 和120 min 的发酵系统的延滞期较15 ~75 min 的要长,也说明污泥活性受抑。此外,在不同热处理时间下,污泥产氢发酵的延滞期均较未进行预处理的系统要明显缩短。以上结果表明,污泥经过65 ℃适宜时间的热处理后,促使种泥中产氢菌孢子的萌发,产氢发酵细菌能较快进入指数生长期,而具备较高的产氢速率,但过长的热处理时间反而会因抑制混合菌群的活性而使产氢发酵反应受阻,限制了发酵系统的产氢效能。试验结果显示,以生活污水活性污泥为种泥,采用65 ℃热预处理方法富集产氢菌群时,适宜热处理时间为15 ~30 min。
2.3 液相末端发酵产物
图2 显示各发酵体系液相末端发酵产物的浓度。由图2 可见,培养到终点时,除空白对照组的葡萄糖转化率为77%外,其他发酵系统的葡萄糖转化率为88% ~91%。各污泥样品反应体系中剩余葡萄糖浓度分别为2 036(对照)、1 071(15 min)、923(30 min)、1 106(45 min)、966(60 min)、897(75 min)、1 086(90 min)和903 mg/L(120 min)。

图2 各发酵体系液相末端发酵产物浓度Fig.2 Liquid fermentative products at the end of the cultivation
由图2 可见,液相末端发酵产物主要以乙酸、丙酸、丁酸和乙醇为主,且不同热处理时间下所产生的代谢产物总量各不相同,各代谢产物浓度也存在一定差异。对于未经处理的种泥发酵体系,液相代谢产物以乙醇和乙酸为主,其中乙醇、乙酸、丁酸分别占发酵产物总量的24.2%、53.7%和16.6%,呈乙醇型发酵。而对于经过热处理的发酵体系来讲,各发酵体系中乙醇、乙酸和丁酸占总量的比例:15 min 时分别为19.1%、43.1%和35.6%;30 min 时分别为19.3%、45.9%和34.8%;45 min 时分别为20.0%、47.2%和32.9%;60 min 时分别为15.7%、48.5%和35.7%;75 min 时分别为22.7%、47.2%和30.1%;90 min 时分别为26.6%、47.7%和25.6%;120 min 时分别为27.0%、45.9%和28.4%。这说明经15 ~75 min热处理的污泥发酵系统,呈丁酸型发酵特征;而经90和120 min 热处理的污泥发酵系统,呈混合酸型发酵特征。表明不同热处理时间下各发酵系统内形成了具有不同产酸发酵代谢功能的顶级微生物群落,其产酸代谢特征各异。
由图2 可见,未经过65 ℃处理的污泥和经热处理15 min 的发酵体系中,经过64 h 发酵反应后,液相代谢产物中含有微量丙酸,而其他热处理时间下,丙酸未被检出。这说明热处理时间较短时,丙酸发酵细菌的活性可能难以被抑制,当处理时间大于15 min时,丙酸发酵细菌可能被杀灭。而在产酸发酵体系中,丙酸发酵菌群在厌氧发酵降解葡萄糖的代谢途径中不仅无氢气产生,反而还需消耗氢气[13],因此,未经处理的发酵体系,其累计产氢量最小(图1)。这一现象也说明,在65 ℃的热处理下,热处理时间对不同厌氧微生物发酵菌群的作用效果各异。对于不同热处理时间下厌氧微生物的群落结构组成,后续将采用分子生物学技术进行研究。
2.4 生物量和pH
图3 为不同热处理条件下的终止pH 和生物量。由图3 可见,反应64 h 后,因大量挥发酸的产生,pH 下降较多,但各反应体系的pH 差异甚微,介于3.40 ~3.55。但生物量差别明显,在间歇培养结束时,各体系的生物量分别为5.85(空白)、5.77(15 min)、5.35(30 min)、4.95(45 min)、5.31(60 min)、4.80(75 min)、4.51 (90 min)和4.57 g/L(120 min)。这一结果表明,过长时间的热处理显著抑制了种泥活性,其生物量增加幅度最小。
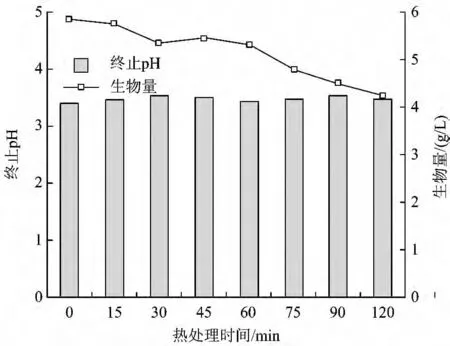
图3 不同热处理条件下的终止pH 和生物量Fig.3 pH and biomass profiles at the end of fermentation with different heat pretreatment time
2.5 综合分析
表2 为65 ℃不同热处理时间下各污泥发酵体系的产氢特性。
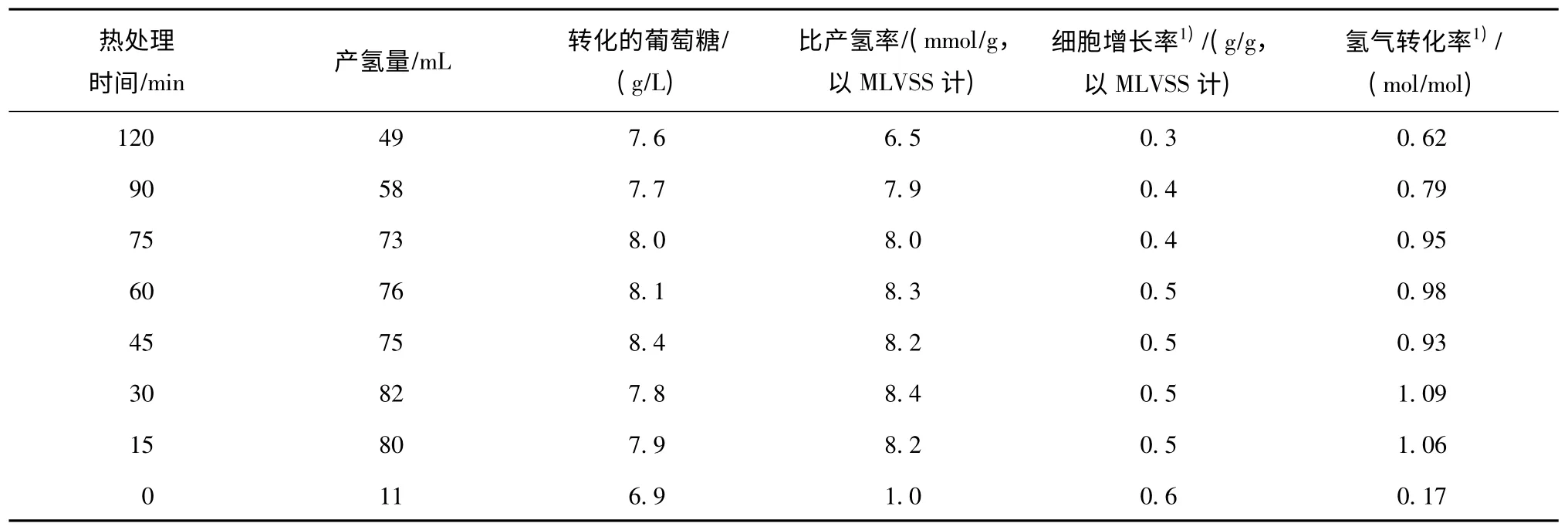
表2 65 ℃不同热处理时间下各污泥发酵体系的产氢特性分析Table 2 The characteristic of fermentative hydrogen production of the heat-pretreated sludge by 65 ℃
由表2 可见,污泥在65 ℃下经不同时间的预处理后,发酵系统的产氢特性和微生物生长情况存在显著差异。对于未经处理的污泥发酵系统而言,虽然其葡萄糖的降解情况与污泥经热处理过的体系相当,但其获得的氢气转化率最小(0.17 mol/mol,以葡萄糖计)、比细胞增长率却最大(0.6 g/g,以MLVSS 和葡萄糖计),这表明在未经处理的污泥发酵体系中,大量葡萄糖被非产氢菌种所利用,故其产生的氢气量最小(图2);而经热处理的污泥,种泥中的非产氢菌种活性受抑制或被杀灭,当污泥被接种后,混合菌群中的产氢菌种能较快进行繁殖,对底物加以利用而大量产氢,因而对污泥辅以热冲击的预处理方式,能有效富集产氢菌群,这与Mu Y. 等[15]的报道结果一致。有研究表明,生物量的增长与其发酵产氢量呈现正相关性[9],然而,试验中各发酵系统的生物增长量,要比Wang J. L.等[16]报道的高出1.5 倍,但氢气转化率却相对较低。分析认为,基质向细胞生物质的大量转化,是导致系统产氢量较低的直接原因[17],而接种污泥的来源和培养条件与Wang J. L.等的研究方法不同,可能是氢气产率较低的根本原因。为此,有必要在后续研究中,通过进一步优化培养基组分及培养条件以提高系统的产氢效能。
B. Baghchehsaraee 等[9]的研究表明,以活性污泥和厌氧污泥为种泥时,种泥的处理温度对发酵产氢特性具有显著影响,笔者的前期研究结果得出了相同的结论[10]。B. Baghchehsaraee 等的研究显示,经65、80 和95 ℃热处理后,种泥的微生物群落结构存在明显差异,发酵产物中的乙酸、丁酸组分比例不同,发酵系统的氢气转化率与丁酸/乙酸的比率存在一定相关性。同时,随着热处理温度的提高,种泥中的微生物多样性显著降低。笔者的研究结果显示,在65 ℃下,污泥经不同时间的热冲击后,种泥发酵体系的发酵产氢活性和液相末端发酵产物的分布情况都存在一定差异。对于污泥经15 ~75 min 热处理的发酵体系来讲,发酵产物以乙酸和丁酸为主,系统呈丁酸型发酵特征;而经90 和120 min 热处理的污泥发酵体系,则呈混合酸发酵特征。分析认为,这是由于在不同温度下的热处理及在一定温度下改变处理时间的热处理方式,均是利用活性污泥在受到不同程度的热冲击后,各种微生物菌群反应不一而形成不同的种群结构,所以,不同热处理时间下种泥中的微生物种群存在差异,进而影响活性污泥中的微生物种群结构组成,导致经不同时间热处理后,污泥表现出不同的发酵产氢性能。另一方面,笔者的研究结果显示,过长时间的热处理也会降低种泥的微生物活性。从表2 可知,过长时间的热处理,将会降低污泥活性,其葡萄糖降解率、挥发酸产量较低,系统产氢效能欠佳。与经15 ~75 min 热处理的发酵体系相比,热处理90 ~120 min 时的污泥细胞增长率较低,这说明种泥经90 和120 min 热处理后,种泥的多样性降低,其中活性较差的产氢菌代谢能力降低甚至失去活性,致使发酵体系的产氢量变小(图1)。因而,热处理时间为90 和120 min 时,污泥发酵体系的氢气转化率相对偏低,而污泥经15 ~75 min 的热处理后,其污泥比产氢速率和氢气转化率分别为8.2 ~8.4 mmol/g(以MLVSS 计)和0.95 ~1.09 mol/mol(以葡萄糖计),产氢效能差异不明显,但从节约预处理成本的角度考虑,选择热预处理时间为15 ~30 min 较为适宜。
3 结论
(1)城市污水处理厂的活性污泥经65 ℃热处理后,产酸发酵产氢混合菌群能得到有效富集,进而增强了污泥的厌氧发酵产氢活性,且污泥的热预处理时间对系统的发酵产氢效能有显著影响。
(2)在初始葡萄糖浓度为10 g/L,污泥接种量为1.6 g/L(以MLVSS 计),pH 为7.0 的条件下,经过不同时间热处理的污泥发酵系统呈现的产氢特性各异。经过64 h 发酵后,以热处理时间为15 和30 min 获得的产氢效果最佳,氢气转化率为1.06 ~1.09 mol/mol(以葡萄糖计);而当热处理时间超过90 min 时,种泥中的部分微生物将因失去活性,而削弱系统的产氢效能。
(3)不同热处理时间下种泥中的微生物种群存在差异,各发酵体系呈现出不同的产酸发酵类型。经热处理15 ~75 min 后的污泥发酵系统,液相末端发酵产物以丁酸、乙酸为主,呈现出丁酸型发酵特征;而经热处理90 和120 min 后的污泥发酵系统中,乙醇比例也占到25%以上,呈现出混合酸发酵特征。
[1]MOMIRLAN M,VEZIROGLU T N.The properties of hydrogen as fuel tomorrow in sustainable energy system for a cleaner planet[J]. International Journal of Hydrogen Energy,2005,30(7):795-802.
[2]DAS D. Advances in biohydrogen production processes:an approach towards commercialization[J]. International Journal of Hydrogen Energy,2009,34(17):7349-7357.
[3]HALLENBECK P C,GHOSH D. Advances in fermentative biohydrogen production:the way forward [J]. Trends Biotechnology,2009,27(5):287-297.
[4]郭婉茜,任南琪,王相晶,等.接种污泥预处理对生物制氢反应器启动的影响[J].化工学报,2008,59(5):1283-1287.
[5]SONG Z X,DAI Y,FAN Q L,et al. Effects of pretreatment method of natural bacteria source on microbial community and bio-hydrogen production by dark fermentation[J]. International Journal of Hydrogen Energy,2012,37(7):5631-5636.
[6]HAFEZ H,ELBESHBISHY E,DHAR B R,et al. Single and combined effect of various pretreatment methods for biohydrogen production from food waste[J].International Journal of Hydrogen Energy,2011,36(17):11379-11387.
[7]REN N Q,GUO W Q,WANG X J,et al. Effects of different pretreatment methods on fermentation types and dominant bacteria for hydrogen production[J]. International Journal of Hydrogen Energy,2008,33(16):4318-4324.
[8]PENTEADO E D,LAZARO C Z,SAKAMOTO I K,et al.Influence of seed sludge and pretreatment method on hydrogen production in packed-bed anaerobic reactors[J]. International Journal of Hydrogen Energy,2013,38(14):6137-6145.
[9]BAGHCHEHSARAEE B,NAKHLA G,KARAMANEV D,et al.The effect of heat pretreatment temperature on fermentative hydrogen production using mixed cultures[J]. International Journal of Hydrogen Energy,2008,33(15):4064-4073.
[10]昌盛,李建政,王淑静,等. 预处理温度对活性污泥发酵产氢特性的影响[J].太阳能学报,2011,32(3):395-401.
[11]国家环境保护局.水和废水监测分析方法[M].3 版.北京:中国环境科学出版社,1997.
[12]MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-427.
[13]OWEN W F,STUCKEY D C,HEALY J B,et al. Bioassay for monitoring biochemical methane potential and anaerobic toxicity[J].Water Research,1979,13:485-492.
[14]LI J Z,ZHENG G C,HE J G,et al. Hydrogen-producing capability of anaerobic activated sludge in three types of fermentations in a continuous stirred-tank reactor [J].Biotechnology Advance,2009,27(5):573-577.
[15]MU Y,YU H Q,WANG G. Evaluation of three methods for enriching H2-producing cultures from anaerobic sludge[J].China Enzyme and Microbial Technology,2007,40(4):947-953.
[16]WANG J L,WAN W. Comparison of different pretreatment methods for enriching hydrogen-producing bacteria from digested sludge[J]. International Journal of Hydrogen Energy,2008,33(12):2934-2941.
[17]LEE H S,RITTMANN B E. Evaluation of metabolism using stoichiometry in fermentative biohydrogen[J]. Biotechnology and Bioengineering,2009,102(3):749-758.▷

