血清降钙素原联合痰培养检测在呼吸道感染中的临床应用
吴芳芳
(嘉兴市王店人民医院,浙江314011)
血清降钙素原联合痰培养检测在呼吸道感染中的临床应用
吴芳芳
(嘉兴市王店人民医院,浙江314011)
目的探讨血清降钙素原(PCT)联合痰培养检查在呼吸道感染中的临床应用。方法选取2014年3月至2015年3月在该院就诊的呼吸道感染患者500例,收集患者入院首次痰培养结果和PCT检测结果进行统计学分析。结果病原菌组血清PCT水平明显高于无菌组和正常菌群组,差异均有统计学意义(U=8 213、201 264,P<0.01);革兰阳性菌组与革兰阴性菌组血清PCT水平比较,差异无统计学意义(U=6 021.6,P=0.624);细菌感染组与真菌感染组血清PCT水平比较,差异无统计学意义(U=23 446,P=0.261)。结论血清PCT联合痰培养检测可早期快速诊断呼吸道感染是否为细菌感染,对于临床合理使用抗生素具有重要意义,值得临床推广。
降钙素/血液; 痰; 细菌学技术; 呼吸道感染; 细菌感染; 真菌
根据WHO统计结果显示,每年由于呼吸道感染导致死亡的患者约有430万左右[1]。大多数情况下,呼吸道感染由病毒感染引起,但据相关统计表明,75%的呼吸道感染患者均接受了抗生素治疗[2]。之所以出现这种状况,是因为由细菌和病毒引起的呼吸道感染症状较难鉴别,而且在病毒感染后常伴细菌感染。痰培养是临床上诊断呼吸道感染的主要手段之一,但痰标本自身具有很大的局限性,标本在留取、运输和接种等过程中很容易受到外界杂菌的污染,标本培养时间较长,培养阴性并不能完全排除细菌感染。因此,寻找一种快速简便的呼吸道感染诊断方法已经成为临床上亟须解决的关键问题之一。血清降钙素原(PCT)是血清降钙素(CT)的前肽物质,由甲状腺C细胞分泌,是一种由116个氨基酸组成的糖蛋白,正常情况下人体内PCT的含量极低(<0.05 μg/L),但在脓毒血症状态下或细菌感染时的炎症性刺激下,机体会产生大量PCT并释放入血液,导致PCT在血清中的水平迅速升高[3]。因此,PCT对于细菌性感染和非细菌性感染具有十分重要的早期诊断价值。目前,临床上对于PCT在感染性疾病的诊断和鉴别诊断研究已有较多报道,但PCT与痰培养联合检测的相关报道较少。本研究探讨PCT与痰培养联合检测在呼吸道感染中的临床应用,现报道如下。
1 资料与方法
1.1 一般资料 选取2014年3月至2015年3月在本院呼吸内科就诊的呼吸道感染患者500例作为研究对象,其中男350例,女150例;年龄9~90岁,平均(51.6± 13.6)岁。呼吸道感染的诊断依据鼻咽部症状和患者体征,并结合实验室检查确诊,排除气管炎、支气管炎、流行性感冒、过敏性鼻炎等呼吸道疾病。
1.2 方法
1.2.1 仪器与试剂 PCT检测采用罗氏全自动电化学发光免疫分析仪,所用试剂为原装配套试剂。痰培养鉴定采用法国生物梅里埃公司生产的VitekⅡ微生物全自动鉴定仪,血琼脂培养基、麦康凯培养基、巧克力培养基和沙保罗培养基。
1.2.2 痰标本收集 于患者入院后次日清晨采用自然咳痰法留取痰标本,并置于一次性无菌痰标本收集盒中立即送检,标本送至检验科后在生物安全柜中依次接种于血琼脂培养基、麦康凯培养基、巧克力培养基和沙保罗培养基上。
1.2.3 PCT检测范围 PCT检测范围0.02~100.00 ng/mL,若PCT≥0.5 ng/mL则判断为阳性。
1.3 统计学处理 应用SPSS19.0统计软件进行数据分析,PCT测定值以中位数(四分位间距)[M(P25~P75)]表示,单个菌种由于例数较少以M(min~max)表示,组间比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结 果
2.1 500份痰标本培养结果及其PCT水平比较 500份痰标本培养3 d无细菌生长11例(2.2%),口腔正常菌群249例(49.8%),病原菌生长240例(48.0%,其中细菌185例,真菌生长55例)。无菌组血清PCT水平中位数小于0.5 ng/mL,其中PCT阳性3例(27.3%);正常菌群组血清PCT水平M<0.5 ng/mL,其中PCT阳性60例(24.1%);病原菌组血清PCT水平显著高于无菌组和正常菌群组,差异均有统计学意义(U=8 213、201 264,P<0.01)。细菌感染组与真菌感染组血清PCT水平比较,差异无统计学意义(U=23 446,P=0.261)。见表1。
2.2 细菌感染组PCT水平比较 本研究细菌生长185例中,革兰阳性菌为21例(11.4%),血清PCT水平为0.77(0.15~5.85)ng/mL,其中 PCT阳性11例(52.4%);革兰阴性菌为126例(68.1%),血清PCT水平为0.80(0.18~3.25)ng/mL,其中PCT阳性77例(61.1%);混合细菌感染为38例(20.5%),血清 PCT水平为0.61(0.25~2.85)ng/mL,其中PCT阳性15例(39.5%),革兰阳性菌组与革兰阴性菌组血清PCT水平比较,差异无统计学意义(U=6 021.6,P=0.624)。见表2。

表1 500份痰标本培养结果及其PCT水平比较
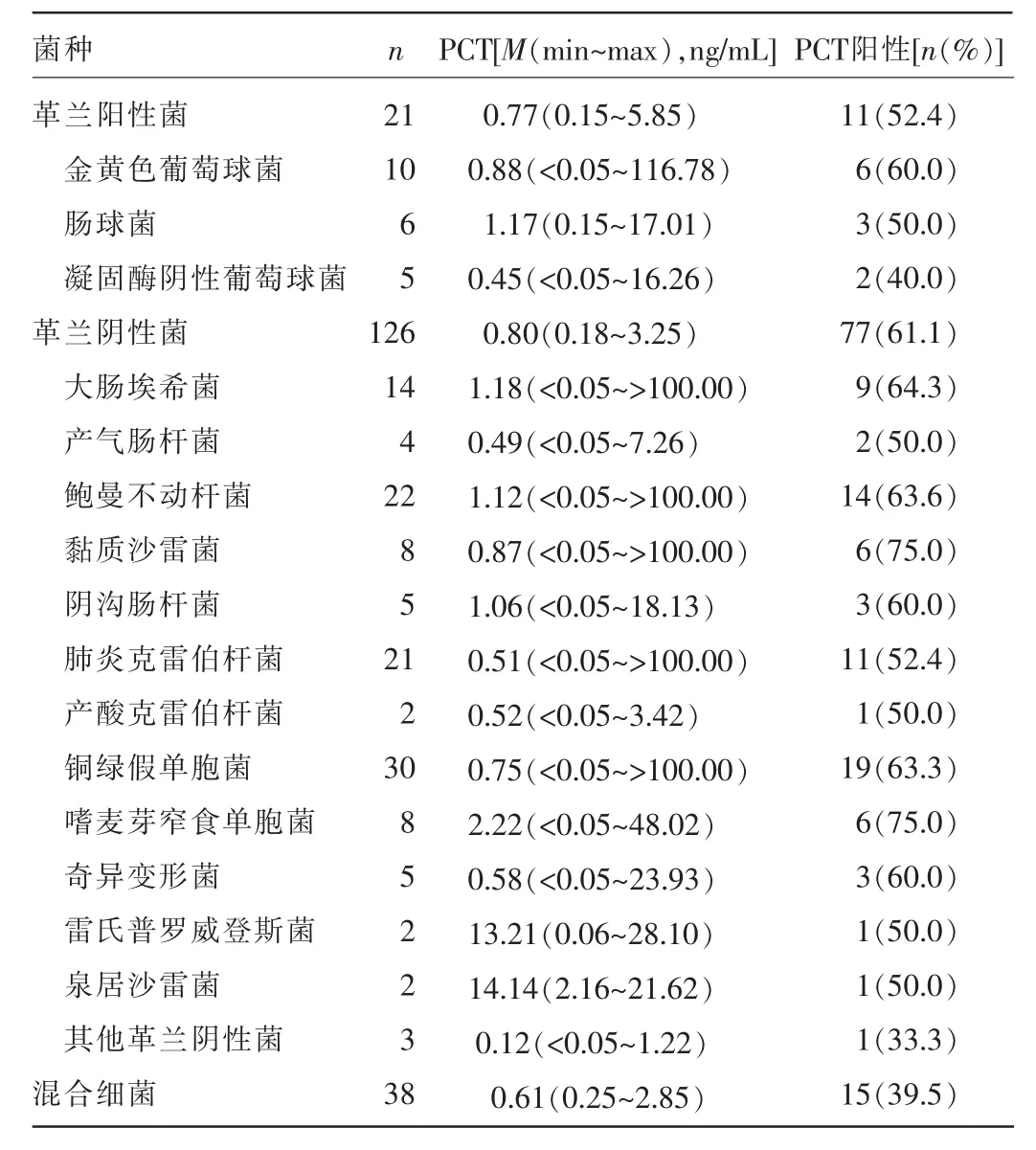
表2 细菌感染组PCT水平比较
2.3 真菌感染组PCT水平比较 本研究真菌生长55例中,白假丝酵母菌42例,热带假丝酵母菌7例,烟曲霉菌4例,其他2例。见表3。
3 讨 论
PCT是CT的前体物质,是一种内源性非类固醇类炎症介质,大多数情况下在细菌感染时诱导机体产生,对于细胞因子调控起着十分重要的作用,可作为诊断感染性疾病的早期标志物。即使患者在尚无明显临床表现或处于免疫抑制状态下,血清PCT水平也会显著升高并持续24~48 h,但在病毒感染时血清PCT水平维持在较低水平,不增加或轻度增加[4-5]。因此,通过对血清PCT水平的监测能够帮助诊断和鉴别诊断呼吸道感染疾病。
本研究痰培养结果提示,病原菌感染的240例患者中PCT阳性134例(55.8%),阳性率较高。因此,临床上对于呼吸道感染患者早期进行血清PCT监测能够帮助诊断,尽早确定治疗方案,提高预后。但也有 106例(44.2%)患者血清PCT水平未升高,这可能与标本在留取、运输和接种过程中被污染,部分致病菌为定植菌,患者入院前使用药物等因素有关。另有相关研究报道,盐酸布洛芬能够使全身炎症反应综合征患者外周血PCT水平显著下降[6-8]。
本研究中,革兰阳性菌为21例(11.4%),血清PCT水平为 0.77(0.15~5.85)ng/mL,其中 PCT阳性 11例(52.4%);革兰阴性菌为126例(68.1%),血清PCT水平为0.80(0.18~3.25)ng/mL,其中PCT阳性77例(61.1%),两组血清PCT水平比较,差异无统计学意义(U=6 021.6,P=0.624)。这与相关研究中血清PCT水平不仅能够提示机体是否细菌感染且能够区分革兰阴性菌和革兰阳性菌感染的结论不一致[9-10],可能是由于本研究与相关研究选择的标本类型不同有关。本研究选择的培养标本为痰标本,相关研究选择的标本类型为血培养标本,而细菌感染产生的内毒素能够进入血液,当血液中侵入革兰阴性菌时,不但能够诱导患者机体发生全身性炎性反应,还会同时释放内毒素,而内毒素是PCT的重要刺激因素,能够作用于靶细胞时刺激PCT的产生和分泌,而本研究的对象为呼吸道感染患者,内毒素基本不会进入血液。因此,革兰阴性菌感染和革兰阳性菌感染患者血清PCT水平不会产生显著差异。
本研究中革兰阴性菌感染最常见为大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌和铜绿假单胞菌,这几种细菌是临床上最常见的多重耐药菌,在临床上治疗困难,而连续监测患者血清PCT水平能够帮助医生了解和掌握患者感染进展情况,并指导抗生素的应用。目前有多项研究对血清PCT水平监测指导抗生素的应用进行了深入研究,取得了重大成果,形成了一整套血清PCT指导抗生素应用的治疗策略[11-12]。
呼吸道真菌感染最为常见的是深部真菌感染,如白色假丝酵母菌等。随着抗生素滥用和免疫抑制剂、激素、细胞毒性药物等在临床的广泛应用,呼吸道深部真菌感染患者也逐年增加。目前临床上对于真菌感染尚无特效药,因此治疗难度较大,多采用经验性治疗,病死率较高。目前对于真菌的实验室检查手段较为简陋,主要依靠培养和镜检,阳性率较低。本研究中,真菌感染患者血清PCT水平也显著增高,与细菌感染组患者血清PCT水平比较,差异无统计学意义(U=23 446,P=0.261)。因此,临床上检测出PCT阳性不能排除真菌感染的可能性,应进一步检查确诊。
综上所述,血清PCT水平测定在呼吸道感染性疾病的早期诊断、鉴别诊断、治疗进展和预后判断中具有十分重要的临床意义。
[1]陈飞.C-反应蛋白联合降钙素原检测鉴别肺部感染病原体的临床价值[J].中国医学创新,2012,9(12):91-92.
[2]周健,孟军,江淑芳.综合ICU多重耐药菌感染的分析与护理干预[J].护士进修杂,2012,27(19):1743-1744.
[3]陈宏斌,张小江,赵颖,等.卫生部全国细菌耐药监测网(Mohnarin)2009年度报告:ICU来源细菌耐药监测[J].中国临床药理学杂志,2011,27(7):483-489.
[4]李勇卫.32例高龄危重患者深部真菌感染治疗分析[J].陕西医学杂志,2012,41(8):1041-1043.
[5]Schuetz P,Christ-Crain M,Thomann R,et al.Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections:the ProHOSP randomized controlled trial[J].JAMA,2009,302(10):1059-1066.
[6]Tavares E,Miñano FJ.Immunoneutralization of the aminoprocalcitonin peptide of procalcitonin protects rats from lethal endotoxaemia:neuroendocrine and systemic studies[J].Clin Sci:Lond,2010,119(12):519-534.
[7]汤静,赛双桥,吴卓鸿,等.血清降钙素原和C-反应蛋白对AECOPD细菌感染的诊断价值[J].疑难病杂志,2013,12(10):756-758.
[8]顾敏,包正军,曾欣荣,等.革兰阳性与阴性菌感染血清降钙素原水平比较[J].中国感染控制杂志,2011,10(6):449-451.
[9]邹国英,任碧琼,徐飞,等.革兰阴性菌感染患者降钙素原的测定[J].国际检验医学杂志,2010,31(5):494-495.
[10]沈国森,徐致远.血清降钙素原、C反应蛋白、白细胞计数对细菌性感染的诊断价值研究[J].中国现代医生,2013,51(8):67-69.
[11]黄晓霞,汤进,柏莹.PCT、CRP、WBC、Neu%在鉴别诊断儿童细菌感染及G+与G-菌感染中的应用评价[J].国际检验医学杂志,2013,34(14):1850-1852.
[12]Charles PE,Ladoire S,Aho S,et al.Serum procalcitonin elevation in critically ill patients at the onset of bacteremia caused by either Gram negative or Gram positive bacteria[J].BMC Infect Dis,2008,8:38.
10.3969/j.issn.1009-5519.2015.20.035
B
1009-5519(2015)20-3135-03
2015-06-03)
;吴芳芳(1974-),女,浙江嘉兴人,主管检验师,主要从事临床检验基础相关研究;E-mail:wufangfang@163.com。

