冠状动脉慢血流现象相关危险因素的探讨
席连东,刘亚娟
冠状动脉慢血流现象相关危险因素的探讨
席连东,刘亚娟
目的探讨冠状动脉慢血流现象的危险因素及其发病机制。方法入选我院2012年1月—2014年1月因怀疑冠心病于我科行冠状动脉造影检查,结果示冠状动脉无明显狭窄且存在冠状动脉慢血流现象的患者与同期冠状动脉无明显狭窄且血流速度正常的患者各50例,采用校正的TIMI血流计帧法(corrected TIMI frame count,CTFC)检测,其中CTFC>27诊断为冠状动脉慢血流,所有患者均签署术前知情同意书。在冠状动脉造影术中采用抽吸导管抽取冠状动脉血,慢血流患者冠状动脉血设为A组,慢血流患者外周静脉血设为B组,冠状动脉造影无明显狭窄且血流速度正常患者冠状动脉血设为C组。结果与B组、C组比较,A组三酰甘油、胆固醇、低密度脂蛋白、高密度脂蛋白差异无统计学意义(P>0.05);C反应蛋白、白细胞介素-6、血尿酸、同型半胱氨酸、内皮素-1差异均有统计学意义(P<0.05)。结论炎性反应和内皮损伤可能参与冠状动脉慢血流的发病机制。
冠状动脉慢血流现象;炎性反应;内皮损伤;危险因素
冠状动脉慢血流(slow coronary flow,SCF)现象,指排除冠状动脉痉挛和扩张型心肌病、瓣膜病、结缔组织病等病因后在冠状动脉造影时没有发现心外膜冠状动脉存在明显病变,而远端血流灌注延迟的现象。随着冠状动脉介入诊疗技术的普及,SCF越来越受到关注,约有7%怀疑冠心病的患者进行冠状动脉造影出现慢血流现象[1]。14%的发病时间在12 h以内的不稳定型心绞痛或非Q波心肌梗死患者冠状动脉造影检查正常,这部分患者中有三分之一可见有慢血流现象发生[2]。慢血流现象可以导致心肌缺血、急性冠脉综合征甚至急性心肌梗死的发生。SCF的发病机制迄今仍不清楚,有相关研究表明,SCF可能与微循环功能失调、内皮功能障碍、冠状动脉的炎症性疾病等相关[3]。
1 资料与方法
1.1 一般资料 入选我院2012年1月—2014年1月因怀疑冠心病于我科行冠状动脉造影检查,结果示冠状动脉无明显狭窄且存在冠状动脉慢血流现象的患者(SCF组)与同期冠状动脉无明显狭窄且血流速度正常的患者(NCF组)各50例。均排除存在严重肝肾疾病、恶性肿瘤、合并感染、免疫性疾病、严重心功能不全[纽约心脏协会(NYHA)分级为Ⅲ级、Ⅳ级]者,记录相关的临床资料并统计。
1.2 冠状动脉血流速度评价及慢血流诊断标准 冠脉血流速度的评价采用Gibson等提出的TIMI血流计帧法(CTFC)记录造影剂充填各支冠状动脉的帧数, TIMI帧数均以30帧/s校正。其中第一帧为造影剂到达某支冠状动脉并占满近端横径,最后1帧为造影剂到达各支冠状动脉的远端标记。冠状动脉的远端标记处:前降支为远端分叉处,通常在心尖部;回旋支在最远端分叉处;右冠状动脉为后降支发出后侧支的第一个分支。由于前降支较回旋支及右冠状动脉长,将其所得帧数除以1.7得出前降支校正的帧数。结果的判读由两位经验丰富的心血管介入医师分析。将冠状动脉的平均帧数大于27定义为SCF。
1.3 标本采集及分组 在冠状动脉造影术中采用抽吸导管抽取冠状动脉内血,同时采外周静脉血。慢血流患者冠状动脉血设为A组,慢血流患者外周静脉血设为B组,冠状动脉造影无明显狭窄且血流速度正常患者冠状动脉血设为C组。三酰甘油(TG)、胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、C反应蛋白(CRP)、血尿酸(UA)测定由本院临床检验中心生化室(日立7600-020全自动生化分析仪)完成,白细胞介素-6(IL-6)、内皮素-1(ET-1)测定采用酶联免疫测定ELISA法,采用上海西唐生物科技有限公司试剂盒检测。操作步骤严格按照说明书进行。
1.4 统计学处理 采用SPSS17.0统计软件进行分析。计量资料用均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用Bonferroni法。以P<0.05为差异有统计学意义。
2 结 果
2.1 SCF组、NCF组一般资料比较 两组患者年龄、性别、吸烟、饮酒、体重指数、血压、空腹血糖、尿素氮、肌酐差异无统计学意义。详见表1。
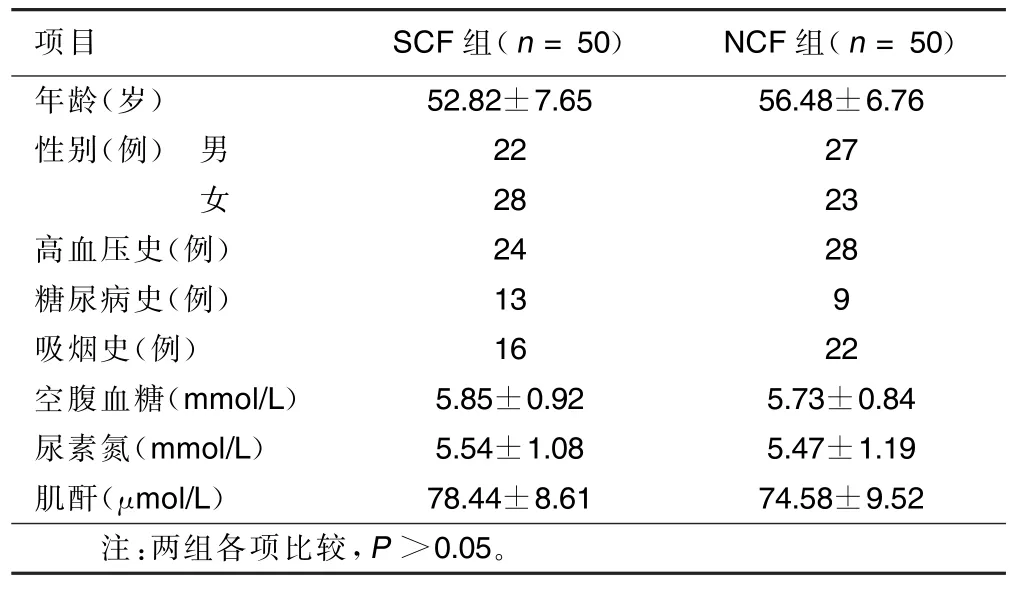
表1 SCF组、NCF组一般资料比较
2.2 SCF组与NCF组平均帧数比较(见表2)
表2 SCF组与NCF组平均帧数比较(±s)

表2 SCF组与NCF组平均帧数比较(±s)
组别平均帧数SCF组32.58±2.84 NCF组18.96±2.73 P <0.05
2.3 A组、B组、C组各检测指标比较(见表3) 与B组、C组比较,A组TG、TC、LDL、HDL差异无统计学意义(P>0.05),CRP、IL-6、UA、同型半胱氨酸(Hcy)、ET-1比较差异均有统计学意义(P<0.05)。详见表3。
表3 A组、B组、C组各检测指标比较(±s)
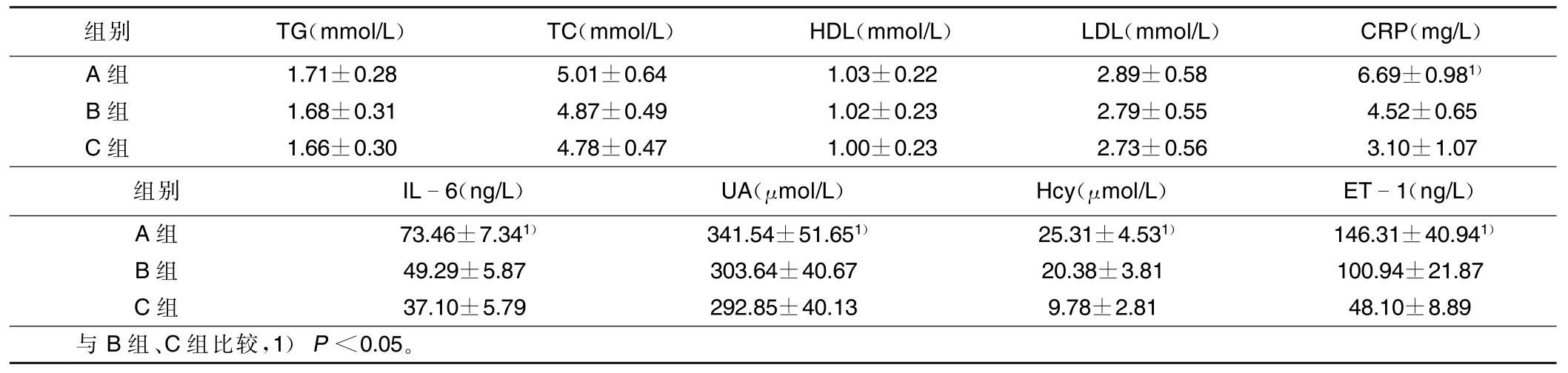
表3 A组、B组、C组各检测指标比较(±s)
组别TG(mmol/L)TC(mmol/L)HDL(mmol/L)LDL(mmol/L)CRP(mg/L) A组1.71±0.285.01±0.641.03±0.222.89±0.586.69±0.981)B组1.68±0.314.87±0.491.02±0.232.79±0.554.52±0.65 C组1.66±0.304.78±0.471.00±0.232.73±0.563.10±1.07组别IL6(ng/L)UA(μmol/L)Hcy(μmol/L)ET1(ng/L) A组73.46±7.341)341.54±51.651)25.31±4.531)146.31±40.941)B组49.29±5.87303.64±40.6720.38±3.81100.94±21.87 C组37.10±5.79292.85±40.139.78±2.8148.10±8.89与B组、C组比较,1)P<0.05。
3 讨 论
越来越多的研究表明,冠状动脉慢血流现象不单纯是冠状动脉造影的偶发现象,很可能导致心绞痛和心肌梗死的发生。冠状动脉慢血流经冠状动脉造影的检出率约为1%[4]。本科室两年完成冠状动脉造影上千例,冠状动脉慢血流现象的检出率约为3.8%,检出率高可能与随着冠状动脉造影检查技术的进步,冠状动脉造影检查较以前更普及,冠状动脉造影人群较以前发生了变化有关。
本研究结果表明,慢血流患者冠状动脉血中CRP、IL-6较外周静脉血含量高,且慢血流冠状动脉血CRP、IL-6较对照组高。血浆CRP、IL-6等炎性标记物增高,提示炎性反应可能参与了SCF的病理过程。IL-6是一种糖蛋白,广泛表达于活化的B细胞、静止T细胞、NK细胞等表面。在通常情况下,正常人血清中含有的微量IL-6,认为是内皮细胞持续分泌的结果。在病理情况下,其可促进心肌细胞表达黏附分子,增强白细胞和心肌细胞的黏附作用,加重心肌细胞损伤。而CRP作为一种非特异性炎症反应标志物参与了相关心血管病的发生与发展。有研究发现CRP通过对人内皮细胞凋亡相关基因Bcl-2/Bax表达的影响来诱导内皮细胞凋亡,并且这种效应具有浓度依赖和时间依赖效应性。而内皮细胞凋亡在动脉粥样硬化的发病中起着重要的作用。最近在体内试验研究中发现,CRP通过内皮型一氧化氮合酶脱偶联(endothelial nitric oxide synthase,eNOS)作用引起NO(n-i tric oxide,NO)水平下降,从而导致NO依赖的血管舒张障碍,最终引起血管内皮功能不良[5]。Devaraj等[6]则研究表明CRP是通过损伤内皮细胞表面的细胞衣而导致内皮功能障碍的。此外,研究还发现C反应蛋白可使骨髓内皮祖细胞的迁移、黏附、增殖功能受损,且这种变化与C反应蛋白浓度与作用时间呈正相关。而内皮祖细胞参与血管内皮损伤后修复过程,对促进损伤血管再内皮化、减轻血管损伤后新生内膜过度增殖、恢复内皮功能、防止动脉粥样硬化发生发展具有重要作用。由此,C反应蛋白可能是通过损伤骨髓内皮祖细胞参与的内皮修复功能导致内皮功能不良。另外,CRP还可降低NO、前列环素,显著刺激内皮细胞释放具有很强收缩作用的ET-1,促进血管内皮激活和动脉粥样硬化斑块的形成;通过上调内皮细胞NF-κB的表达增加一系列炎症因子如肿瘤坏死因子和白细胞介素-1(IL-1)的产生,进一步促进单核细胞的聚集和泡沫细胞的形成和聚集;直接上调血管平滑肌细胞的血管紧张素1型受体,后者可以刺激平滑肌细胞移行、增殖,促进动脉粥样硬化的发展。另外,CRP可以刺激单核细胞组织因子的释放而促进血小板黏附和活化,以及促进纤溶酶原激活剂抑制物-1的合成,在斑块不稳定性方面也起着重要的作用。
新近有许多学者经过大量的临床和实验研究后提出血中高Hcy是致SCF的又一独立危险因素[7]。高Hcy血症作为内皮损伤结果,与ET分泌增加呈正相关,改变血液系统的抗凝状态及血小板功能,促进LDL氧化,从而参与动脉粥样硬化发生发展过程。本研究结果表明慢血流冠状动脉血中Hcy水平明显高于慢血流外周静脉血组及对照冠状动脉血组,提示高Hcy血症可能与SCF发生有关。而单因素相关分析的结果显示慢血流冠状动脉血中Hcy水平与ET水平呈正相关,提示高Hcy血症可能是损伤内皮细胞,引起ET分泌增加,启动动脉粥样硬化及SCF发生的另一个重要的危险因素。本研究同时发现血浆Hcy增高与血脂水平之间无相关关系,且相关研究表明与其他危险因素(如高血压、吸烟、糖尿病等)之间并不相关,说明高Hcy可能是SCF发生的一个独立危险因子。
血尿酸是人体内嘌呤代谢的最终产物,主要由细胞代谢分解的核酸、食物中的嘌呤和其他嘌呤类化合物分解而来。UA增加与嘌呤的过量合成及肾脏对UA的排出减少有关。Niskanen等[8]在排除肾脏功能和糖尿病对心脑血管危险的影响后发现,高UA血症能使心血管疾病死亡危险增加4.77倍。相关研究表明,UA可作为动脉粥样硬化的一个独立的危险因子。UA的形成往往伴有氧自由基、过氧化氢等活性氧生成,活性氧参与炎症反应灭活NO,从而损伤血管内皮细胞以至血管内皮功能不良,造成SCF;另外,高UA水平可促进LDL的氧化和脂质过氧化,增加和放大氧化应激反应,促使动脉粥样硬化斑块形成,增加血管阻力而导致血流缓慢;且高UA血症患者UA结晶析出,沉积于血管内壁直接损伤血管内膜,诱发和加重动脉粥样硬化。
总之,SCF确切的发病机制仍不清楚,尚需大量的临床和实验研究,可能是多种病理机制共同参与的结果,包括炎性反应、内皮功能失调、动脉粥样硬化、微血管病变等。SCF与心肌缺血存在密切关系,可能是导致缺血性心脏病的新的发病机制。另外,本研究还发现慢血流冠状动脉血中血尿酸较其外周静脉血含量高,而慢血流外周静脉血血尿酸含量与对照组冠状动脉血含量差异无统计学意义。提示冠状动脉血与外周静脉血存在一定的差异,不能简单的由外周静脉血来替代冠状动脉血反映影响冠脉血流各因素的真实情况。
[1] Tambe AA,Demany MA,Zimmeman HA.Angina pectoris and slow flow velocity of dye in coronary arteries:A new angiographic finding[J].Am Heart J,1972,84:66-71.
[2] Celebi H,Catakoglu AB,Kurtoglu H.The relation between coronary flow rate,plasma endothelin-1 concentrations,and clinical characterstics in patients with normal coronary arteries[J].Cardiovasc Revasc Med,2008,9:144-148.
[3] Yumashits K,Takahiro K,Kamezaki F.Decreased plasma extracellular superoxide dismutase level in patients with vasospastic angins[J].Atherosclerosis,2007,191:147-152.
[4] Beltrame JF,Turner SP,Leslie SL.The angiographic and clinical benefits of mibefradil in the coronary slow flow phenomenon[J]. J Am Coll Cardiol,2004,44:57-62.
[5] Li JJ,Qin XW,Li ZC.Increased plasma C-reactive protein and interleukin-6 concentrations in patients with slow coronary flow [J].Clin Chim Acta,2007,385:43-47.
[6] Devaraj S,Kumaresan PR,Jialal I.C-reactive protein induces release of both endothelial microparticles and circulating endothelial cells in vitro and in vivo:Further evidence of endothelial dysfunction[J].Clin Chem,2011,57:1752-1761.
[7] Fragasso G,Chierchia SL,Arioli F.Coronary slow-flow causing transient myocardial hypoperfusion in patients with cardiac syndrome X:Long-term clinical and functional prognosis[J].Int J Cardiol,2009,137:137-144.
[8] Niskanen LK,Laaksonen DE,Nyyssnen K,etal.Uric acid level as a risk factor for cardiovascular and all-cause mortality in middle -aged men:A prospective cohort study[J].Arch Intern Med,2004, 164:1546-1551.
R543.3R256.2
:B
10.3969/j.issn.1672-1349.2015.02.036
:1672-1349(2015)02-0230-03
2014-08-13)
(本文编辑郭怀印)
首都医科大学密云教学医院(北京101500)通讯作者:刘亚娟,E-mail:liuyaiuan1966@126.com

