ΔG判据与ΔrGm判据的区别
孙文东(东北师范大学化学学院 吉林长春 130024)
师生笔谈
ΔG判据与ΔrGm判据的区别
孙文东*
(东北师范大学化学学院 吉林长春 130024)
简要说明ΔG与ΔrGm作为方向性判据的区别。其中ΔG判据的适用条件是封闭系统的等温等压过程;而ΔrGm判据是ΔG判据应用于化学反应系统时的进一步推演。ΔrGm代表反应系统在某一时刻的势函数,作为方向性判据,只需要W′=0,而不需要等温等压条件。
ΔG判据 ΔrGm判据 吉布斯函数
从符号上看,ΔG表示一个过程的吉布斯函数变化,当用于化学反应时变为ΔrG,表示单位反应进度时变为ΔrGm,ΔrGm称为反应的摩尔吉布斯函数。从符号表示法的演变过程来看,容易产生一个误解,似乎ΔG和ΔrGm作为过程方向判据的适用条件均为等温等压。事实上,这两种判据有着本质的差别。例如,在封闭系统中进行气相反应时,随着反应进度的改变,系统的总压也在改变,但仍可应用ΔrGm判据。
1 ΔG判据
ΔG作为方向性判据早已熟知,目前虽然对于“非体积功为0”是否必要存在争议,但“等温等压”条件则必不可少。这里只对过程自发性判据的引出作如下说明。
根据热力学第一、二定律的数学表示式可以导出,在等温等压下,有:
ΔG≤W′
(1)
式中W′为过程的非体积功;“=”表示过程可逆(R);“<”表示过程不可逆(IR)。即式(1)是过程可逆性的判据。那么判别过程可逆性的公式(式(1))是如何与过程的自发性判据联系起来的呢?讨论如下:
将式(1)改写为:
(2)
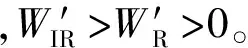

需要指出的是,为什么在等温等压下的作功能力要用体积功之外的非体积功来衡量呢?因为在过程中如果系统的体积发生变化,则不可避免地必须反抗外压而作体积功,才能保证过程在等压下进行;也就是说,这个体积功是用来维持等压过程的,所以它不能用来衡量系统在等温等压下的作功能力。只有非体积功才能表示系统在恒温恒压过程中的作功能力。例如原电池在等温等压下用电功来衡量作功能力。
2 ΔrGm判据
ΔrGm判别自发性的条件与最初由热力学第二定律导出的ΔG≤0的判别自发性的条件(等温等压)不同。推导如下:
设封闭系统中的任一反应
当反应发生一微小变化(δW′=0)时,系统的吉布斯函数改变为:
(3)
在等温等压下,式(3)变为:
(4)
因为

所以
dnB=νBdξ
(5)
将式(5)代入式(4),得:
(6)
式(6)可写成:
(7)
定义为反应的摩尔吉布斯函数(变)ΔrGm,即:
(8)
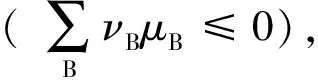
(9)
(10)
(11)
也可导出:
(12)
在式(12)各下角标的条件下,自发性判据均可表示为:
(13)
定义化学反应亲和势A为:
(14)
式(14)即是只作体积功的化学反应系统的方向和限度的判据。此判据与达到平衡的方式(如等温等压等)无关[2],但是系统的热力学函数在平衡时的极值性质却与系统达平衡的方式有关。具体地说,等温等压下达平衡时,系统的G最小;等温等容下达平衡时,系统的A最小。
3 结论
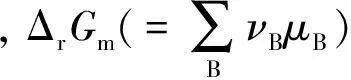
[1]胡英.物理化学.第5版.北京:高等教育出版社,2007
[2]天津大学物理化学教研室编.刘俊吉,周亚平,李松林修订.物理化学(上册).第5版.北京:高等教育出版社,2009
TheDifferencebetweenΔGandΔrGmCriteria
Sun Wendong
(FacultyofChemistry,NortheastNormalUniversity,Changchun130024,Jilin,China)
The difference between ΔGand ΔrGmas direction criteria was briefly described. The ΔGcriterion is applicable to the isothermal and isobaric processes of the closed system; however, the ΔrGmcriterion is the further deduction of application of the ΔGcriterion in chemical reaction system and represents the potential function of the reaction system at a certain time. ΔrGmas the direction criteria requires onlyW′=0 instead of the isothermal and isobaric conditions.
ΔGcriterion; ΔrGmcriterion; The Gibbs function
10.3866/pku.DXHX20150552
O6;G64
*通讯联系人,E-mail:sunwd843@nenu.edu.cn

