经皮心室重建术——左心室室壁瘤治疗新进展
官洪山 综述 上官海娟 审校
(安徽医科大学第二附属医院心内科,安徽 合肥 230601)
大面积心肌梗死后坏死的心肌逐渐被纤维瘢痕组织所替代,室壁变薄、向外膨出,形成室壁瘤。室壁瘤最常见于左心室。内科药物治疗和外科左心室减容术是临床常用的治疗方法。尽管外科左心室减容术疗效确切,但手术难度大、风险高,手术病死率和并发症发生率高,而且对术者的要求较高,临床应用受限;而内科药物疗效欠佳。近年来国外研发出一种新的技术:经皮心室重建术(percutaneous ventricular restoration,PVR),对左心室室壁瘤合并心力衰竭患者采用经皮股动脉植入心室隔离装置(ventricular partitioning device,VPD)的方法,减少左心室容积,减少收缩期心室内分流,增加左心室射血量,改善患者临床症状及心功能。第一例PVR 由Otasevic 等在2005年施行,近年来逐渐在国外开展,并获得欧洲安全认证标志。
1 手术器材
PVR 手术器材由三个部分组成[1]:入路系统、输送系统、左心室隔离装置(图1)。
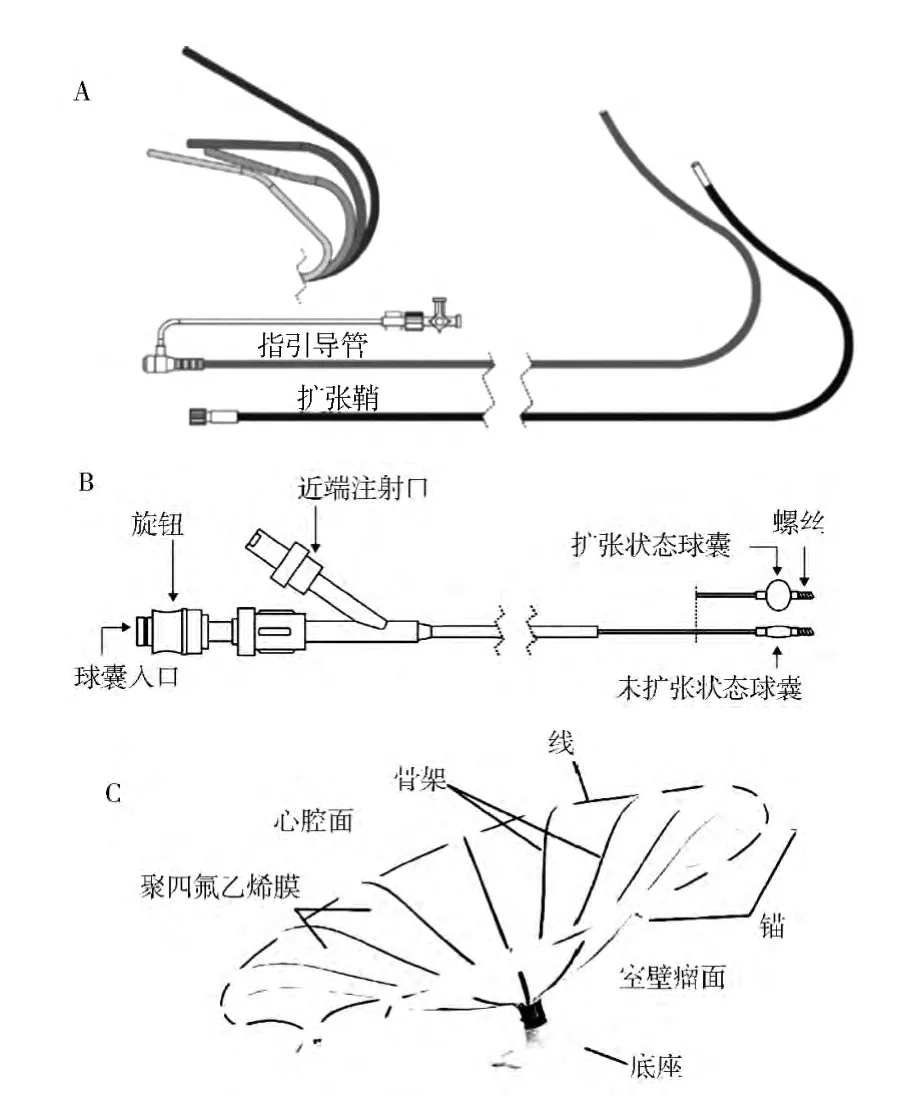
图1 PVR 手术器材[1]
入路系统:包括一个指引导管和扩张鞘。指引导管内腔可容纳一个折叠左心室隔离装置,以便将左室隔离装置输送到左心室,有多种型号导管可供选择。
输送系统:用于将折叠的心室隔离装置输送并定位于心尖部。输送系统管腔提供容纳推送杆的通道,在其前端是左心室隔离装置。通过在输送导管的近端旋转脱离旋钮,左心室隔离装置可以安装或拆卸。球囊被设计成在加压时挤压左心室隔离装置的支架,以确保左心室隔离装置充分扩张以及支架贴壁。
左心室隔离装置:外形似降落伞,由自膨胀镍钛记忆合金支架、覆盖于支架上的聚四氟乙烯膜以及尼龙弹性体成分的底座组成。镍钛记忆合金支架有16个骨架,每根骨架的顶端是2 mm 锚。锚的作用是稳定植入物,防止脱落和移位。一旦左心室隔离装置展开,聚四氟乙烯膜将隔离室壁瘤与心室腔。目前有八种不同大小的左心室隔离装置可用于植入,伞面直径有65 mm、75 mm、85 mm 和95 mm 四种规格,每种规格依据隔离装置底座的长度分为长底座和短底座。
2 适应证
综合国外研究,PVR 主要入选标准[2-4]:(1)患者年龄>18 岁;(2)陈旧性前壁心肌梗死合并室壁瘤,且超声左心室射血分数<40%;(3)按照现有指南强化药物治疗超过3 个月,心功能Ⅱ~Ⅳ级(NYHA 分级);(4)适合行心脏外科手术;(5)签署书面知情同意书。PVR 主要排除标准:(1)急性心肌梗死60 d 内;(2)患者心肌缺血需要血运重建;(3)冠状动脉血运重建治疗60 d 内;(4)心脏再同步化治疗60 d 内;(5)显著瓣膜病需要外科手术治疗;(6)左心室血栓;(7)左心室室壁钙化;(8)急性心力衰竭、感染或炎症性疾病、活动性出血、血小板减少症、贫血、外科手术或创伤后2 个月内、肝肾功能不全、乙醇或药物依赖、其他严重慢性疾病或肿瘤;(9)患者不愿意行左心室隔离装置植入。
3 术前准备以及围术期用药
拟行PVR 的患者,常规行超声心动图、CT 或磁共振检查等判断患者解剖条件是否符合进行PVR[4]。心脏CT 或磁共振扫描可以准确地识别左心室心尖部解剖结构和左心室形态,有助于发现低位乳头肌、心肌过度小梁化及左心室壁钙化。对于适合行PVR 术患者,CT[5]或磁共振扫描成像后于心室舒张末期测量室壁瘤与心室连接区的直径和以及室壁瘤顶端到连接区的高度,确定左心室隔离装置的大小。
术前3 d,开始口服阿司匹林300 mg/d。术前静脉给予普通肝素并维持活化凝血酶原时间>250 s,术后1年口服阿司匹林100 mg/d 及华法林抗凝,维持国际标准化比值2.0~3.0[4]。是否预防性使用抗生素依据手术操作时间长短以及患者基础情况而定。此外,患者在左心室隔离装置植入前、后常规接受规范化抗心力衰竭治疗。
4 PVR 手术过程[1]
局麻后,穿刺左侧股动脉进行左心室造影。穿刺右股动脉植入14 F(1 F≈0.33 mm)或16 F 鞘管,于左心室内植入6 F 猪尾导管,沿猪尾导管植入2.6 m造影导丝,保留导丝,撤出猪尾导管,沿导丝将14 F 或16 F 指引导管(内有扩张鞘和5~7 F 多功能导管)放至室壁瘤顶端,撤出扩张鞘、多功能导管和导丝。在体外水槽内将左心室隔离装置安装于输送导管内,充分排气后,通过指引导管将隔离装置放于室壁瘤中央,经左心室造影和超声心动图确认隔离装置的底座已经位于室壁瘤中央后固定输送导管,撤指引导管并扩张球囊释放隔离装置(图2)。手术完成后,复查左心室造影及超声心动图。

图2 PVR 手术过程[1]
5 PVR 的治疗效果
临床上早期文献多为成功植入左心室隔离装置的个案报道[6-7]。Silva 等[1]报道了5 例患者成功植入左心室隔离装置术后即刻超声检查显示左心室收缩末期以及舒张末期心室容积显著减小、射血分数增加、心功能改善。Schmidt 等[8]报道了16 例患者植入左心室隔离装置后即刻左心室舒张末期左心室容积以及收缩末期容积显著减小(P <0.000 1),同时左心室每搏量增加25.4%(P=0.000 5),每搏量指数增加26.5%(P=0.000 5),心排血量以及心脏指数显著增加(P 均<0.000 1),射血分数显著增加(P <0.000 1);同时还发现主动脉内(P =0.005 0)以及肺动脉(P=0.034 7)平均压力增加,这些结果表明左心室隔离装置植入后立即显著减少左心室容积,能够迅速改善左右心室功能。因此心室舒张以及收缩末期容积减少,室内分流量减少是左心室隔离装置植入后早期心功能改善的机制。
Bozdag-Turan 等[4]在8 例患者成功植入左心室隔离装置并进行3 个月随访,发现患者左心室容积减小,射血分数增加,NYHA 分级以及6 分钟步行距离改善;随访期间无主要心血管事件发生,亦无因心力衰竭而再次住院事件发生。Sagic 等[3]对15 例成功植入左心室隔离装置的患者进行随访。1 例患者术后15 d 因心脏外感染死亡。与术前比较,14 例患者术后6 个月、12 个月左心室收缩末期容积指数[(189 ±45)mL/m2vs (142±29)mL/m2vs (151 ±48)mL/m2,P <0.001 ]以及左心室舒张末期容积指数[(260 ±47)mL/m2vs (208±33)mL/m2vs (222 ±58)mL/m2,P <0.001 ]均显著减小,左心室射血分数显著改善[(28 ±7)% vs (32 ±7)% vs(33 ±9)%,P=0.02],同时NYHA 心功能分级显著改善[(2.21 ±0.57)vs(1.28 ±0.46)vs (1.23 ± 0.43),P <0.001];与术前比较,术后6 个月时6 分钟步行距离无显著变化[(382 ±123)m vs (409 ±129)m,P >0.05],术后12个月时6 分钟步行距离增加[(382 ±123)m vs (425±140)m,P <0.05]。Mazzaferri 等[2]报道了目前入选患者最多的一项PVR 研究,39 例患者拟行PVR 手术,进一步筛选后共有34 例患者进行了PVR 手术,3 例患者在住院期间因并发症行取出左心室隔离装置,31例患者手术成功。与术前相比,术后12 个月患者左心室舒张末容积指数、收缩末期容积显著减小,NYHA 心功能分级显著改善[(2.5 ±0.6)vs(1.3 ±0.6),P <0.001],明尼苏达心力衰竭生活质量指数显著提高[(38.6 ±6.1)vs(28.4 ±4.4),P <0.002],但是静息状态下每搏量[(33.5
±1.6)mL/m2vs (32.0 ±1.8)mL/m2,P=0.442]、左心室射血分数[(26.9 ±1.4)%vs (29.4 ± 1.4)%,P = 0.152]及6 分钟步行距离[(358.5 ±20.4)m vs (374.7 ±25.6)m]变化无统计学差异。术后12~24 个月未出现心血管事件。术后3年时,23 例患者生存;与术前相比,85%患者NYHA分级改善或保持不变,超声心动图显示左心室舒张及收缩末期容积指数分别从(128.4 ± 22.1)mL/m2、(94.9 ±22.3)mL/m2减少到(115.2 ±23.1)mL/m2、(87.3 ±18.7)mL/m2(舒张末期指数P =0.005 6;收缩末期心室容积指数P =0.471 9)[9];术后12、24、36个月时累积因心力衰竭住院以及病死率分别为16.1%、32.3%、38.7%。在3年随访期间,2 例患者发生心源性死亡(均于术后6 个月内)[2,9],1 例患者于术后6 个月后发生脑卒中[2],1 例患者因严重心力衰竭于PVR 术6 个月后行心脏移植[2],手术6 个月后无心源性死亡事件发生[9],这项研究表明左心室隔离装置植入可以改善室壁瘤患者长期心功能,提高生活质量以及生存率。通过CT[10]及计算机模拟技术[11]发现,左心室隔离装置植入后降低室壁张力是患者中长期心功能改善、心室肥厚逆转的重要因素。
以上临床研究表明PVR 可以显著减少左心室容积,改善心室重构,改善患者的临床症状,但是由于入选患者基础心脏条件存在较大的差异,随访时间、评估方法也不同,手术成功率、并发症以及临床疗效存在较大差异,因此需要更多人群、更长时间的随访,明确该手术是否可以降低心血管事件,尤其是心力衰竭相关的病死率。
6 PVR 术后病理过程
目前对于左心室隔离装置植入后的病理过程研究较少,Ladich 等[12]对7 例行PVR 患者进行了全程随访,平均随访时间408 d(15~1 553 d)。1 例患者术后15 d 因严重感染死亡,3 例患者术后心源性死亡(2 例术后4 个月,1 例术后1 553 d),3 例患者行心脏移植术(PVR 术后149 d、196 d、680 d)。研究人员对左心室隔离装置进行病理学检查(4 例尸检,3 例心脏移植)发现,早期(<30 d)聚四氟乙烯表面局部血小板-纤维蛋白血栓附着,左心室隔离装置边缘为巨噬细胞、炎症细胞以及少量平滑肌细胞/肌性成纤维细胞构成的血栓;中期(31~300 d)左心室隔离装置边缘的血栓机化、内皮细胞层增厚,左心室隔离装置心室腔面的其他部分显示出不同程度的内皮化和纤维蛋白沉积,左心室隔离装置室壁瘤面呈现机化血栓和不同程度的内皮细胞覆盖;晚期(PVR 术后680 d 和1 533 d)左心室隔离装置表面出现内膜组织。
7 手术并发症
文献报道的PVR 手术并发症主要有[2-3,13]:血栓形成、聚四氟乙烯膜撕裂、支架底座断裂、封堵装置移位、封堵器未展开、感染、脑卒中、出血等。
8 展望
近期开展的PARACHUTE Ⅳ研究[14]采用随机对照的方法,入选478 例陈旧性前壁心肌梗死后左心室前壁-心尖部室壁瘤合并心力衰竭患者,随机分为接受PVR 治疗和传统药物治疗者,主要观察终点为死亡和因心力衰竭再次住院。PARACHUTE Ⅳ的研究结果有可能为左心室隔离装置植入手术提供更加合理的患者入选条件、左心室隔离装置植入时机、手术前后的药物治疗方案,为不能耐受或不愿意行外科心室减容术的左心室室壁瘤患者提供了一种新的有效的治疗方法。
[1]Silva G,Melica B,Pires de Morais G,et al.Percutaneous implantation of a ventricular partitioning device for treatment of ischemic heart failure:initial experience of a center[J].Rev Port Cardiol,2012,31(12):795-801.
[2]Mazzaferri EL Jr,Gradinac S,Sagic D,et al.Percutaneous left ventricular partitioning in patients with chronic heart failure and a prior anterior myocardial infarction:Results of the PercutAneous Ventricular RestorAtion in Chronic Heart failUre PaTiEnts Trial[J].Am Heart J,2012,163(5):812-820.
[3]Sagic D,Otasevic P,Sievert H,et al.Percutaneous implantation of the left ventricular partitioning device for chronic heart failure:a pilot study with 1-year follow-up[J].Eur J Heart Fail,2010,12(6):600-606.
[4]Bozdag-Turan I,Bermaoui B,Paranskaya L,et al.Challenges in patient selection for the parachute device implantation[J].Catheter Cardiovasc Interv,2013,82(5):E718-E725.
[5]Bozdag-Turan I,Bermaoui B,Turan RG,et al.Parachute implant:CT morphological criteria of our center to identify the suitable patient[J].Cardiovasc Ther,2014,32(1):26-31.
[6]Cilingiroglu M,Rollefson WA,Mego D.Percutaneous implantation of a parachute device for treatment of ischemic heart failure[J].Cardiovasc Revasc Med,2013,14(4):236-240.
[7]Boerlage-van Dijk K,Meregalli PG,Planken RN,et al.Percutaneous left ventricular partitioning device for chronic heart failure[J].Neth Heart J,2012,20(12):513-515.
[8]Schmidt T,Frerker C,Thielsen T,et al.New evidence for favourable effects on haemodynamics and ventricular performance after Parachute((R))implantation in humans[J].Eur J Heart Fail,2014,16(10):1112-1119.
[9]Costa MA,Mazzaferri EL Jr,Sievert H,et al.Percutaneous ventricular restoration using the parachute device in patients with ischemic heart failure:threeyear outcomes of the PARACHUTE first-in-human study[J].Circ Heart Fail,2014,7(5):752-758.
[10]Menon PG,Ludwig D,Lacomis J,et al.Computed tomographic analysis of left ventricular volumes and function after implantation of the parachute(R)endoventricular partitioning device[J].J Interv Cardiol,2014,27(6):604-609.
[11]Lee LC,Ge L,Zhang Z,et al.Patient-specific finite element modeling of the Cardiokinetix Parachute((R))device:effects on left ventricular wall stress and function[J].Med Biol Eng Comput,2014,52(6):557-566.
[12]Ladich E,Otsuka F,Virmani R.A pathologic study of explanted parachute devices from seven heart failure patients following percutaneous ventricular restoration[J].Catheter Cardiovasc Interv,2014,83(4):619-630.
[13]Ladich E,Otsuka F,Virmani R.A pathologic study of explanted parachute devices from seven heart failure patients following percutaneous ventricular restoration[J].Catheter Cardiovasc Interv,2014,83(4):619-630.
[14]Costa MA,Pencina M,Nikolic S,et al.The PARACHUTE IV trial design and rationale:percutaneous ventricular restoration using the parachute device in patients with ischemic heart failure and dilated left ventricles[J].Am Heart J,2013,165(4):531-536.

