以上海高考题为例谈化学实验方案的设计与评价
张顺清

此类试题能全面综合地考查考生的化学知识、实验技能、思维过程及书面表达能力。本文把近十余年上海高考主观题(非选择题)中的涉及化学实验方案的设计与评价的试题进行了详细的汇总和归类,希望对上海地区化学同仁们的高三复习备考有所裨益。
一、考查化学实验方案的评价
对几个实验方案的正确与错误、严密与不严密、准确与不准确作出判断,要考虑是否完全合理、有无干扰现象等,一般从下面几个方面进行评价:①生成相同量的产品,副产品可循环利用,消耗原料少且原料丰富可再生,价格低廉的方案优;②条件合适,操作简单步骤少的方案优;③转化率高、产物纯净的方案优;④环境友好无污染的方案优。这种类型的试题是近三年上海高考实验题的必考点,连续三年每年都有考查,特别是2014年出现了二次。
例1(2014年)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤;②不通氨,冷却、加食盐,过滤。
对两种方法的评价正确的是(选填编号)
a.①析出的氯化铵纯度更高
b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用
d.②的滤液可直接循环使用
解析母液中含有氯化铵、饱和碳酸氢钠、未反应完的氯化钠,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨,产生同离子效应可以使氯化铵结晶沉淀析出,此时通入氨还有一个作用是中和饱和碳酸氢钠生成碳酸钠,防止降温后碳酸氢钠析出,使得到的氯化铵更纯净。过滤后滤液中含有氨,不能直接循环使用,而②的滤液可直接循环使用。
答案:ad。
例2(2012年)碳酸氢铵是一种重要的铵盐。实验室中,将二氧化碳通入氨水可制得碳酸氢铵,用碳酸氢铵和氯化钠可制得纯碱。
为探究NH4HCO3和NaOH的反应,设计实验方案如下:含0.1 mol NH4HCO3的溶液中加入
0.1 mol NaOH,反应完全后,滴加氯化钙稀溶液。
若有沉淀,则NH4HCO3与NaOH的反应可能为(写离子方程式);
若无沉淀,则NH4HCO3与NaOH的反应可能为(写离子方程式);
该实验方案有无不妥之处?若有,提出修正意见。
解析向NH4HCO3溶液中加入NaOH时,发生的离子反应有:HCO-3+OH-CO2-3+H2O、NH+4+OH-NH3+H2O,若NaOH量不足,则两反应存在先后顺序问题,故实验中若产生沉淀,说明反应后溶液中含有CO2-3,证明先发生HCO-3+OH-CO2-3+H2O,否则先发生NH+4+OH-NH3+H2O。如果不煮沸,产生的NH3·H2O能够将HCO-3变成CO2-3与Ca2+产生CaCO3沉淀,最终与前一种现象相同。
答案:HCO-3+OH-CO2-3+H2O、NH+4+OH-NH3+H2O;需先煮沸,然后滴加氯化钙稀溶液。
例3(2005年)用NaClO3氧化FeSO4时反应如下:
6FeSO4+NaClO3+3H2SO4
3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则化学方程式如下:
6FeSO4+2HNO3+3H2SO43Fe2(SO4)3+2NO↑+4H2O
已知1mol HNO3价格0.16元、1 mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是 ,弊是 。
解析从环保和成本两个方面考虑,利是原料便宜,弊是NO会污染空气。
答案:利:原料成本较低;弊:产生气体对大气有污染。
二、考查物质检验实验方案的设计
常见的物质(包括阴阳离子、有机官能团)的检验和鉴别是全国高考化学实验中的必考点,上海高考也不例外。比如:2012年考查了CO2-3和醛基的检验、2010年考查了Cl-的检验、2009年考查了Fe3+的检验、2008年考查了NH+4的检验、2007年考查了CO2-3的检验、2005年考查了酚羟基的检验。这里只把比较新颖(非常规型)的物质检验的实验方案设计试题进行了归纳,以便为以后解答这类试题提供一些启发和借鉴。
例4(2014年)实验室通常用向上排空气法收集氯气,设计一个简单实验,验证所收集的氯气中是否含有空气:。
解析氯气可与氢氧化钠溶液反应,如含有空气,则与氢氧化钠反应后试管内有气体残留。
答案:用试管收集氯气,收集满后将试管倒立在氢氧化钠溶液中,观察试管内有无残留气体。
三、考查定量化学实验方案的设计
定量实验注重学生对实验数据的分析和处理能力,以及对实验流程的推理能力。对实验进行设计的关键是分析判断题目想通过哪种定量方法(气体质量法、气体体积法、沉淀质量法、中和滴定法、灼烧法等)来测定什么量,如何排除干扰精确的定量。还要看清题目已经给定了什么数据还差什么数据,最终一步步推导分析出如何设计实验步骤来测得这些未知数据以达到实验目的。
例5(2008年)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①取钾氮肥试样并溶于水,加入足量的
溶液,产生白色沉淀;
②、、(依次填写实验操作名称)。
③冷却、称重。
解析混合肥料中含有K2SO4、(NH4)2SO4,只能考虑把SO2-4转化为沉淀,因此,加入的溶液为BaCl2或Ba(NO3)2溶液;然后先将混合液过滤,再洗涤沉淀,最后干燥,冷却后称量。
答案:BaCl2或Ba(NO3)2;过滤 、洗涤、干燥。
例6(2006年)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
(1)①样品称量;②高温分解;③;④;⑤MgO质量。
(2)18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:a=;b=;c=。
解析需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量(或体积);④生成水的质量;利用浓硫酸的吸水性先干燥气体,再称量碱石灰吸收CO2前后的质量;根据分解的化学方程式,由镁守恒,质量守恒进行计算a、b、c的数值。
答案:(1)用浓硫酸吸收水蒸气、称量碱石灰吸收CO2前后的质量;(2)3、1、3。
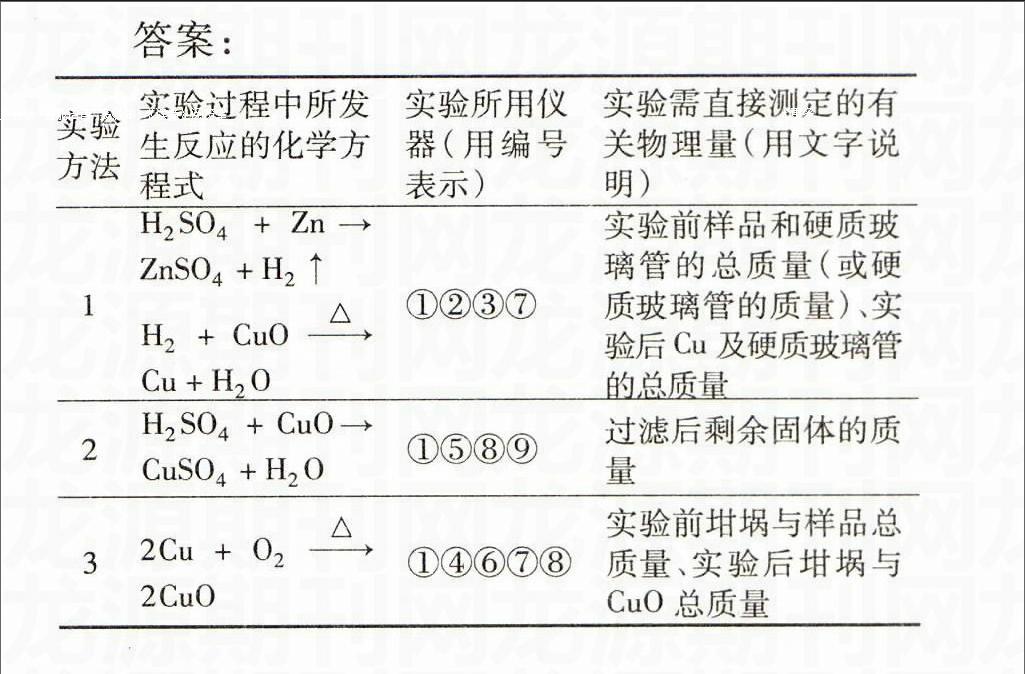
例7(2003年)实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m g)中氧化铜质量分数的方法,并填写表格中的有关内容。
实验方法实验过程中所发生反应的化学方程式实验所用仪器(用编号表示)实验需直接测定的有关物理量(用文字说明)
1
2
实验可能用到的主要仪器:
①托盘天平;②启普发生器;③硬质玻璃管;④泥三角;⑤烧杯;⑥坩埚;⑦酒精灯;⑧玻璃棒;⑨漏斗;⑩干燥管。
实验可能用到的试剂:
a.锌粒b.稀硫酸
c.氯化钠溶液 d.浓硫酸
解析金属铜和非氧化性酸不反应,但是氧化铜能和酸反应,据此获得混合物中金属铜的质量即可;金属铜在氧气中加热可以生成氧化铜,可以根据固体质量的增加来计算金属铜的质量进而计算出氧化铜的质量分数;还可以用氢气还原氧化铜,根据反应前后固体质量的差值可计算出氧化铜的质量。
答案:
实验方法实验过程中所发生反应的化学方程式实验所用仪器(用编号表示)实验需直接测定的有关物理量(用文字说明)
1H2SO4+Zn→ZnSO4+H2↑
H2+CuO△Cu+H2O①②③⑦实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量)、实验后Cu及硬质玻璃管的总质量
2H2SO4+CuO→CuSO4+H2O①⑤⑧⑨过滤后剩余固体的质量
32Cu+O2△2CuO①④⑥⑦⑧实验前坩埚与样品总质量、实验后坩埚与CuO总质量
四、考查实验仪器连接和实验操作的方案设计
实验仪器的连接和实验操作的方案设计是化学实验的基础内容,是构成实验综合大题的内核,涉及的内容有:常见反应装置的选择、干燥或除杂装置的选择、量气装置的选择、防倒吸装置、仪器连接的顺序、实验操作的顺序、气密性检查等。
例8(2010年上海)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重。
(1)为了将石蜡和碳酸钙溶出,应选用的试剂是 ;
a.氯化钠溶液b.稀醋酸
c.稀硫酸d.正已烷
(2)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出后溶出;
(3)上述测定实验中,连续,说明样品已经恒重。
解析根据实验步骤,为将石蜡和碳酸钙溶出,可选用稀醋酸溶出碳酸钙、正己烷溶出石蜡;由于醋酸中的乙酸也是有机物,为防止石蜡损失,可以先溶出石蜡再溶出CaCO3;称重时,当两次称量的结果相差不超过(或小于)0.001g,说明达到恒重。
答案:(1)bd;(2)石蜡、CaCO3;(3)两次称量的结果相差不超过(或小于)0.001g。
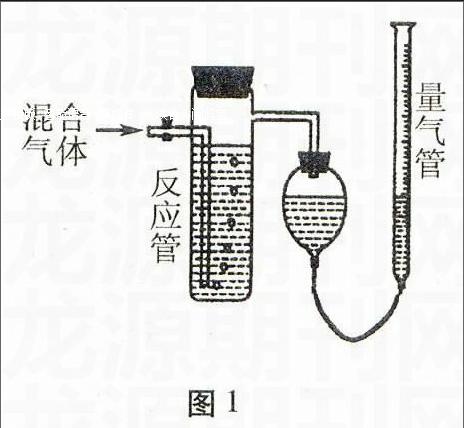
图1
例9(2003年)工业上测量SO2、N2、O2混合气体中SO2含量的装置如图1;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式);
(2)将上述装置改为简易实验装置,除导管外,还需选用的仪器为: (选下列仪器的编号)
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
解析混合气体进入反应管中,其中SO2与I2发生了反应,剩余的气体仅有N2和O2,量气管内增加的水的体积等于N2和O2的总体积;由所给装置可知反应管起密闭容器吸收SO2的作用,因此可用试管、广口瓶代替,而量取气体的体积方法除用量气管外,还可用测量气体所排出液体的体积确定,可用广口瓶、双孔塞、量筒代替量气管。
答案:N2、O2的体积;bceg或beg或ceg。
五、考查物质分离与提纯的实验方案设计
物质分离与提纯的实验操作是每年高考实验题的必考知识点,在非选择题中一般以实验大题中的某几个填空或简答的形式考查。常见的分离与提纯的方法有:过滤、蒸发结晶、冷却结晶、分液、萃取、蒸馏、减压蒸馏、减压烘干、洗气、升华、直接加热法、渗析法、纸层析法、化学蒸气转移法、控制pH选择性的除去原料中的某种或全部的杂质金属离子等,要根据题目的特点来灵活选择上述方法。
例10(2013年)镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
①Ni(s)+4CO(g)30℃Ni(CO)4(g)+Q
②Ni(CO)4(g)230℃Ni(s)+4CO(g)
简述羰基法提纯粗镍的操作过程。
解析根据反应①②的特点及生成Ni(CO)4的状态,通过化学蒸气转移法来提纯粗镍,控制不同的温度,CO相当于一个搬运工把粗镍中的镍从封闭玻璃管的一端搬运到另一端。
答案:把粗镍和CO放于一个水平放置的密闭的玻璃容器中,然后在低温下反应,一段时间后在容器的一端加热。
例11(2012年)粗盐(含Ca2+、Mg2+)经提纯后,加入碳酸氢铵可制得碳酸钠。实验步骤依次为:
①粗盐溶解;②加入试剂至沉淀完全,煮沸;③;④加入盐酸调pH;⑤加入;⑥过滤;⑦灼烧,冷却,称重。
解析粗盐提纯步骤应是向粗盐溶液中加入沉淀剂、过滤(除去沉淀),然后加入盐酸,调pH(除去前面加入沉淀剂引入的OH-与CO2-3),此时溶液为纯净的NaCl溶液,再向该溶液中加入碳酸氢铵,即可析出溶解度较小的碳酸氢钠,然后过滤、洗涤得到纯净NaHCO3,将NaHCO3加热得到Na2CO3。
答案:过滤;碳酸氢铵。
(收稿日期:2015-01-12)

