超声辅助提取红豆蛋白及其功能特性初步研究
刘立 陈学林 罗巧玲
摘要[目的]优化超声辅助法提取红豆蛋白的工艺,同时探讨红豆蛋白功能特性。[方法]采用超声辅助法提取红豆蛋白,在单因素试验基础上,选择最佳的料液比、提取pH、超声时间、温度为影响因子,以红豆蛋白提取率为响应值,确定最优的工艺条件并研究红豆蛋白功能特性。[结果] 超声辅助法提取红豆蛋白最优的工艺条件为:料液比1∶11.2 g/ml、pH 7.2、超声时间52 min、温度51 ℃,红豆蛋白提取率可达到81.20%。红豆蛋白功能特性研究表明:远离等电点及NaCl浓度为0.8 mol/L时,红豆蛋白具有良好的持水性、溶解性、乳化性及乳化稳定性;蔗糖会增加红豆蛋白的持水性,但会降低其溶解性,对乳化性和乳化稳定性影响不大;温度在60 ℃时红豆蛋白持水性、乳化性及乳化稳定性较好,在50 ℃溶解性与吸油性较好,且都随温度的进一步升高而减小。[结论] 研究可为红豆蛋白的开发利用和生产研究提供一定的理论基础和数据参考。
关键词红豆;超声法;蛋白功能特性
中图分类号S521文献标识码
A文章编号0517-6611(2015)07-302-05
Preliminary Study on the Tltrasonic-aided Extraction of Adzuki Bean Protein and Its Functional Properties
LIU Li, CHEN Xue-lin*, LUO Qiao-ling (College of Life Science, Northwest Normal University, Lanzhou, Gansu 730070)
Abstract [Objective] To optimize technique for extracting adzuki bean protein by ultrasonic assisted method, discuss functional characteristics of adzuki bean. [Method] Based on the single factor experiment, the optimal solid-liquid ratio, pH, ultrasonic time, temperature as influencing factors, extraction yield as response value, the optimal conditions were determined and functional characteristics were studied. [Result] The best combination was:solid to liquid ratio 1∶11.2 g/ml, pH 7.2, extraction time 52 min, extraction temperature 51 ℃, and the yield of adzuki bean protein reached up to 81.20%. The results of studying on functional properties of adzuki bean protein indicated that better ability of water retainmen, solubility, emulsibility and emulsion stability of adzuki bean protein were observed at pH far away from isoelectric point and concentration of NaCl at 0.8 mol/L; and along with sucrose concentration increasing, the ability of water retainmen increased, but the solubility decreased and no pronounced changes in the emulsibility and emulsion stability; ability of water retainmen, emulsibility and emulsion stability of adzuki bean protein were better at 60 ℃, solubility, oil absorption were better at 50 ℃, and all decreased following with the further increase of temperature. [Conclusion] The study can provide a certain theoretical basis and data reference for development, utilization and production of adzuki bean protein.
Key words Adzuki bean; Tltrasonic; protein fuctional properties
红豆 (Vigna angularis)又叫赤豆、小豆、红小豆等,是我国重要的豆科豇豆属植物,营养全面,富含蛋白质、膳食纤维、维生素B族等物质,含有较低的脂肪和铁、钾、磷、钙等多种矿质元素,并含有其他豆类植物含量少或者没有的三萜皂苷等成分。红豆入药有治疗水肿脚气、泻痢、痈肿、补血等药理活性[1],并为缓和的清热解毒药及利尿药。此外,红豆还能够补脾、益气、益肾、补肝和抗氧化,抑制癌细胞的增长,对糖尿病有一定的营养保健功能[2-3],开发利用前景极为广阔。目前,国内外对红豆的研究主要还集中在淀粉理化性质方面的研究[2,4]、天然色素的提取[5-6]、抗氧化的功能[7-8]及其食品开发方面[9-10],在红豆蛋白提取方面及其应用研究方面的报道相对比较缺乏[3,11]。
笔者采用超声辅助法提取红豆蛋白质,通过星点设计优化红豆蛋白的提取工艺,并对红豆蛋白的溶解性、吸油性、持水性、乳化性及乳化稳定性进行研究,旨在为红豆蛋白的开发利用和生产研究提供一定的理论基础和数据参考。
1材料与方法
1.1材料
红豆,购于甘肃省张掖市甘州区新乐超市;磷酸二氢钠、磷酸氢二钠、考马斯亮蓝G-250、牛血清白蛋白、85%浓磷酸、95%乙醇、氯化钠、蔗糖,均为国产分析纯。PL-203电子天平,722型可见分光光度计,SB120DT超声波清洗机,LNG-798A离心机,HJ-3数码恒温磁力搅拌器,DHG-9101·1型电热恒温干燥箱。
1.2方法
1.2.1标准曲线的绘制。
精确称取牛血清蛋白0.012 mg,加入0.15 g NaCl,用少量蒸馏水溶解定容至100 ml,配制120 g/ml的牛血清蛋白质标准液。准确吸取0.2、0.4、0.6、0.8、1.0 ml上述溶液用蒸馏水稀释至1.0 ml,分别加入5.0 ml考马斯亮蓝G-250溶液,在595 nm处测定其吸光值[12]。以试管中标准蛋白的总量(μg)为横坐标,相应的吸光度的值为纵坐标绘制标准曲线,并制作线性回归曲线,得到回归方程为:Y=0.005 9 X+0.024 5,R2=0.993 9,两者之间有较显著的相关性。
1.2.2红豆蛋白提取及含量测定。
按照试验步骤称取适量粉碎的红豆粉,加入相应体积不同pH的磷酸二氢钠-磷酸氢二钠缓冲溶液,在一定的温度、时间条件下进行超声浸提,浸提液在3 000 r/min条件下离心5 min,取上清液1.0 ml加入5.0 ml考马斯亮蓝溶液测其吸光值,计算样品中的蛋白质的质量以及提取率。提取率计算公式为:
提取率(%)=样品中蛋白质质量红豆粉质量×100%
1.2.3试验设计
1.2.3.1单因素试验。
分别以提取温度、pH、料液比、提取时间为影响因素,以红豆中蛋白质含量为考核目标,确定各个因素对红豆蛋白质提取率的影响。
1.2.3.2BB试验设计与响应面分析。
在单个因素试验的基础上,对影响红豆蛋白提取率的料液比、pH、提取时间、提取温度4个因素进行BB试验设计[13],各因素设置5水平用代码-2、-1、0、1、2表示,试验因素水平见表1。
表1Box-Behnken试验因素水平
水平因素
料液比(X1)g/mlpH(X2)时间(X3)min温度(X4)℃
-21∶5.06.03030
-11∶7.56.54040
01∶10.07.05050
11∶12.57.56060
21∶15.08.07070
1.2.4红豆蛋白性质测定。
1.2.4.1
持水性能测定。
用0.1 mol/L的HCl或NaOH溶液调节0.01 mol/L的Na2HPO4溶液,将其设置为不同的pH溶液,用1.0 mol/L的NaCl溶液配制成不同浓度梯度的盐溶液;稀释50 g/L的蔗糖溶液配制成不同质量浓度的蔗糖溶液。分别取以上各溶液1.5 ml和不同温度的蒸馏水1.5 ml,加入提取出来的红豆蛋白粗品5 mg,搅拌均匀后放置20 min,使其充分的吸水,在3 000 r/min条件下离心30 min,倾出上清液,称量沉淀的质量,按以下公式计算红豆蛋白的持水性[14]:
赤豆蛋白持水性(g/g)=离心后沉淀质量-蛋白粗品质量蛋白粗品质量
1.2.4.2乳化性和乳化稳定性测定。
配制不同pH、不同NaCl浓度以及不同蔗糖质量浓度的混合溶液,分别取50 mg/ml红豆蛋白粗提物,加入1 ml的大豆油,将其超声处理2 min,3 000 r/min离心5 min,按以下公式计算红豆蛋白的乳化能力[15]。
乳化性(%)=乳化层体积离心管中液体总体积×100
通过以上方法得到的混合液放置于80 ℃条件下保温30 min,然后将其冷却至室温,用30 000 r /min离心5 min,取出后测量乳化层的体积。乳化稳定性计算公式为:
乳化稳定性(%)=乳化层剩余体积乳化层初体积×100
1.2.4.3吸油性测定。取红豆蛋白粗体物5 mg,加入1.5 ml大豆油将其搅拌均匀,在不同的温度下静置30 min,之后再3 000 r/min离心15 min,去除游离油,按照以下公式计算红豆蛋白的吸油性[16]:
赤豆蛋白吸油性(g/g)=
离心后沉淀质量-蛋白粗品质量蛋白粗品质量
1.2.4.4
等电点测定。分别配制一定浓度不同pH的红豆蛋白溶液,在3 000 r/min条件下离心30 min,取上清液测定蛋白质含量,蛋白质浓度最低时的pH就是等电点[17]。
2结果与分析
2.1单因素试验
分别把提取温度、提取时间、料液比、pH作为影响因素,以红豆蛋白质含量为考察目标,确定了最佳的料液比为1∶10 g/ml,最适的pH为7,最佳提取时间为50 min,最适的提取温度为50 ℃。
2.2红豆蛋白提取工艺的优化
以红豆蛋白提取率Y作为因变量,使用Design-Expert 8.0.5.0软件对各因素(自变量)进行二次多项式拟合,得到以红豆蛋白提取率为目标函数的二次回归程为:Y=81.20+0.86X1+0.66X2+0.59X3+0.57X4+0.060X1X2+0.046X1X3-0.045X1X4-0.29X2X3-0.39X2X4-0.21X3X4-0.88X21-0.80X22-0.83X23-0.81X24。此预期模型的相关系数为R2=98.06%,模型拟合程度较为良好,说明这个方程可以较好地解释以上4个单因素对红豆蛋白提取率的影响程度。
表2CCD试验设计与结果
F失拟=4.47,P失拟=0.056 1。***差异极显著(P<0.001);**差异高度显著(P<0.01);*差异显著(P<0.05)[18] 。
由此能够看出,模型的显著性水平小于0.001,此时的回归方差模型是极显著,这个方程和实际情况的拟合很好,很好地反映出了红豆蛋白提取率和温度、料液比、pH、超声时间的关系。在选取的各因素的水平范围以内,根据对红豆蛋白提取率影响程度排序,得:X1>X2>X3>X4,即料液比>pH>提取时间>提取温度。
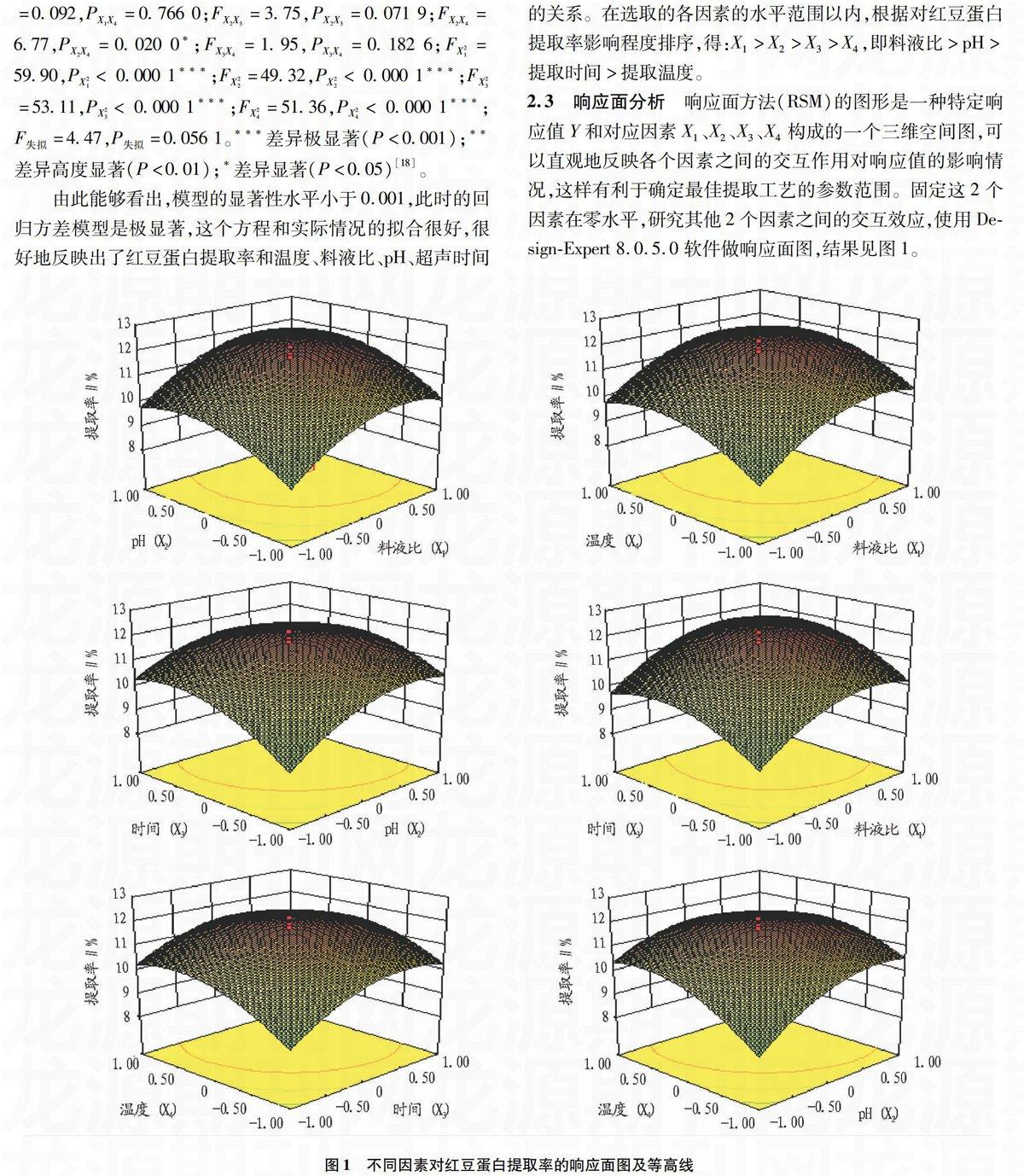
2.3响应面分析
响应面方法(RSM)的图形是一种特定响应值Y和对应因素X1、X2、X3、X4构成的一个三维空间图,可以直观地反映各个因素之间的交互作用对响应值的影响情况,这样有利于确定最佳提取工艺的参数范围。固定这2个因素在零水平,研究其他2个因素之间的交互效应,使用Design-Expert 8.0.5.0软件做响应面图,结果见图1。
图1不同因素对红豆蛋白提取率的响应面图及等高线
安徽农业科学2015年
2.4优化试验验证
按照CCD优化的试验结果,确定的最佳提取工艺条件为料液比1∶11.2 g/ml、pH为7.2、超声时间为52 min、温度为51 ℃,在优化的提取工艺条件下提取3次求取平均值,和最佳提取工艺条件下模拟结果进行了比较。结果显示,预测值为82.145 5%,实测值为81.20%,偏差率为0.255%。实测值与预测值之间的偏差率相对较小,说明验证试验的预测值和实测值之间相吻合,星点设计-响应面优化试验有较好的预测效果。
2.5红豆蛋白特性测定
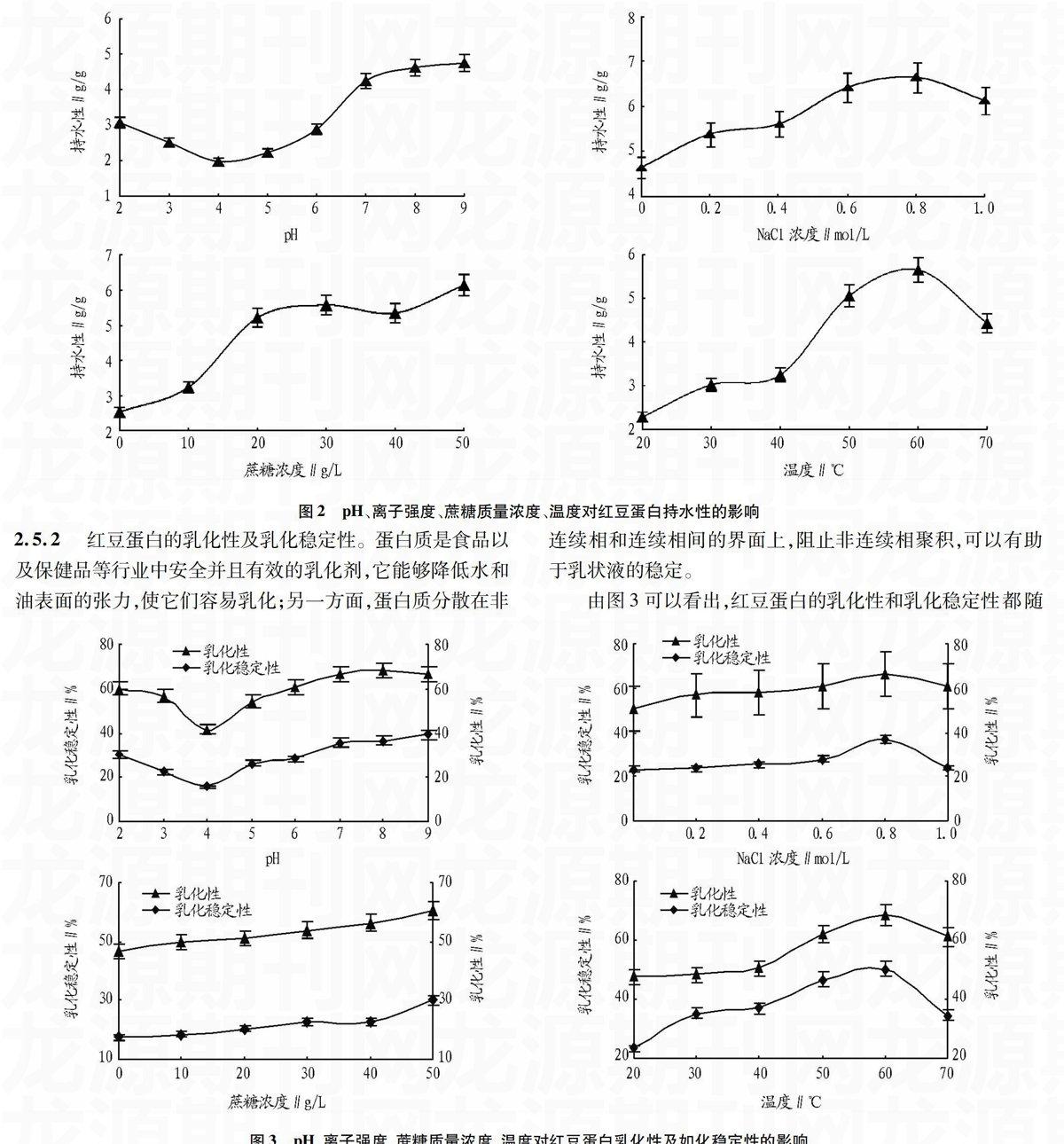
2.5.1持水性测定。
图2表明,红豆蛋白的持水性受到温度、离子强度、pH和蔗糖质量浓度的影响较为明显。当pH等于4时,红豆蛋白持水性降到最低,说明此时正处在红豆蛋白的等电点附近,蛋白质处于兼性离子的状态,其带的净电荷为零,蛋白质分子分散程度比较低,水化能力较小,因此持水性表现的最低。反之,离红豆蛋白的等电点越远,蛋白质所带的净电荷越多,蛋白质分子的静电斥力就会增加、分散程度也越高,水化能力和持水性就会越强。在NaCl浓度为0~0.8 mol/L的范围以内,红豆蛋白的持水性随着NaCl浓度的增大而增大,NaCl浓度为0.8 mol/L时达到了最大,原因是由于发生了“盐溶”现象,使蛋白质带的电荷增多,蛋白质的水化能力增强,持水性增加了;但是大于0.8 mol/L时则表现出下降趋势,可能是发生了盐析沉淀造成的。由于盐类解离出的离子与水分子的结合,降低了蛋白质水合作用,从而降低蛋白质的持水性。蔗糖质量浓度在0~50 g/L的范围内,红豆蛋白持水性一样表现出随着蔗糖质量浓度增大而增大,这可能是因为蔗糖分子中有大量的羟基能够吸引和保持水分,增加了红豆蛋白持水性。在60 ℃以下时,红豆蛋白持水性会随着温度升高而增加,这是由于温度增加把原本结构致密的蛋白质变性,其构象发生了改变,蛋白质分子解离和伸展以及适当升温都有助于蛋白质分子与水分子相互作用;但是随着温度进一步的升高,蛋白质变性,分子内部的非极性基团大量暴露于外围,使得蛋白质持水性下降。
图2pH、离子强度、蔗糖质量浓度、温度对红豆蛋白持水性的影响
2.5.2 红豆蛋白的乳化性及乳化稳定性。
蛋白质是食品以及保健品等行业中安全并且有效的乳化剂,它能够降低水和油表面的张力,使它们容易乳化;另一方面,蛋白质分散在非连续相和连续相间的界面上,阻止非连续相聚积,可以有助于乳状液的稳定。
由图3可以看出,红豆蛋白的乳化性和乳化稳定性都随
图3pH、离子强度、蔗糖质量浓度、温度对红豆蛋白乳化性及如化稳定性的影响
着pH和离子强度的变化趋势和溶解度曲线保持一致,这可能是由于蛋白质乳化性与稳定性和蛋白质溶解度呈正相关造成的,当远离红豆蛋白等电点和“盐溶”作用的影响,蛋白质溶解度比较强,蛋白质间的排斥力会增强,油滴更容易吸附到蛋白质的界面上[19]。可溶性蛋白质能扩散并且吸附到油—水界面是决定蛋白质乳化性质最重要的因素之一。当pH大于7、NaCl浓度大于0.8 mol/L时,红豆蛋白的乳化性与乳化稳定性出现下降趋势,这是由于蛋白质溶解度进一步增加引起的,可使胶体水化层变薄,蛋白质发生凝聚,降低了乳化性和乳化稳定性,同时溶解度较低时,没有溶解的蛋白质颗粒对乳状液的稳定起到了重要的作用[20]。蔗糖可以增加红豆蛋白的乳化性和乳化稳定性,随着蔗糖质量浓度的增大而有小的增加幅度,这是因为蛋白质通过在油滴界面形成了一层薄膜而产生立体阻碍效应以达到稳定乳状液,添加蔗糖改变了水相介质的流变特性,升高了体系黏稠度,并和蛋白质发生交互作用使得乳状液稳定[21]。红豆蛋白乳化性随着温度的变化趋势和其温度—溶解度曲线相吻合,这可以证明可溶性是蛋白质有乳化性质的先决条件,只有蛋白质具有一定的溶解度,才能有效地向油-水界面扩散。随着温度的升高,红豆蛋白乳化性和乳化稳定性表现出先上升后降低的趋势,在60 ℃时表现出最大的乳化性和乳化稳定性,这是因为适度加热处理会使蛋白质分子伸展、溶解度增加,蛋白质之间排斥力的减小,会使油滴容易吸附到蛋白质界面上,促进蛋白的乳化能力;可是温度过高会降低吸附到界面上蛋白质膜的黏度和硬度,因此乳化性和乳化稳定性会有所降低[19]。
2.5.3吸油性测定。
蛋白质的吸油性是指蛋白质和游离油脂互相的结合能力。对于食品风味,蛋白质吸油性是一项重要的功能特性,能够提高食品对于脂肪的吸收和保留能力,减少脂肪在加工中的损失,从而提高食品的适口性和风。
图4表明,红豆蛋白的吸油性会随着温度升高而下降,原因可能是随着温度的升高,蛋白质分子渐渐解离和伸展以致变性,肽链伸展后会和高温处理后发生氧化的油的中小分子产生作用[19]。
图4温度对红豆蛋白吸油性的影响
2.5.4等电点测定。
在蛋白质的分子中,尽管各个氨基酸间是通过肽键连接的,但是其分子依旧有很多可以解离的基团,如氨基、酚羟基、羧基、咪唑基等,因而蛋白质为两性电解质。调节溶液的pH,当蛋白质分子中带有的正电荷数量和负电荷数量相等,因此静电荷为零,在电场中不移动,此时溶液pH就是该蛋白质的等电点。
由图5可知,pH等于3.6时,溶液中红豆蛋白聚集沉淀,蛋白质含量达到最低,此时蛋白质分子中带有的正电荷数量和负电荷数量相等,静电荷等于零,即等电点是3.6。
图5pH与红豆蛋白浓度的关系
3结论
在单因素试验处理的基础上,通过CCD组合交错试验,得到超声波辅助提取红豆蛋白最佳工艺条件为:料液比为1∶11.2 g/ml、pH为7.2、超声时间为52 min、温度为51 ℃,提取率达81.20%。
当pH在等电点附近时,红豆蛋白具有很好的持水性、乳化性和乳化稳定性。NaCl溶液的浓度在0~0.8 mol/L范围内时,红豆蛋白溶解性和持水性、乳化稳定性和乳化性与NaCl浓度的增加呈正相关,并且随着盐浓度增加而呈现下降趋势。
加入蔗糖会增加红豆蛋白的持水性,溶解性先下降后升高,在37 g/L时为最低,乳化性和乳化稳定性随着蔗糖浓度增大而稍有增加,但是增加幅度并不大。温度在20~60 ℃范围以内时,红豆蛋白持水性和乳化性以及乳化稳定性会随着温度升高而增大,在60 ℃时达到最大值;溶解性和吸油性在50 ℃时达到最大值,并且随温度的进一步升高均表现出下降趋势。
参考文献
[1]
梁丽雅, 闫师杰.红豆的加工利用现状[J].粮油加工与食品机械, 2004(3): 68-69.
[2] 杜双奎, 于修烛, 问小强, 等.红豆淀粉理化性质研究[J].食品科学, 2007(12): 92-95.
[3] 娜仁图雅, 李正英, 李艳梅, 等.红小豆蛋白质提取工艺的优化[J].农业机械学报, 2012(20): 112-114.
[4] 任顺城, 李翠翠, 李想, 等.赤豆、刀豆、芸豆淀粉性质的比较[J].食品研究与开发, 2011, 32(11): 36-39.
[5] 王海棠, 张玉清, 马向东, 等.红豆红色素的性质研究[J].郑州工程学院学报, 2001, 22(4): 54-57.
[6] 李洋, 韩小贤, 成军虎, 等.基于正交试验法优化红小豆色素提取条件研究[J].农产品加工, 2011(7): 23-25.
[7] 楼宜嘉, 王志强.红豆总黄酮提取物及其应用:中国,10023263.5[P].2005.
[8] 周威, 王璐.小粒黑大豆和红小豆提取物的体外抗氧化活性研究[J].食品科技, 2008(9): 144-148.
[9] 陈秀霞, 张斌, 蒲海燕.赤豆速溶饮品工艺探讨[J].饮料工业, 2010, 13(6): 19-21.
[10] 王占东, 杨郁荭, 郭静, 等.红豆牛奶的研制[J].现代食品科技, 2011(8): 998-1000.
[11] 扶庆权, 张李阳, 徐鉴.微波辅助提取红蛋白的工艺研究[J].食品工业, 2012(2): 71-73.
[12] 刘叶青.生物分离工程实验[M].北京: 高等教育出版社, 2007: 81-82.