植物乳杆菌BS22 对黄曲霉毒素B1 的吸附效果 及对肉鸡消化道菌群的影响
张艳,曾东,倪学勤∗,王剑,曾燕,简平
(1.四川农业大学动物医学院动物微生态研究中心,四川 成都 611130;2.动物疫病与人类健康四川省重点实验室,四川 成都 611130)
黄曲霉毒素(AF)是一类主要由黄曲霉菌、寄生曲霉菌、特异曲霉和假溜曲霉等产生的次级代谢产物,具有极强毒性,其中,以黄曲霉毒素B1(AFB1)的毒性最强。黄曲霉毒素主要污染玉米、花生、坚果等农作物及其制品[1]。目前,肉鸡感染黄曲霉毒素的检测指标主要有生长性能指标、血清生化指标、组织器官毒素残留指标等。1975年,Larsen 等[2]研究指出,经AFB1处理后的仓鼠生长缓慢,并表现出AFB1毒性症状,肠道细菌数量下降。何明清等[3]指出,AFB11可抑制正常菌群的生长繁殖,引起机体菌群变化,在临床上表现出一系列慢性中毒症状。
饲料中的黄曲霉毒素可经碱处理、氧化处理、生物降解等多种方法去毒。近些年,生物降解法成了研究的热点,许多微生物,包括细菌、酵母菌等都能吸附霉菌毒素。乳酸菌对AFB1吸附作用的研究始于1995年。目前,澳大利亚、日本和瑞典等国家开展这方面的研究较多。有研究[4]证明,乳酸菌属的许多菌株都具有吸附黄曲霉毒素的作用。马静等[5]研究发现,乳酸杆菌可以减少人体肠道对黄曲霉毒素的吸收,增加毒素排泄。Lahtinen 等[6]证实,鼠李糖乳杆菌菌株GG(L. rhamnosus GG)能以物理结合方式除去培养介质中的AFB1。笔者在含有50μg 黄曲霉毒素B1的饲料中加入不同含量的植物乳杆菌BS22,以研究BS22 对AFB1的吸附效果,并用含有AFB1和BS22 的饲料饲喂肉鸡,采用PCR–DGGE 分析AFB1对肉鸡肠道不同部位内容物和黏膜中菌群的影响,探讨BS22 对黄曲霉毒素的解毒作用及其对肉鸡肠道菌群的调节作用,现将结果报道如下。
1 材料和方法
1.1 材料
供试AFB1含量大于99%,购自北京华安麦科有限责任公司;植物乳杆菌BS22 由四川农业大学动物微生态研究中心提供, 保贮编号为CCTCC:M2013010,活菌数为1.0×108CFU/mL。
试验动物为1日龄健康艾维茵肉鸡120 羽,体重45g 左右,购于温江正大畜禽有限责任公司。基础日粮采用玉米–豆粕型饲料,日粮组成及营养水平见表1。

表1 试验基础日粮组成及营养水平 Table 1 Composition of basal diets and nutrient levels
1.2 基础饲料添加BS22 对AFB1 的吸附试验(体外试验)
试验设A、B、C、D、E 5个组,试验设计见表2。

表2 饲料添加BS22 试验设计 Table 2 Experimental design of BS22 addition in feedstuff
分别于第0、15、30天时各采1次样,每次混匀后采样20g,放入样品袋,编号,置于–20℃冰箱保存。采用酶联免疫吸附试验(ELISA)法测定不同时期饲料中AFB1的含量。检测方法和具体操作步骤按照深圳绿诗源生物技术有限公司AFB1检测ELISA 试剂盒说明书进行。
1.3 肉鸡饲养试验
选用1日龄健康艾维茵肉鸡120 羽,随机分为3个组,每组4个重复,每个重复10 羽。3个组之间初始体重差异无统计学意义(P>0.05)。试验期为28 d。I组(对照组),饲喂基础日粮;II组,在基础日粮中添加50 µg/kg AFB1;III组,在1 kg 基础日粮中加 50 µg AFB1和 0.1%植物乳杆菌 BS22 (1×108CFU/g)。试验鸡采用2 层笼养,自由饮水和采食,24 h 光照。
1.4 消化道各部位内容物、黏膜采集及粪样AFB1检测
试验第28天采集供试鸡的粪便,之后随机从各组取肉鸡5 只宰杀,采集消化道不同部位(嗉囊、腺胃、十二指肠、空肠、回肠和盲肠)内容物,并将5 只鸡相同部位的内容物混合均匀,分装至2mL离心管。同时采用无菌操作方法,在冰上用解剖刀将消化道黏膜刮下,置于装有生理盐水的离心管,振荡均匀后各吸取5 只鸡的混悬液200 µL 混合,分装至2mL 离心管,–80℃保存。收集的粪样按1.2 中的方法检测ABF1含量。
参照文献[7]提取细菌总DNA,用核酸浓度测定仪测定总DNA 浓度。
1.5 基因组总DNA 16S rDNA V3 区扩增
参照文献[8]中大肠杆菌16S rRNA基因V3片段(339 ~539 bp)设计引物:上游引物ACTCCTACGGGAGGCAGCAGT–3';下 游 引 物5'–GTAT TACCGCGGCTGCTGGCAC–3'。PCR 反应体系(25 µL):上、下游引物(10 pmol/µL)各1.0 µL,2×Taq Master Mix 12.5 µL,总DNA(模板)1.0~2.0 µL,用双蒸水补至25 µL,同时设阴性对照管。PCR扩增程序为:94℃预变性4min;94℃变性30 s,58℃退火30 s,72℃延伸2min,30个循环;最后72℃延伸10min。用1.0%琼脂糖凝胶电泳检测PCR产物片段大小和浓度。
1.6 PCR–DGGE 分析
PCR–DGGE 分析参照文献[9]进行。凝胶电泳梯度为35%~65%(100%的变性剂包括7 mol/L尿素和40%甲酰胺),变性方向与电泳方向一致。采用l×TAE 作电泳缓冲液,100 V、60℃电泳14~16 h,结果经硝酸银染色后用凝胶成像系统扫描图像。
1.7 割胶回收共性和特异性条带并克隆和测序
将DGGE 图谱上的共性和特异性条带分别割胶回收并浸泡在100 µL 加有0.1%Triton X–100 的缓冲液中,4℃过夜,取l µL 作为模板,按1.5 中方法再次扩增16S rDNA V3区,扩增产物进行DGGE 电泳,确认回收片段的正确性。重复该过程,直至在DGGE 图谱上得到单一的特定条带为止。取l µL 回收纯化的DNA 为模板,采用1.5 中方法扩增V3区,不同的是使用不带GC 发夹的引物,PCR 产物用于下一步克隆。
采用pMD19–T 载体试剂盒,参照使用手册对模板PCR 产物进行连接,再将其转入大肠杆菌DH5α 感受态细胞中,涂布含氨苄青霉素的营养琼脂平板,每条带选取1~3个阳性克隆送英潍捷基(上海)生物技术有限公司测序。应用Chromas 2 软件对测定序列进行编辑,非嵌合体序列在GenBank数据库中进行比对分析,寻找亲缘关系最近的细菌并克隆。
1.8 数据分析
将DGGE 图谱数字化、标准化后得到1个记录DGGE 胶中条带迁移位置的数字化矩阵,将矩阵导入SPSS19 软件和Quantity One 软件进行聚类分析。
2 结果与分析
2.1 饲料中添加BS22 对AFB1 含量的影响
由表3 可见,A组AFB1的含量极低,B组AFB1的含量与加入量相近。加入植物乳杆菌BS22 后,饲料中的AFB1含量显著下降(P<0.05),且随着加入的植物乳杆菌活菌量的增加,饲料中AFB1的含量逐渐下降。同一添加量处理,随饲料储存时间的增加,B、C、D、E组ABF1含量均略有上升。
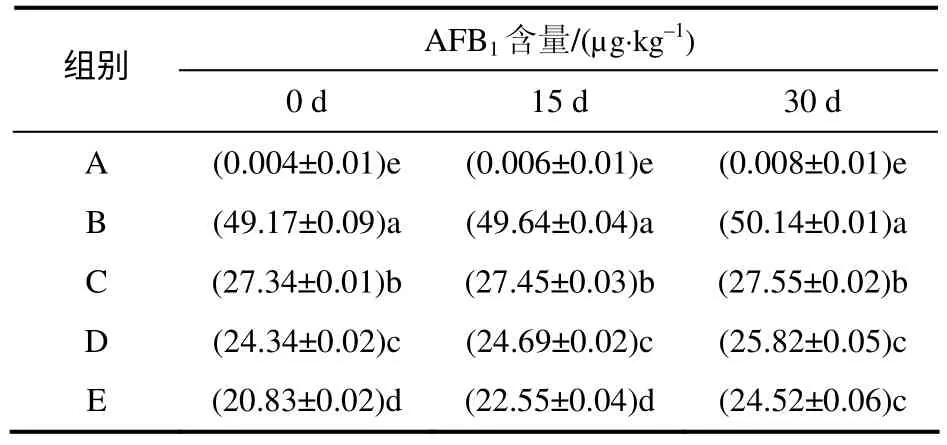
表3 饲料中AFB1 的含量 Table 3 The content of AFB1 in feedstuff

图1 消化道内容物细菌16S rDNA V3区基因片段的PCR–DGGE图谱和聚类结果 Fig.1 PCR–DGGE profiles and clustering results of 16S rDNA in V3 region from microbiota ingut content
2.2 饲料中添加BS22 对肉鸡粪便中AFB1 含量的影响
I组(对照组)肉鸡粪便中AFB1的残留量为(0.579±0.025) µg/kg,II组(黄曲霉毒素组)肉鸡粪便中AFB1的残留量为(0.937±0.048) µg/kg,II组AFB1的残留量显著高于I组,而加入植物乳杆菌BS22 后,III组AFB1的残留量为(1.587±0.055) µg/kg,显著高于黄曲霉毒素组和对照组。上述结果表明,植物乳杆菌BS22 对AFB1有吸附作用,使得蓄积在动物体内的AFB1含量减少,而排出体外的AFB1含量增加。
2.3 消化道内容物细菌16S rDNA V3 区基因片段的PCR–DGGE 图谱和多样性分析
图1–a、b显示,不同部位内容物的细菌组成不一样,其中盲肠中的细菌种类最丰富。对消化道内容物而言,除回肠外,其他部位III组的细菌多样性指数、均匀度和丰富度均高于II组和对照组(表4)。由图1– a、b聚类结果可知,除腺胃和盲肠外,II组与对照(I)组聚在一起,III组单独存在;II组与对照组(I组)的最高相似性为87%,最低相似性为66%,而III组与对照组(I组)的最高相似性为79%,最低相似性为55%。
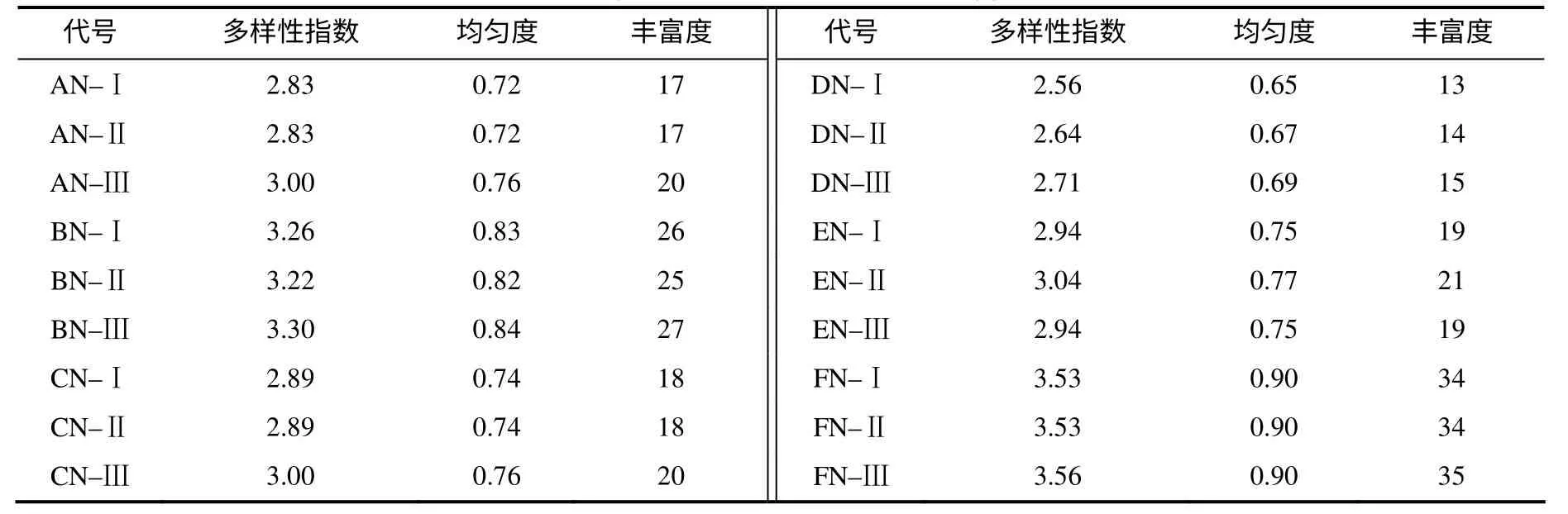
表4 消化道内容物的细菌多样性指数、均匀度和丰富度 Table 4 Shannon–Wiener index (H'), evenness (EH) and richness (S) of microbiota ingut contents
2.4 肉鸡消化道黏膜细菌16S rDNA V3 区基因片段的PCR–DGGE 图谱和多样性分析
消化道黏膜细菌16S rDNA V3 区基因片段的PCR–DGGE 图谱见图2。除空肠和盲肠外,其他部位II组的黏膜细菌多样性指数和丰富度均高于III组和对照组(I),且III组和I组的多样性指数相近或相同(表5)。由图2–a、b 可以看出,不同部位黏膜的DGGE 图谱条带数有差异,盲肠依然菌群最丰富。由图2–a、b 聚类结果可看出,III组与对照组(I组)大部分聚在一起,而II组单独存在;III组与对照组的最高相似性为94%,最低相似性为62%,而II组与对照组的最高相似性为92%,最低相似性为63%。
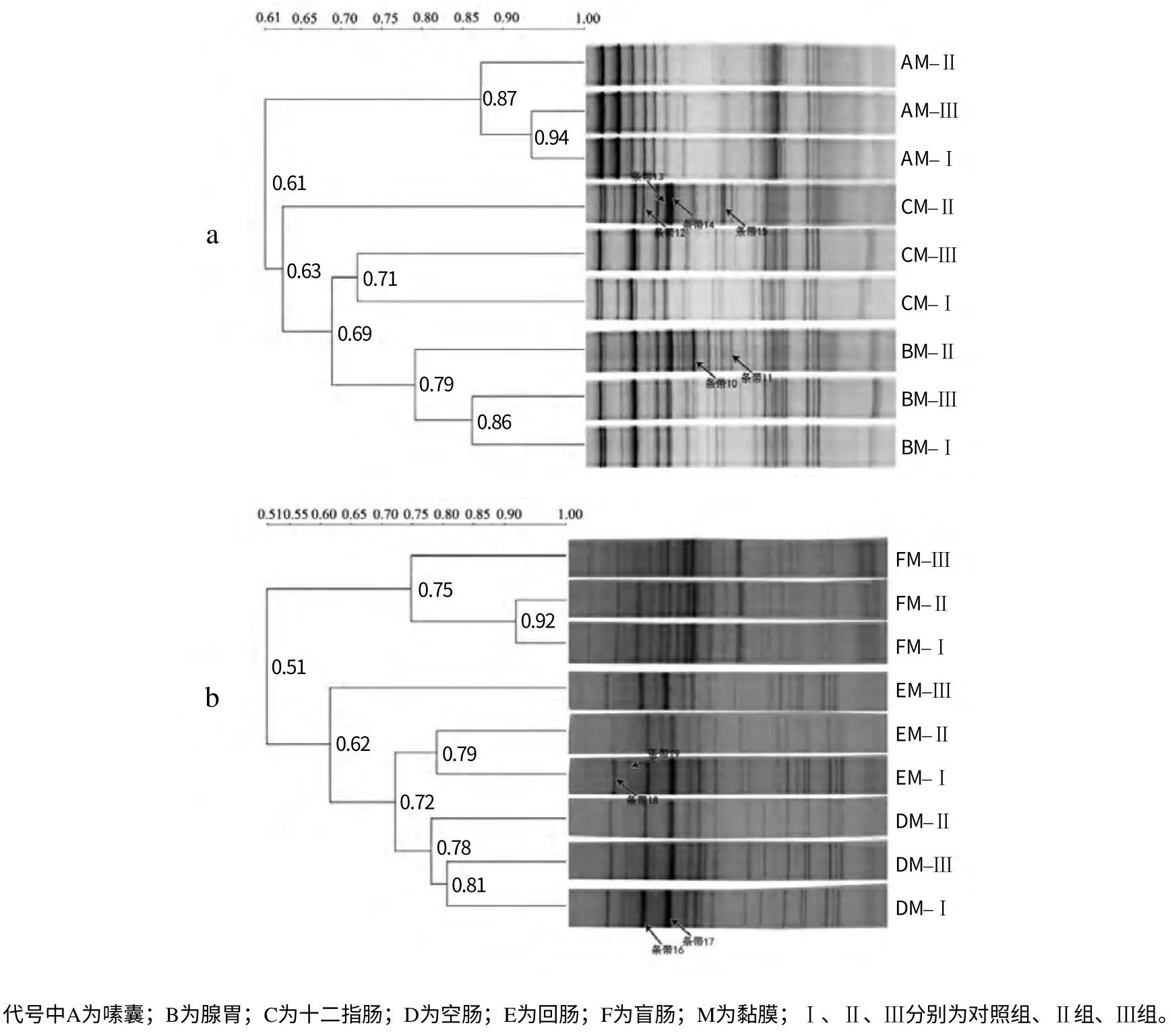
图2 消化道黏膜细菌16S rDNA V3区基因片段的PCR–DGGE图谱和聚类结果 Fig.2 PCR–DGGE profiles and clustering results of 16S rDNA in V3 region from microbiota ingut mucosa

表 5 消化道黏膜细菌的多样性指数、均匀度和丰富度 Table 5 Shannon–Wiener index (H'), Evenness (EH) and Richness (S) of microbiota ingut mucosa
2.5 消化道各部位内容物及黏膜的共性和特异性菌群分析
在DGGE 图谱上共割胶回收19 条带,其中有11 条共性条带和8 条特异性条带(图l、图2 中箭头所指)。克隆测序后,在GenBank 数据库中进行序列比对分析,找出了最相近的菌种(表6)。7个共性条带为优势菌群,分别为卷曲乳杆菌(Lactobacillus crispatus)、唾液乳杆菌(Lactobacillus salivarius)、嗜酸乳杆菌(Lactobacillus acidophilus)、巴氏链球菌(Streptococcus pasteurianus) 、 食 淀 粉 乳 杆 菌(Lactobacillus amylovorus) 和 瑞 士 乳 杆 菌(Lactobacillus helveticus)。条带1 和条带7 分别是对照组肉鸡腺胃和空肠内容物的特异条带,为未培养细菌;条带10 和条带11 为II组腺胃黏膜的特异性条带,分别为未培养细菌和未培养的柔嫩梭菌属(Uncultured Faecalibacterium sp.);条带12、14 和15 是II组十二指肠的特异条带,其中条带12 为梭菌属(Clostridium sp.),条带14 为未培养的毛螺旋菌科(Uncultured Lachnospiraceae bacterium)。条带17和19 是对照组和III组特有的条带,分别是不动杆菌属(Acinetobacter sp.)和拟杆菌(Bacteroidetes bacterium)。

表6 DGGE共性条带和特异性条带的基因片段序列的BLAST分析 Table 6 BLAST analysis ofgenomic sequences in common bands and special bands in DGGE
3 结论与讨论
Gong 等[10]曾提出5个以上的个体样品混合才能代表整体的菌群组成。为减少个体差异对试验结果的影响,本试验中采取5 只鸡相同部位的内容物混合后提总DNA,在减少样本数量的同时,保证了试验结果不受个体差异的影响。对消化道内容物菌群而言,聚类结果是大部分肠段II组与对照组聚在一起,表明AFB1对内容物菌群的作用不明显。目前,有关毒素对肠道微生物种群及发酵影响的数据仍缺乏[11]。Sutic 等[12]研究指出,植物乳杆菌、干酪乳杆菌等可在AFB1的影响下利用葡萄糖等发酵产气,但也未得到任何有意义的证据可证明AFB1对肠道菌群多样性产生了影响。关于AFB1直接对黏膜菌群影响的研究目前尚少见报道,但其可引起黏膜损伤,间接影响肠道菌群结构。Agag 等[13]和Ul–Hassan 等[14]分别证明AFB1可抑制机体自身的免疫力,导致寄生细菌和病毒感染宿主。本试验结果显示,除腺胃外,其他部位II组的菌群多样性指数均高于对照组,可能是AFB1损伤黏膜组织,降低了肠道免疫功能,导致一些病原菌和寄生细菌的入侵,从而使黏膜细菌多样性增加。Aboutalebi 等[15]研究指出,AFB1可引起十二指肠肠绒毛增生和黏膜的损伤。Fernandez 等[16]研究了 AFB1对羔羊回肠黏膜免疫分子细胞数量的影响,结果证明AFB1使回肠黏膜上的SIgA 细胞数量明显减少。SIgA 是黏膜的主要免疫分子[17–18],SIgA 的减少使回肠黏膜免疫系统受到损伤。Ramos 等[19]研究了AFB1在大鼠的小肠部位吸收的机制,结果表明AFB1高速通过小肠,几乎可全部被肠道吸收,尤其在十二指肠的吸收效果最明显。本试验结果显示,II组与对照组十二指肠段黏膜的菌群相似性相当低,仅为63%,说明AFB1基本在十二指肠被吸收,并对黏膜菌群多样性造成了较大的影响,故AFB1组(II组)与对照组的细菌多样性存在较大差异。
本研究结果表明,III组大多数肠段内容物的细菌多样性指数高于对照组和II组, III组消化道各部位黏膜细菌多样性指数和对照组的值相同或相近,说明饲喂植物乳杆菌BS22 可增加肉鸡肠道微生物的数量和多样性,这与郭元晟[20]的研究结果相似。El–Nezami 等[21]的研究证明了乳酸杆菌和丙酸菌属可去除鸡十二指肠的AFB1,并能在一定程度上改善由于AFB1引起的黏膜损伤,从而调整黏膜菌群趋于正常。
消化道内容物不同部位条带测序得到的优势菌群主要是乳杆菌,如唾液乳杆菌、嗜酸乳杆菌,该结果与潘康成等[24]的研究结果相似。对照组腺胃和空肠段特异条带是未培养的微生物,而II组和III组在各肠段均无特异性条带,进一步说明AFB1对肠道内容物菌群无明显影响。黏膜各肠段测序结果显示, II组有较多的特异条带。有研究报道AFB1让机体肠道组织中毒的机制包括抑制氧的产生[25]、抑制氧自由基[26]等,造成机体内环境处于厌氧状态。本研究中II组的特异性条带12 和14 分别是梭菌属(Clostridium sp.)和未培养毛螺菌科(Uncultured Lachnospiraceae bacterium),前者是专性厌氧菌,后者是严格厌氧菌,表明AFB1可能如上述文献报道,抑制了黏膜组织上氧的产生,使机体处于厌氧或严重厌氧状态,从而使未培养毛螺菌科(Uncultured Lachnospiraceae bacterium)能在黏膜上定植,改变黏膜菌群结构。
综上所述,AFB1对肉鸡肠道内容物菌群结构的作用不明显,但其可引起黏膜损伤,从而导致黏膜菌群结构发生改变。添加植物乳杆菌BS22 对AFB1引起的肠道黏膜菌群失调具有调节作用。
[1] Gourama H,Bullerman L B.Inhibition ofgrowth and aflatoxin production of Aspergillus flavus by Lactoba- cillus species[J].Jounal of Food Protection,1995,58(11):1249–1256.
[2] Larsen A B,Cysewski S J,Miller J M.Effect of aflatoxin on susceptibility of hamsters to mycobacterium paratuberculosis[J].American Journal of Veterinary Research,1975,36(10):1545–1547.
[3] 何明清,程安春.动物微生态学[M].成都:四川科学技术出版社,2004.
[4] 关舒,胡新旭,马秋刚,等.黄曲霉毒素的传统降解方法和生物降解研究进展[J].饲料工业,2008,29(24):57–59.
[5] 马静,拳惠莲,唐志红,等.乳酸杆菌对人体肠道黄曲霉毒素排泄的影响[J].广州食品工业科技,2003,19(21):23–26.
[6] Lahtinen S J,Haskard C A,Ouwehand A C,et al.Binding of aflatoxin B1to cell wall components of Lactobacillus rhamnosus strain GG[J].Food Additives and Contami- nants,2004,21(2):158–164.
[7] Li M,Gong J,Cottrill M,et al.Evaluation of QIAamp® DNA stoolmini kit for ecological studies ofgut microbiota[J].Journal of Microbiological Methods,2003,54(1):13–20.
[8] Walter J,Hertel C,Tannock G W,et al.Detection of Lactobacillu,Pediococcus,Leuconostoc and Weissella species in human feces by usinggroup-specific PCR primers and denaturinggradientgel electrophoresis[J]. Applied and Environmental Microbiology,2001,67(6):2578–2585.
[9] 倪学勤,曾东,周小秋.采用 PCR–DGGE 技术分析蛋鸡肠道细菌种群结构及多样性[J].畜牧兽医学报,2008,39(7):955–961.
[10] Gong J,Si W,Forster R J.et al.16S rRNAgene-based analysis of mucosa-associated bacterial community and phylogeny in the chickengastrointestinal tracts:From crops to ceca[J].Fems Microbiology Ecology,2007,59(1):147–157.
[11] Yunus A W,Razzazi-Fazeli E,Bohm J.Aflatoxin B1in affecting broiler’s performance , immunity , andgastrointestinal tract:A review of history and contemporary issues[J].Toxins,2011,3(6):566–590.
[12] Sutic M,Banina A.Influence of aflatoxin B1ongas production by lactic acid bacteria[J] . Journal of Environmental Pathology,Toxicology and Oncology:Official Organ of the International Society for Environmental Toxicology and Cancer,1989,10(3):149–153.
[13] Agag B I . Mycotoxins in foods and feeds :1-aflatoxins[J].Ass Univ Bull Environ Research,2004,7(1):173–205.
[14] Ul-Hassan Z,Zargham Khan M,Khan A,et al. Immunological status of the progeny of breeder hens kept on ochratoxin A (OTA)-and aflatoxin B1(AFB1)- contaminated feeds[J].Journal of Immunotoxicology,2012,9(4):381–391.
[15] Aboutalebi N,Toxic M.Effects of aflatoxin B1on duodenum tissue[J].American Journal of Science,2013,9(3S):115–117.
[16] Fernandez A,Hernandez M,Verde M T,et al.Effect of aflatoxin on performance,hematology,and clinical immunology in lambs[J].Canadian Journal of Veterinary Research-revue Canadienne de Recherche Veterinaire,2000,64(1):53–58.
[17] Peterson D A,McNulty N P,Guruge J L,et al.IgA response to symbiotic bacteria as a mediator ofgut homeostasis[J].Cell Host & Microbe,2007,2(5):328–339.
[18] Mantis N J,Rol N,Corthésy B.Secretory IgA's complex roles in immunity and mucosal homeostasis in thegut[J].Mucosal Immunology,2011,4(6):603–611.
[19] Ramos A J,Hernandez E.In situ absorption of aflatoxins in rat small intestine[J].Mycopathologia,1996,134(1):27–30.
[20] 郭元晟.乳酸杆菌对肉鸡生产性能,免疫机能及肠道菌群的影响[D].呼和浩特:内蒙古农业大学,2011.
[21] El-Nezami,Hani.Ability of Lactobacillus and Propioni bacterium strains to remove aflatoxin B1from the chicken duodenum[J].Journal of Food Protection,2000,63(4):549–552.
[22] Zuo R,Chang J,Yin Q,et al.Effect of the combined probiotics with aflatoxin B1-degrading enzyme on aflatoxin detoxification,broiler production performance and hepatic enzymegene expression[J].Food and Chem Toxicol,2013,59:470–475.
[23] Biernasiak J,Piotrowska M,Libudzisz Z.Detoxification of mycotoxins by probiotic preparation for broiler chickens[J].Mycotoxin Research,2006,22(4):230–235.
[24] 潘康成,陈正礼,崔恒敏,等.利用 ERIC–PCR 和 PCR–DGGE 技术分析喂服枯草芽孢杆菌肉鸡肠道菌群的多样性[J].动物营养学报,2010,22(4):985–991.
[25] Uwaifo O A.Reversion by vitamin K of aflatoxin B1(AFB)-induced inhibition of oxygen uptake in three AFB-susceptible bacteria[J].Toxicol Lett,1983,15(1):57–60.
[26] Atroshi F,Rizzo A,Westermarck T,et al.Effects of tamoxifen,melatonin,coenzyme Q10 and l-carnitine supplementation on bacterialgrowth in the presence of mycotoxins[J].Pharmacol Research,1998,38(4):289–295.

