谷氨酰胺对实验性结肠炎BABL/C小鼠肠黏膜的修复作用
李 力, 李弼民, 蔡 敏, 程峰涛, 王 斌, 黄 玲
(1. 同济大学附属杨浦医院消化内科,上海 200090; 2. 南昌大学第一附属医院消化内科,江西 南昌 330000)
·基础研究·
谷氨酰胺对实验性结肠炎BABL/C小鼠肠黏膜的修复作用
李 力1, 李弼民2, 蔡 敏1, 程峰涛1, 王 斌1, 黄 玲1
(1. 同济大学附属杨浦医院消化内科,上海 200090; 2. 南昌大学第一附属医院消化内科,江西 南昌 330000)
目的 探讨谷氨酰胺(Gln)对BALB/C小鼠实验性结肠炎的治疗作用及可能的机制。方法 将50只BALB/C小鼠分为正常对照组、模型对照组、5-ASA组、Gln组、Gln+5-ASA组。各实验性结肠炎组小鼠采用2,4,6-三硝基苯磺酸灌肠造模后,治疗组给予药物干预,观察疾病活动指数(disease activity index, DAI),取结肠组织行H-E染色病理组织学检查并积分,应用免疫组织化学技术检测小鼠结肠黏膜TNF-α、NF-κB、IL-10、IL-1β的表达。结果 模型组小鼠DAI评分明显升高、结肠黏膜呈明显的炎症变化,表现为急性炎症,如溃疡形成、单核细胞浸润等。结肠黏膜TNF-α、NF-κB、IL-1β的表达增多、IL-10表达减少;谷氨酰胺能减轻小鼠大肠黏膜炎症,在一定程度上起到治疗小鼠实验性结肠炎的目的,其疗效与5-ASA相当;其中谷氨酰胺联合5-ASA治疗效果最佳,与正常对照组比较差异无统计学意义。结论 谷氨酰胺可用于治疗BALB/C小鼠实验性结肠炎,其作用机制可能与促进肠黏膜细胞增殖、维护肠黏膜屏障、调节免疫功能、抑制NF-κB活化、降低TNF-α、IL-1β表达,升高IL-10的表达等有关,与5-ASA联用其治疗效果优于两者单独用药。
谷氨酰胺; 结肠炎; 细胞因子; 免疫组化; 小鼠
1 材料与方法
1.1 实验动物
BALB/C小鼠50只,体质量20g, 购自上海史莱克实验动物中心。小鼠随机均分为5组: 正常对照组、模型组、谷氨酰胺组、5-ASA组及谷氨酰胺+5-ASA组。
1.2 主要试剂
TNBS(100g/L)溶液购自德国Sigma公司,与无水乙醇配成1∶1混合液;谷氨酰胺颗粒(商品名: 舍兰),购自海南海神同洲制药有限公司,每袋1g,含99%L-Gln 0.67g。5-氨基水杨酸(商品名: 艾迪莎,进口注册证号H20040727),购自法国Ethypharm Industries公司。
NF-κB免疫组化试剂盒购自Sant Cruz公司;IL-10、IL-1β试剂盒购自武汉博士德生物工程有限公司;TNF-α免疫组化试剂盒购自北京中山生物技术有限公司。
1.3 方法
将1.5mg氯化钠经导管导入正常对照组小鼠结肠,其余4组小鼠均将1.5mg TNBS/乙醇经导管导入结肠造模。第2天起,正常对照组和模型组每日灌喂0.9%生理盐水1次,每次 0.5ml;谷氨酰胺组给予谷氨酰胺每日灌喂1次,每次0.02g;5-ASA组每日给予5-ASA溶液灌喂1次,每次0.02g;联合用药组每日上午给予5-ASA,每次0.02g,下午给予谷氨酰胺各1次,每次0.02g。10d后脱颈椎处死小鼠,各组均取部分结肠和外周血。肉眼和光镜下观察结肠黏膜的病理改变。
1.4 免疫组织化学染色
为进一步检测各分割算法的应用效果,选择油菜多次室内和户外叶片图像以及冠层图像作为研究对象,应用各类算法来分割图像,分别提取图像中感兴趣目标的颜色特征值与已测量得到的SPAD值进行相关分析,计算得到相关系数,选择无重复、相对稳定及相关性最好的19个颜色指标的相关系数,取绝对值后计算均值、中值、最大值和均方根(RMS)[8]等评价指标,结果列表(如表1所示)进行比较。
单克隆抗体TNF-α、IL-1β、IL-10、NF-κB稀释浓度分别为1∶100、1∶150、1∶50,采用S-P法检测。切片厚度为3μm,常规脱蜡至水,3%H2O2洗10~15min,蒸馏水洗5min,0.01mol/L PBS洗5min,3次,微波热修复92~98℃ 5~15min,自然冷却后PBS洗5min,3次,10%山羊血清37℃孵育10~40min,加入相应的一抗37℃孵育60min或4℃过夜,PBS洗5min,3次;1∶100生物素化二抗37℃孵育20~30min,PBS洗5min,3次;1∶100辣根过氧化物酶标记链霉卵白素37℃孵育20~30min,PBS洗 5min,3次。DAB显色,显微镜下控制显色时间。苏木精复染,脱水封片。以正常血清代替一抗作阴性对照。
1.5 一般情况及病理观察
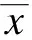
1.6 统计学处理
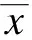
2 结 果
2.1 小鼠的一般情况
灌肠后的第1天,模型组BALB/C小鼠出现不同程度的血性腹泻、少动、身体蜷缩、食量减少、毛发无光泽、体质量下降。正常对照组小鼠则反应灵活、体质量增加、食量正常。随着谷氨酰胺给药时间的延长,从第3天起,谷氨酰胺组小鼠食量和体质量增加,无血便出现。5-ASA组小鼠出现稀便、血便,体质量及一般情况与谷氨酰组类似,联合用药组小鼠一般情况改善较为明显。
2.2 结肠病理情况
模型组小鼠病变结肠水肿,肠壁增厚明显。剪开肠壁,可见黏膜有弥漫性出血点、红斑和溃疡。镜下可见结肠黏膜上皮糜烂、溃疡及隐窝脓肿形成,杯状细胞消失,固有层中性粒细胞、淋巴细胞浸润,见图1。正常组小鼠结肠黏膜无上述病理变化。
谷氨酰胺组小鼠结肠黏膜均未见溃疡形成。病理切片未发现溃疡形成,仅示黏膜固有层内有炎性细胞如淋巴细胞、浆细胞、嗜酸性粒细胞浸润,见图2。5-ASA组小鼠结肠黏膜肉眼及光镜下的病理表现与谷氨酰组类似,联合用药组则仅见黏膜上皮内灶性淋巴细胞浸润,其他无异常发现。

图1 模型组小鼠病变结肠病理结果Fig.1 The colon pathology results in model mice group
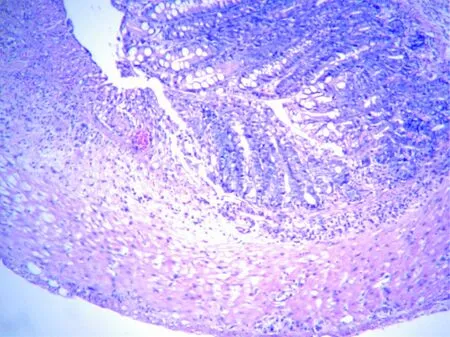
图2 谷氨酰胺组小鼠结肠病理结果Fig.2 The colon pathology results in Gln group
2.3 细胞因子的表达
与正常对照组相比,模型组小鼠结肠黏膜炎症评分及TNF、IL-1β、NF-κB水平上升,IL-10水平降低,差异均有统计学意义(P<0.05);与模型组相比,谷氨酰胺组小鼠肠黏膜炎症评分及TNF、IL-1β、NF-κB水平下降,IL-10水平上升,差异均有统计学意义(P<0.01),说明谷氨酰胺能在一定程度上起到治疗炎性肠病的作用;与模型组相比,联合用药组小鼠肠黏膜炎症评分及TNF、IL-1β、NF-κB水平下降,IL-10水平上升,差异均有统计学意义(P<0.01),说明谷氨酰胺联合5-ASA对于炎性肠病起到较好的治疗作用,见表1。

表1 各组小鼠炎症评分、结肠黏膜细胞因子和NF-κB的表达Tab.1 Comparison of TNF-α, IL-1β and NF-κB levels and disease activity index in different groups ±s)
与正常对照组相比,*P<0.01;与模型组相比,△P<0.01
3 讨 论
本实验所建立的TNBS BALB/C小鼠急性结肠炎模型具有如下特点: 小鼠经TNBS/50%酒精灌肠后出现不同程度的腹泻、血便、体质量下降等典型症状,并有肠黏膜弥漫性充血、出血,溃疡形成,腺体破坏、炎性细胞浸润等组织学改变,其病理学特征与人类炎性肠病十分相似,因而可用于探索相关治疗药物疗效的研究。
组织学损伤评分可以较好地反映结肠炎症状和组织学改变的特点和程度。本实验中,模型对照组DAI、组织学炎症评分明显高于正常对照组;5-ASA治疗组、Gln治疗组大鼠DAI、组织学炎症评分较模型对照组有所改善,但与正常对照组比较,差异仍有统计学意义。Gln+5-ASA组的DAI、组织学损伤评分及MPO活性较5-ASA治疗组、Gln治疗组改善更明显,与正常对照组比较,差异无统计学意义,说明5-ASA和Gln均具有治疗作用,且联合用药效果更佳。
炎性肠病的病因和发病机制目前尚不明确。研究[6-7]认为,其与免疫反应异常有关,尤其与局部肠黏膜免疫反应异常密切相关。研究[8-9]发现,细胞因子在肠黏膜局部的炎症和免疫反应中有重要作用,IL-1具有多种功能,主要为免疫调节和致炎作用,IL-1β是IL-1的主要活性形式,TNF-α作为一种重要的免疫介质和致炎因子,在炎症炎性反应、免疫应答的启动和持续过程中具有不可缺少的作用,是肠黏膜炎症反应的核心环节。而IL-10能抑制多种炎症因子的合成和生物活性,是一种重要的抗炎因子。IL-10可抑制抗原提呈反应以及炎症细胞因子的释放,其在炎性肠病的发病中可能发挥着重要的作用。以上这些细胞因子是由NF-κB来调控释放,因而NF-κB参与了肠道的炎症和免疫反应。研究证实,NF-κB的激活可导致TNF-α、IL-1β的转录增加,而TNF-α、IL-1β的释放又进一步激活NF-κB。后者通过正反馈进一步增加TNF-α、IL-1β的分泌,同时使其他细胞因子如IL-6、IL-8等的表达也增加。由此产生级联反应,使炎症不断放大,形成“瀑布效应”,这可以解释TNF-α、IL-1β的促炎作用。本研究发现,实验小鼠病变结肠黏膜组织NF-κB表达水平显著增高,其表达水平可作为评价病情活动性和严重性的指标之一,而抑制NF-κB的活性可有效治疗IBD。现有的IBD治疗药物如SASP、5-ASA、皮质类固醇等均直接或间接通过减少靶细胞中的IκBα来抑制NF-κB的活性,从而减少炎症细胞因子的产生,达到治疗目的[10-11]。
本实验发现,5-ASA和Gln治疗1周后,小鼠大肠黏膜NF-κB p65、TNF-α、IL-1β表达较模型对照组显著降低,但与正常对照组相比,差异仍有统计学意义,表明5-ASA和Gln可能通过抑制过度激活的NF-κB,下调促炎细胞因子的表达,提高抑炎细胞因子的表达。
肠黏膜在保护机体免受微生物的损害、保持机体内环境稳定起着重要的作用。Gln是谷胱苷肽的前体,可保护肠上皮细胞免受氧自由基损害和阻止肠黏膜细胞的凋亡。总之,Gln可作为治疗大鼠UC的药物,可能的作用机制是: 谷氨酰胺可以调节免疫功能,参与机体免疫保护,缓解肠道炎症和改善损伤黏膜的结构和功能,调节肠道免疫功能,减少细菌移位、防止细菌内毒素及毒性大分子物质进入体内等。具体则表现在通过抑制NF-κB活化,从而减少损伤性炎性因子的释放,增加保持性炎症因子释放,达到修复肠道组织、减轻结肠炎症小鼠结肠组织的损伤而起着保护作用。与5-ASA联合应用其治疗效果优于两者单独用药。因此,临床上在使用5-ASA的基础上加用该药物将有更好的疗效[2-16]。
[1] Al-Mansouri HMSH, Kawajiri A, Yamamoto S. et al. Nucleoside-nucleotide free diet protects rat colonic mucosa from damage induced by trinitrobenzene sulphonic acid[J]. Gut, 1996,39(3): 428-433.
[2] Witaicenis A, Fruet AC, Salem L, et al. Dietary polydextrose prevents inflammatory bowel disease in trinitrobenzenesulfonic acid model of rat colitis[J]. J Med Food, 2010,13(6): 1391-1396.
[3] Erbil Y, GiriM,lu SD, et al. Effect of heme oxygenase-1 induction by octreotide on TNBS-induced colitis[J]. J Gastroenterol Hepatol, 2007,22(11): 1852-1858.
[4] Evans ME, Jones DP, Ziegler TR, et al. Glutamine prevents cytokine-induced apoptosis in human colonic epithelial cells[J]. J Nutr, 2003,133(10): 3065-3071.
[5] Kretzmann NA, Fillmann H, Mauriz JL, et al. Effects of glutamine on proinflammatory gene expression and activation of nuclear factor kappa B and signal transducers and activators of transcription in TNBS-induced colitis[J]. Inflamm Bowel Dis, 2008,14(11): 1504-1513.
[6] Prakash A, Medhi B, Avti PK, et al. Effect of different doses of Manuka honey in experimentally induced inflammatory bowel disease in rats[J]. Phytother Res, 2008,22(11): 1511-1519.
[8] Bai A, Lu N, Guo Y, et al. Tanshinone IIA ameliorates trinitrobenzene sulfonic acid (TNBS)-induced murine colitis[J]. Dig Dis Sci, 2008,53(2): 421-428.
[10] Dikopoulos N, Nüssler AK, Liptay S, et al. Inhibition of nitric oxide synthesis by aminoguanidine increases intestinal damage in the acute phase of rat TNBS-colitis[J]. Eur J Clin Invest, 2001,31(3): 234-239.
[11] Peran L, Sierra S, Comalada M, et al. A comparative study of the preventative effects exerted by two probiotics, Lactobacillus reuteri and Lactobacillus fermentum, in the trinitrobenzenesulfonic acid model of rat colitis[J]. Br J Nutr, 2007,97(1): 96-103.
[12] Zhu-Fu Quan, Chong Yang, Ning Li, et al. Effect of glutamine on change in early postoperative intestinal permeability and its relation to systemic inflammatory response[J]. World J Gastroenterol, 2004,10(13): 1992-1994.
[13] San-Miguel B, Crespo I, Kretzmann NA, et al. Glutamine prevents fibrosis development in rats with colitis induced by 2,4,6-trinitrobenzene sulfonic acid[J]. J Nutr, 2010,140(6): 1065-1071.
[14] Li Z, Zhang de K, Yi WQ, et al. NF-kappaB p65 antisense oligonucleotides may serve as a novel molecular approach for the treatment of patients with ulcerative colitis[J]. Arch Med Res, 2008,39(8): 729-734.
[15] Vallejo D, Crespo I, San-Miguel B, et al. J Autophagic response in the Rabbit Hemorrhagic Disease, an animal model of virally-induced fulminant hepatic failure[J]. Vet Res, 2014,45(2): 15-18.
[16] Crespo L, San-Miguel B, Prause C, et al. Glutamine treatment attenuate endoplasmic reticulum stress and apoptosis in TNBS-induced colitis[J]. PloS One, 2012,7(11): 504-507.
Glutamine promotes intestinal mucosa repairing inexperimental mouse colitis
LILi1,LIBi-min2,CAIMin1,CHENGFeng-tao1,WANGBin1,HUANGLing1
(1. Dept. of Gastroenterology, Yangpu Hospital, Tongji University, Shanghai 200090, China;2. Dept. of Gastroenterology, First Affiliated Hospital, Nanchang University, Nanchang 330000, Jiangxi Province, China)
Objective To evaluate the therapeutic effect of glutamine in treatment of experimental colitis in mice. Methods Fifty BALB/C mice were randomly divided into 5 groups: normal control group, model group, 5-ASA group, glutamine group, and 5-ASA (Acetyl-5-aminosalicylic acid) +glutamine group. The experimental colitis was induced with 2, 4, 6-Trinitrobenzenesulfonic acid (TNBS) enema. The disease activity index (DAI) was observed and the histopathological changes of intestinal mucosa were examined with H-E staining, the expression of TNF-a, NF-κB, IL-10 and IL-1β was detected with immunohistochemical technique. Results The DAI score of model group increased significantly. Histopathological examination revealed acute inflammation, ulceration, mononuclear cell infiltration in intestinal mucosa in model mice. The expression of TNF-a, NF-κB, IL-β was increased, the expression of IL-10 was decreased. The glutamine can relieve intestine mucosa inflammation, to a certain extent, it can treat the experimental colitis mice.The curative effect is equal to 5-ASA. The therapy effect of combination of 5-ASA and glutamine group is best, and has no statistical difference compared with normal controls. Conclusion Glutamine can treat experimental colitis in mouse which may be related to promate mucosa cells growing, keep mucosa, relieve colon tissue injury in colitis by suppressing the activity of NF-κB, decrease TNF-α、IL-1β expression. The combination treatment of glutamine and 5-ASA has a better effect than either of individual treatment alone.
glutamine; colitis; cytokines; histologytis; mouse
10.16118/j.1008-0392.2015.02.003
2014-11-02
上海市卫生和计划生育委员会项目(20134424)
李 力(1969—),男,副主任医师,硕士.E-mail: lli10437@sina.com
李弼民.E-mail: lbmjx@163.com
R 574.62
A
1008-0392(2015)02-0011-05

