大孔树脂吸附法用于分离泡沫分离消泡液中银杏黄酮的工艺
焦萌,吴兆亮,刘伟
(河北工业大学化工学院,天津 300130)
大孔树脂吸附法用于分离泡沫分离消泡液中银杏黄酮的工艺
焦萌,吴兆亮,刘伟
(河北工业大学化工学院,天津 300130)
拟通过大孔树脂吸附技术分离纯化泡沫分离消泡液中的银杏黄酮.静态吸附/脱附实验结果表明,5种大孔吸附树脂中S-8型树脂为吸附分离银杏黄酮的最佳吸附剂.通过研究动态穿透曲线、脱附剂浓度及动态脱附曲线,确定了S-8型树脂动态吸附/脱附银杏黄酮的最佳操作条件:上样流速为3.0 BV/h时,进料液的最佳上样体积为65mL;以75%乙醇溶液作为脱附剂,脱附流速为1.8 BV/h时,脱附剂体积为40mL.该条件下脱附液中银杏黄酮的纯度为27.5%,且其中的SDS已被去除.HPLC-MS/MS结果表明脱附液中的银杏黄酮主要包含7种成分.S-8型树脂分离纯化银杏黄酮性质稳定,可连续使用5次后进行再生.
大孔吸附树脂;银杏黄酮;分离;纯化;泡沫分离
0 引言
银杏叶是一味重要的中药,其主要的药效成分是一系列黄酮类物质[1-2].随着植物营养素在食品、药品中的普遍应用,银杏黄酮开始受到越来越多的关注[3-4].银杏黄酮的分离提取主要是通过溶剂提取法[5].近年来,溶剂气浮法被开发用于富集银杏叶提取液中的银杏黄酮[6].银杏黄酮是一类非表面活性物质,可以通过泡沫分离技术以表面活性剂作为“捕获剂”实现银杏黄酮从水溶液中的富集[6].
在泡沫分离中,银杏黄酮随捕获剂(表面活性剂)的富集而富集,因此消泡液中银杏黄酮与表面活性剂同时存在.为了获得高纯度的银杏黄酮,有必要对消泡液中的银杏黄酮进行进一步分离.大孔树脂吸附技术是一种发展较为成熟的分离纯化技术,它因极性、分子大小等性质的不同而具有选择性吸附作用[7-8].大孔树脂作为吸附剂具有理想的孔道结构、多种表面功能基团及较易再生等优点[9].溶质分子可通过库仑力、氢键、络合及孔道筛选作用分布及积累在吸附剂的表面及内部[10].根据吸附质性质、吸附质与吸附剂间作用力的强弱,采用不同的脱附剂进行脱附,最终实现目的产物与杂质的分离.
本文以泡沫分离银杏黄酮浸提液(以十二烷基硫酸钠(SDS)作为助溶剂及捕获剂)所得的消泡液为研究体系.首先通过静态吸附/脱附实验,筛选对银杏黄酮与SDS分离效果较好的大孔吸附树脂.之后研究动态吸附/脱附过程中进料液上样流速、脱附剂浓度和脱附流速对银杏黄酮与SDS分离效果的影响并确立最佳的动态操作条件.通过液相-质谱联用技术(HPLC-MS/MS)鉴定脱附液中银杏黄酮的组成成分.最后研究所选树脂的稳定性.
1 材料与方法
1.1 实验材料
银杏叶购自天津市敬一堂药店,用前研碎并过50目筛;甲醇、乙醇、乙酸、SDS、HCl、NaOH、NaNO2、Al NO33均购自天津市登丰化学品有限公司,均为分析纯试剂;DM130树脂、AB-8树脂、ADS17树脂、HPD100树脂、D101树脂、S-8树脂均购自天津南开大学化工厂.芦丁标准品购自Sigma,用于绘制标准曲线.
1.2 实验方法
1.2.1 银杏黄酮消泡液的制备
将银杏叶粉末置于质量分数为0.2%的SDS溶液中,料液比为1∶20,于70℃下浸提3 h.浸提液于4 500 r min1下离心10 min,上清液即为泡沫分离初始原料液.以上部带有球状结构的圆柱分离塔做为实验塔[11],全塔总高为620 mm,柱形内径为40 mm,球形内径为80 mm,球心距塔底的垂直距离为475 mm.在装液体积80mL,气速流率30 mL/min条件下进行泡沫分离.收集塔顶流出的泡沫,经破泡后获得银杏黄酮消泡液(银杏黄酮浓度为1.95 mg/mL).
1.2.2 大孔吸附树脂的活化
购得的大孔吸附树脂在使用前需活化,首先用95%乙醇进行浸泡以保证大孔吸附树脂充分溶胀,之后用蒸馏水进行洗涤直至无醇味.先后在5%盐酸溶液和5%氢氧化钠溶液中分别浸泡3 h,用蒸馏水洗至中性后干燥备用.
1.2.3 静态吸附/脱附实验
取2 g活化后的大孔吸附树脂于250 mL具塞三角瓶中,加入30 mL银杏黄酮消泡液作为进料液.50℃下100 r min1水浴振荡24h后,测定残液中银杏黄酮的浓度,即可计算大孔吸附树脂的吸附率及吸附量.回收大孔吸附树脂并以蒸馏水进行清洗直至流出液澄清后,加入40 mL脱附剂于30℃下100 r min1水浴振荡24h进行脱附.测定脱附液中银杏黄酮的浓度,即可获得大孔吸附树脂的脱附率及回收率.吸附率、吸附量、脱附率和回收率为

其中:C0、Ce、C1分别为进料液、吸附平衡后残液和脱附液中银杏黄酮浓度,mg/mL;V0、V1为进料液、脱附液体积,mL;m0为树脂质量,g.
1.2.4 动态吸附/脱附实验

其中:C1、V1定义如式(3)、式(4);m1为脱附液干燥至恒重的质量,mg.
1.2.5 银杏黄酮浓度的测定
选取银杏黄酮的结构类似物芦丁为标准品,采用NaNO2-Al NO33-NaOH分光光度法测定银杏黄酮浓度[12],最大吸收波长为510nm.由实验结果获得银杏黄酮浓度的标准曲线方程为A=11.725C+0.0039,R2=0.9999,A为吸光值,C为银杏黄酮浓度(mg/mL),检测范围为0.2~4 mg/mL.
1.2.6 红外光谱分析
待测样品经冷冻干燥后,采用KBr法进行压片制样,以Vector22傅立叶红外光谱仪(德国布鲁克光谱仪器公司)测定红外光谱.红外光谱频率范围为4 000~400 cm1,所得数据通过Opus软件(德国布鲁克光谱仪器公司)进行分析.
1.2.7 HPLC-MS/MS分析
实验采用高效液相色谱-电喷雾串联质谱法(HPLC-ESI-MS/MS,Agilent 1 260,美国安捷伦科技有限公司;BrukermicrOTOFQ-Ⅱ,德国布鲁克光谱仪器公司)分析银杏黄酮成分.其中色谱柱为Bonna-AgelaC18 (L)色谱柱(250mm×4.6mm,5m,Bonna-AgelaTechnologies,China),柱温为25℃,进液量为20L,流动相A为甲醇,B为体积分数0.4%的乙酸水溶液,v A∶v B=50∶50,流速为0.45 mL/min,检测波长为356 nm.质谱离子源为ESI,检测模式为负离子模式,质量数扫描范围m/z为500~1 000.
2 结果与讨论
2.1 大孔吸附树脂的筛选
大孔吸附树脂的极性、孔径、比表面积等特性会影响其对目的物质的吸附效果[13].为此研究5种不同类型的大孔吸附树脂对银杏黄酮的静态吸附/解吸实验,从中筛选出最适宜分离纯化银杏黄酮的吸附剂.实验结果如表1所示.

表1 不同树脂对银杏黄酮吸附/脱附效果的影响Tab.1Effect of different resin on adsorption/desorption of ginkgo flavonoids
由表1可知,在5种大孔吸附树脂中,S-8型树脂对银杏黄酮的吸附效果好,吸附量和吸附率分别为24.9 mg/g和84.94%.首先,银杏黄酮具有较强的极性,因此易与强极性的S-8型树脂发生吸附作用[14].其次,S-8型树脂的平均孔径大,这有利于银杏黄酮进入大孔树脂内部从而增强吸附效率.S-8型树脂的脱附率为82.90%,略低于D101型和HPD100型树脂的脱附率,这可能是由于银杏黄酮的羟基与S-8型树脂易形成氢键,使部分银杏黄酮被束缚在S-8型树脂内.此外,以S-8型树脂作为吸附剂时,银杏黄酮的回收率最高,为70.43%.因此,S-8型树脂可选为适宜的吸附剂用以分离纯化银杏黄酮.
2.2 S-8型树脂吸附银杏黄酮的动态穿透曲线
在动态吸附过程中,流出液中银杏黄酮的浓度随着进料液的加入量的增大而不断变化.一般认为在流出液中目的物质的浓度为进料液中目的物质浓度的10%时,树脂被吸附饱和,此时的上样体积即为穿透点[15].为了确定最佳的上样体积,实验研究了S-8型树脂吸附银杏黄酮的动态穿透曲线.于室温条件下分别以1.8BV/h、3BV/h、3.6BV/h、9BV/h的上样速率加入进料液进行动态吸附,每5mL作为单位收集流出液并测定其中银杏黄酮浓度.实验结果如图1所示.
由1图知,穿透点(此时银杏黄酮浓度为0.195 mg/mL)处流出液体积随上样速率的增加而减小,在上样速率为1.8 BV/h、3.0 BV/h、3.6 BV/h、9.0 BV/h时,流出液体积分别为70 mL、65 mL、45 mL、30 mL.在进料液流经树脂柱时,银杏黄酮首先在进料液与树脂表面之间进行传质,之后在树脂内部进行扩散,最后与吸附位点结合.上样速率越大,银杏黄酮与树脂接触时间越短,此时不利于银杏黄酮的传质,银杏黄酮还未被树脂吸附就被带入到流出液中.因此,上样速率较小时银杏黄酮能够有效地与S-8型树脂发生吸附.上样速率为1.8BV/h和3.0BV/h时,穿透点处流出液体积相差不大.但在实际生产过程中,上样速率越低生产效率也随之降低.因此,S-8型树脂吸附银杏黄酮的最佳上样速率选定为3.0 BV/h,此时的最佳的上样体积为65 mL.
2.3 脱附剂浓度对银杏黄酮脱附效果的影响
脱附剂应根据吸附质性质、吸附质与吸附剂间作用力的强弱进行选择[16].为了有效地回收银杏黄酮,本文研究了不同浓度的乙醇溶液对银杏黄酮脱附效率的影响.于3 BV/h的速率条件下分别加入35%、45%、55%、65%、75%、85%、95%的乙醇溶液各100 mL进行脱附.实验结果如图2所示.
由图2知,银杏黄酮的脱附率随乙醇浓度的增加而呈现先增加后减小的趋势,当乙醇浓度为75%时,脱附率可达到76.56%.随着乙醇浓度增加,树脂溶胀增强,银杏黄酮在脱附剂中的溶解度增大,因此被脱附下来的银杏黄酮增多,脱附率变大.根据相似相溶原理,75%的乙醇溶液与银杏黄酮的极性可能最为接近,因此银杏黄酮在75%的乙醇溶液中溶解度最高.此外,乙醇浓度过高会导致同银杏黄酮一起吸附在树脂上的色素等杂质也被解吸下来,从而降低银杏黄酮的纯度.因此,75%的乙醇溶液可选为最佳的脱附剂.

图1 银杏黄酮的动态穿透曲线Fig.1The dynamic breakthrough curve of ginkgo flavonoids

图2 乙醇浓度对银杏黄酮解吸效果的影响Fig.2Effect of ethanol concentration on the desorption of ginkgo flavonoids

图3 银杏黄酮的动态脱附曲线Fig.3The dynamic desorption curve of ginkgo flavonoids
2.4 银杏黄酮的动态脱附曲线
为了有效地脱附银杏黄酮同时降低脱附剂的消耗,实验通过动态脱附曲线研究了脱附速率对银杏黄酮脱附效率的影响.于室温条件下分别以1.8 BV/h、3BV/h、3.6BV/h、9BV/h的脱附速率加入75%乙醇溶液进行动态脱附,每5mL作为单位收集脱附液并测定其中银杏黄酮浓度.实验结果如图3所示.
由图3知,随脱附液体积的增加,脱附液中银杏黄酮浓度先增加后降低.在脱附过程中,脱附剂会进入树脂的内部孔道中从而溶出其中吸附的目的物质.在较小的脱附速率条件下,吸附在S-8型树脂内部的银杏黄酮与脱附剂的接触时间长,使得银杏黄酮的脱附率升高.因此在相同的脱附率条件下,较小的脱附速率可显著地降低脱附剂的用量.因此,1.8 BV/h可选为最佳的脱附速率,此时仅需消耗40 mL的75%乙醇溶液即可将银杏黄酮从S-8型树脂上洗脱下来.
综上研究,确定了S-8型树脂动态吸附/脱附银杏黄酮的最佳条件:上样流速为3 BV/h,上样体积为65 mL,脱附剂为75%乙醇溶液,脱附流速为1.8 BV/ h,脱附剂用量为40 mL.收集该条件下的脱附液冷冻真空干燥,制得银杏黄酮粉末,计算得银杏黄酮纯度为27.5%,高于银杏黄酮纯度的国际标准(24%).
2.5 脱附液中成分分析2.5.1红外光谱分析
脱附实验结束后,研究了脱附液与进料液的红外吸收光谱,其红外光谱图如图4所示.在进料液的红外谱图中,3 412 cm1处的吸收峰为游离-OH峰,2 919 cm1处的吸收峰为烷基C-H的弯曲震动峰,1 251 cm1、1 018 cm1处的吸收峰为SO24的特征峰,717 cm1处的吸收峰为(CH2)n,(n>4)的特征峰,说明进料液中含有SDS.在脱附液的红外谱图中,SO24的特征峰1251cm1、1018cm1消失,同时(CH2)n,(n>4)的特征峰717 cm1也消失,而代表银杏黄酮中C=O键的两个特征吸收峰1 648 cm1、1609cm1却再次出现,说明脱附液中不含SDS,即脱附过程实现了银杏黄酮与SDS的分离,银杏黄酮得到进一步纯化.
2.5.2 脱附液中银杏黄酮成分的鉴定银杏黄酮种类繁多[17],为鉴定脱
附液中银杏黄酮具体成分,取上述银杏黄酮粉末0.02g溶于50mL甲醇中,溶液经孔径为0.45m的滤膜过滤后,进行HPLC-MS/MS分析.银杏黄酮总离子流图如图5所示.

图4 脱附液与消泡液的红外光谱图Fig.4The FTIR of eluent and the foamate
由图5可知,在银杏黄酮的总质子流图中被鉴别为银杏黄酮成分的离子流峰主要为m/z 593、m/z 609、m/z 623、m/z 739、m/z 755,其对应的分子式分别为C27H30O15、C27H30O16、C28H32O16、C33H40O19、C36H35O18,且被鉴别出来的所有成分均列于表2中.值得注意的是离子峰m/z 739、m/z 755在不同保留时间各出现2次,表明C33H40O19、C36H35O18各有两个同分异构体.而离子峰m/z 847代表的成分为银杏萜内酯.
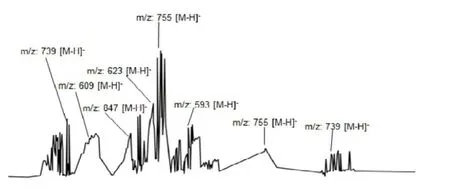
图5 银杏黄酮ESI总质子流图Fig.5ESI-total ion chromatogram of ginkgo flavonoids

表2 脱附液中银杏黄酮成分表Tab.2The components of ginkgo flavonoids in eluent
2.6 树脂稳定性实验
吸附剂的重复使用性是评价其稳定性及吸附性能的重要指标[18].一般吸附剂在吸附目标物质的同时也会吸附其他杂质,导致吸附剂的吸附性能降低.在最佳动态吸附/脱附条件下,在S-8树脂连续使用6次后,其吸附/脱附银杏黄酮的结果如表3.
由表3可见,随着应用次数的增加,S-8型树脂对银杏黄酮的吸附/脱附性能呈现降低的趋势,特别是连续应用第6次时银杏黄酮的吸附率、脱附率及回收率都较前5次大幅降低.以上结果表明,S-8型树脂在实验操作条件下可连续进行吸附/脱附银杏黄酮5次,之后由于树脂性能的降低需要进行树脂再生操作(同2.2.2树脂的活化).再生后的S-8树脂依然对银杏黄酮保持了较高的吸附率、吸附量、脱附率、回收率,从而可实现大孔吸附树脂分离纯化银杏黄酮的连续操作.
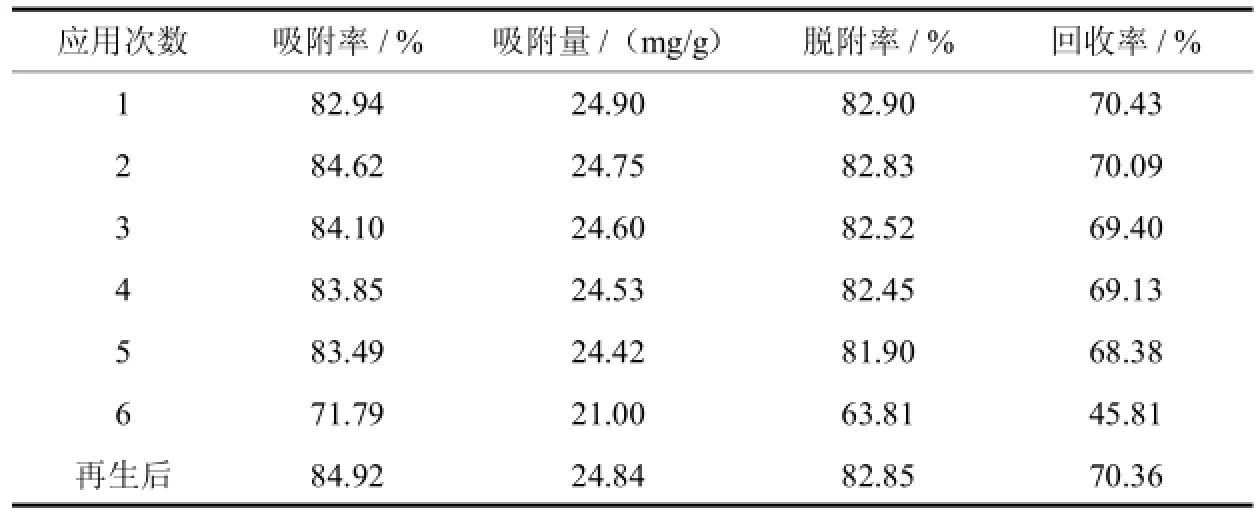
表3 S-8型树脂的使用次数对分离银杏黄酮的影响Tab.3Effect of the usage times of S-8 resin on separating ginkgo flavonoids
3 结论
首先通过静态吸附/脱附实验,确定了5种大孔吸附树脂中S-8型树脂可用作吸附分离银杏黄酮的最佳吸附剂.通过研究动态穿透曲线、脱附剂浓度及动态脱附曲线,确定了S-8型树脂对银杏黄酮的最佳动态吸附/脱附操作条件:上样流速为3.0BV/h时,进料液的最佳上样体积为65mL;以75%乙醇溶液作为脱附剂,脱附流速为1.8 BV/h时,脱附剂体积为40 mL.该条件下解吸液中银杏黄酮的纯度为27.5%,高于银杏黄酮纯度的国际标准(24%).傅里叶红外光谱结果表明,S-8型树脂可实现银杏黄酮与SDS的分离.HPLC-MS/MS分析结果表明脱附液中的银杏黄酮主要由7种成分组成.S-8型树脂分离纯化银杏黄酮性质稳定,可连续使用5次后进行再生.
[1]Van Beek T A.Chemical analysis of Ginkgo biloba leaves and extracts[J].J Chromatogr A,2002,967:21-25.
[2]Singh B,Kaur P,Gopichand,et al.Biology and chemistry of ginkgo biloba[J].Fitoterapia,2008,79:401-418.
[3]LiuBG,ZhuYY.Extractionof flavonoidsfromflavonoid-richpartsintartarybuckwheat andidentificationofthemainflavonoids[J].JFoodEng,2007,78(2):584-587.
[4]Erdman J W,Balentine D,Arab L,et al.Flavonoids and heart health[J].J Nutr,2007,137(3):718S-737S.
[5]AksayS,MazzaG.Optimizationofproteinrecoverybyfoamseparationusingresponsesurfacemethodology[J].JFoodEng,2007,79(2):598-606.
[6]刘萌,吴兆亮,孙江娜,等.溶剂气浮法分离富集银杏叶黄酮[J].过程工程学报,2009,9(1):28-32.
[7]Deng T,Jia J F,Luo N,et al.A dual-task method for the simultaneous detoxification and enrichment of stilbene glycoside from polygonum multiflorum roots extract by macroporous resin[J].Chem Eng J,2014,237:138-145.
[8]汪洪武,刘艳清.大孔吸附树脂的应用研究进展[J].中药材,2005,28(4):353-356.
[9]王一敏,任晓蕾.大孔树脂的应用研究[J].中医药信息,2008,25(4):26-28.
[10]Zhang J,Hayat K,Zhang X M,et al.Separation and purification of flavonoid from ginkgo extract by polyamide resin[J].Sep Sci Technol,2010,45:2413-2419.
[11]Liu W,Zhang H X,Wu Z L,et al.Recovery of isoflavone aglycones from soy whey wastewater using foam fractionation and acidic hydrolysis [J].J Agric Food Chem,2013,61:7366-7372.
[12]China Pharmacopoeia Committee.Pharmacopoeia of the People's Republic of China[M].Beijing:China Medical Science and Technology Press,2010:372-373.
[13]Dong Y,Zhao M M,Sun-Waterhouse D X,et al.Absorption and desorption behaviour of the flavonoids from Glycyrrhiza glabra L.leaf on macroporous adsorption resins[J].Food Chem,2014,168(2015):538-545.
[14]Xiong Q P,Zhang Q H,Zhang D Y,et al.Preliminary separation and purification of resveratrol from extract of peanut(Arachis hypogaea)sprouts by macroporous adsorption resins[J].Food Chem,2014,145(2014):1-7.
[15]王丽敏,郑灿龙,高贵良,等.大孔吸附树脂分离纯化月见草叶总黄酮工艺研究[J].新疆农业科学,2013,50(12):2286-2295.
[16]Li C,Zheng Y Y,Wang X F,et al.Simultaneous separation and purification of flavonoids and oleuropeinfrom Olea europaea L.(olive)leaves using macroporous resin[J].J Sci Food Agric,2011,91:2826-2834.
[17]DingS,DudleyE,Plummer S,etal.FingerprintprofileofGinkgobilobanutritionalsupplementsbyLC/ESI-MS/MS[J].Phytochemistry,2008,69:1555-1564.
[18]吴梅林,周春山,钟世安,等.大孔吸附树脂纯化银杏活性化合物的工艺研究[J].中南药学,2005,3(2):75-77.
[责任编辑 田丰]
Separation of ginkgo flavonoids from the foamate in foam fractionation using macroporous resin adsorption
JIAO Meng,WU Zhaoliang,LIU Wei
(School of Chemical Engineering,Hebei University of Technology,Tianjin 300130,China)
Macroporous adsorption resin was used to separate and purify ginkgo flavonoids from the foamate.The results of static adsorption/desorption experiments indicated that S-8 resin could be used as the optimal adsorbent among the five tested resins.The dynamic breakthrough curves,the concentration of desorption solvent and the dynamic desorption curves were investigated and the optimal dynamic adsorption/desorption conditions of S-8 resin on ginkgo flavonoids were determined as follows:the breakthrough volume was 65 mLwhen loading flow rate was 3.0 BV/h,and the consumption volume of desorption solvent was 40 mL when the desorption flow rate was 1.8 BV/h by using 75%ethanol solution as desorption solvent.Under the optimal conditions,the purity of ginkgo flavonoids in the eluent reached 27.5%,in which SDS was also removed.Additionally,HPLC-MS/MS result suggestthatginkgo flavonoids in theeluent mainly consisted of seven components.S-8 resin can be reused to purify ginkgo flavonoids five times before the regeneration.
macroporous adsorption resin;ginkgo flavonoids;separation;purification;foam fractionation
TQ461
A
1007-2373(2015)04-0057-06
10.14081/j.cnki.hgdxb.2015.04.012
2015-01-21
国家自然科学基金(21346008)
焦萌(1989-),女(汉族),硕士生.通讯作者:吴兆亮(1957-),男(汉族),教授,zhaoliangwu_hebut@163.com.
数字出版日期:2015-06-23
数字出版网址:http://www.cnki.net/kcms/detail/13.1208.T.20150623.1636.004.html

