黔产毛蒟提取物的制备及其化学成分的定性分析
杨艳,吴芹,龚其海,徐世兵,石京山Δ
(1.遵义医学院附属医院 药剂科,贵州 遵义 563003;2.遵义医学院 药理学教研室,贵州 遵义 563002;3.遵义市湄潭县人民医院,贵州 遵义 564100)
黔产毛蒟提取物的制备及其化学成分的定性分析
杨艳1,吴芹2,龚其海2,徐世兵3,石京山2Δ
(1.遵义医学院附属医院 药剂科,贵州 遵义 563003;2.遵义医学院 药理学教研室,贵州 遵义 563002;3.遵义市湄潭县人民医院,贵州 遵义 564100)
目的 考察黔产毛蒟提取物制备的最佳工艺,定性分析各提取物的化学成分。方法 采用溶剂回流加热法进行提取。在单因素试验的基础上,以提取次数、提取时间、料液比和浸泡时间为因素安排L9(34)正交试验,以提取率为指标,优选黔产毛蒟提取的最佳工艺;经D-101大孔吸附树脂分离,得到黔产毛蒟水洗脱液、醇洗脱液;采用理化分析方法对黔产毛蒟提取物进行初步定性分析。结果 提取最佳工艺为:提取时间为2 h,提取次数为3次,料液比为1:30,浸泡时间为2 h;经过初步定性反应确认总提取物含有氨基酸、多肽、蛋白质、生物碱、甾体或三萜类、黄酮、皂苷、多糖、还原糖及糖苷、香豆素及萜类内酯化合物、酚类和鞣质成分;水洗脱物含有氨基酸、多肽、蛋白质、皂苷、多糖、还原糖及糖苷、香豆素及萜类内酯化合物;乙醇洗脱物含有氨基酸、多肽、蛋白质、生物碱、甾体或三萜类、黄酮、多糖、还原糖及糖苷、酚类和鞣质成分。结论 黔产毛蒟提取的最佳工艺提取率高、稳定可行。
毛蒟; 提取工艺; 定性分析; 正交试验设计
毛蒟[Piperpuberulum(Benth.) Maxim.]系胡椒科胡椒属植物,为多年生攀援藤本,全株有浓烈香气,幼枝纤细,密被短柔毛。常生长在密林、疏林中、沟边阴湿处,主要分布于我国的四川、云南,贵州、广西、广东等地。毛蒟全株可药用,具有行气止痛,祛风活血之功效,主治风湿性痹痛、风寒头痛、胃脘痛等[1]。毛蒟在贵州民间已用于治疗急慢性肝损伤,疗效显著,未发现不良反应[2],因此值得研究开发。根据文献记载,胡椒科植物多具有温中散寒、行气止痛等功效[3]。毛蒟同属植物海风藤、假蒟等均已见化学成分[4-6]、药理活性方面的研究[7],但毛蒟化学成分尚不清楚,所以本实验以质量提取率为指标,在单因素实验的基础上应用正交实验对提取工艺进行优化,以确定最佳的提取条件,并对提取物的化成成分进行初步分析,旨在为广泛深入研究、开发此植物提供实验依据。
1 材料与方法
1.1 实验仪器 50×900 mm玻璃层析柱(上海琪特分析仪器有限公司)、SHHW电热恒温三用水浴锅(北京永光明医疗仪器厂)、DHG-9123A电热恒温鼓风干燥箱(上海精宏实验设备有限公司)、MODULYOD-230冷冻干燥机(Thermoelectron 公司)。
1.2 药材与试剂 新鲜毛蒟采自于贵州省黔东南州锦屏县,经贵州省遵义医学院附属医院药剂科杨建文副教授鉴定为胡椒科胡椒属植物毛蒟的变种[Piperpuberulum(Benth.) Maxim.]。其他试剂均为分析纯。
1.3 毛蒟提取工艺条件
1.3.1 药材的处理:新鲜毛蒟(20 g)以纯化水适当冲洗去除泥土,于40 ℃烘箱中低温干燥,粉碎成粗粉,密封于璃瓶内备用。
1.3.2 毛蒟的提取方法:称取约10 g毛蒟干燥粗粉放置于圆底烧瓶中,按一定比例加入蒸馏水(料液比),浸泡合适的时间(浸泡时间),加热提取数小时(提取时间),加热结束后,趁热真空抽滤,收集滤液。残渣用蒸馏水洗入圆底烧瓶中,再次加热回流提取,提取数次(提取次数)后,同样趁热真空抽滤,合并滤液。滤液于旋转蒸发仪减压回收溶剂、浓缩,置于冷冻干燥机干燥得毛蒟总提取物。
1.3.3 提取工艺单因素实验:①料液比:分别称取约10 g毛蒟粗粉末5份,于圆底烧瓶中,加入100、200、300、400、500 mL (料液比为1:10、1:20、1:30、1:40、1:50)蒸馏水,浸泡2 h,固定提取温度,提取时间2 h的条件下,提取3次,考察料液比对粗提取物的质量提取率的影响,每一条件下重复测定3次,取平均值。②提取次数:分别称取约10 g毛蒟粗粉末5份,于圆底烧瓶中,加入“1.3.3”项下①方法得到的质量提取率最高的体积比的水,浸泡2 h,固定提取温度,提取时间2 h的条件下,提取1、2、3、4次,考察提取次数对粗提取物的质量提取率的影响,每一条件下重复测定3次,取平均值。③提取时间:分别称取约10 g毛蒟粗粉末5份,于圆底烧瓶中,加入“1.3.3”项下①方法得到的质量提取率最高的体积比的水,浸泡2 h,固定提取温度,提取时间0.5、1.0、2.0、3.0、4.0 h的条件下,按照提取“1.3.3”项下②方法得到的质量提取率最高的次数,考察提取时间对粗提取物的质量提取率的影响,每一条件下重复3次,取平均值。④药材浸泡时间:分别称取约10 g毛蒟粗粉末5份,于圆底烧瓶中,加入“1.3.3”项下①方法得到的质量最高的体积比的水,浸泡0.5、1、1.5、2、2.5 h,固定提取温度,提取时间为“1.3.3”项下③质量提取率最高的时间,提取“1.3.3”项下②方法得到的质量提取率最高的次数,考察药材浸泡时间对质量提取率的影响,每一条件重复3次,取平均值。
1.3.4 提取工艺正交实验:在单因素实验的基础上,以料液比(A)、浸泡时间(B)、提取次数(C)、提取时间(D)为考察因素。以质量提取率为指标,选用L9(34)正交表根据“1.3.3”项下的方法安排提取实验。每一水平重复3次,取其平均值。采用直观分析方法,根据极差大小和方差分析确定影响提取因素的主次顺序。正交实验因素水平,见表1。
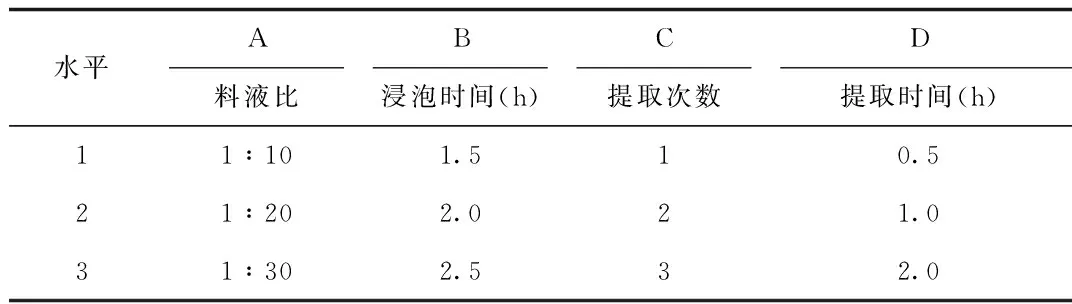
表1 提取正交实验因素水平表Tab.1 Factors and levels of extraction test
料液比=毛蒟干燥粗粉质量︰蒸馏水质量
1.3.5 提取工艺参数的验证试验:称取毛蒟粗粉末约10 g各3份,用“1.3.4”优选出来的最佳提取工艺参数照“1.3.2”项下的方法进行重复性实验3次,分别计算质量提取率,以此来验证提取工艺的稳定性和可行性。
1.3.6 毛蒟总提取物的制备:取毛蒟干燥药材10.0 kg,粉碎,用1:30体积比的蒸馏水浸泡2 h,冷凝回流3次,每次回流时间为2 h,真空抽滤后合并滤液,减压浓缩后冷冻干燥,得得毛蒟总提取物(以下简称总提物)。
1.3.7 毛蒟总提取物的分离:将毛蒟总提取物进行分离,采用D-101大孔树脂,将其进行酸、碱处理,得到大孔树脂填装,再将大孔树脂填装进行醇、水处理,得到待用大孔树脂;将上一步骤中得到的毛蒟总提取物溶解、离心,得到总提物上清液;将总提物上清液缓慢加入待用大孔树脂内进行水洗脱;将水洗脱毕后的水洗液减压回收溶剂,得到水洗浸膏,再将该水洗浸膏冷冻干燥后,即得到毛蒟水提物;另外,将水洗脱毕的余下物进行醇洗脱,将得到的醇洗液减压回收溶剂,得到醇洗浸膏,将该醇洗浸膏冷冻干燥后,即得到毛蒟醇提物。
1.3.8 总提物、水洗物、醇洗物定性实验:
① 氨基酸、多肽、蛋白质的定性检测:
茚三酮(Ninhydrin)实验:分别取总提液2 mL于试管中,加试剂3~5滴,在沸水浴上加热5 min,冷却后有蓝色或蓝紫色出现。以乙醇液为对照,同法进行操作。
双缩脲(Biuret)反应:分别取总提液2 mL于试管中,加入试剂,摇动,冷却时候显绿色—紫红色。以乙醇液为对照,同法进行操作。
② 生物碱的定性实验
碘- 碘化钾(Wagner)实验:分别取总提液2mL 于试管中,加入试剂,生成棕色沉淀。以乙醇液为对照,同法进行操作。
碘化汞钾(Mayer)实验:分别取总提液2 mL 于试管中,加入试剂,生成红棕色沉淀。以乙醇液为对照,同法进行操作。
苦味酸试剂:分别取总提液2 mL于试管中,加入试剂,生成棕黄色沉淀。以乙醇液为对照,同法进行操作。
③ 甾体或三萜类的定性检测
Liebrmann-Burchand反应:分别取总提液0.5 mL悬浮于1 mL 醋酐中,沿试管壁缓慢滴加1 mL浓硫酸,溶液逐渐呈紫红色。以乙醇液为对照,同法进行操作。
④ 黄酮的定性检测
铅盐反应:分别取总提液2 mL于试管中,加入试剂,生成棕黄色沉淀。以乙醇液为对照,同法进行操作。
三氯化铝- 乙醇实验:分别取总提液2 mL 于试管中,加入试剂,充分振摇,于365 nm 下呈现明显绿色或黄绿色荧光。以乙醇液为对照,同法进行操作。
⑤ 皂苷的定性检测
泡沫实验:分别取总提液2 mL 于试管中,充分振摇,产生蜂窝状泡沫,10 min不消退,加入少量95%乙醇泡沫也无明显减少。以乙醇液为对照,同法进行操作。
⑥ 多糖、还原糖及糖苷的定性检测
α-萘酚试剂反应:分别取总提液2 mL 于试管中,加入5% α-萘酚乙醇溶液3~5滴,充分振摇,再沿试管壁缓慢滴加 0.5 mL浓硫酸,在试液与浓硫酸交界处形成紫色环。以乙醇液为对照,同法进行操作。
费林(Fehling)试剂反应:分别取总提液2 mL于试管中,加试剂 3~5滴,充分振摇,在沸水浴上加热5 min,有砖红色沉淀生成。以乙醇液为对照,同法进行操作。
多糖实验:分别取总提液2 mL 于试管中,分加入1倍量的95% 乙醇,出现絮状悬浮物或沉淀。以蒸馏水为对照,同法进行操作。
⑦ 香豆素及萜类内酯化合物的定性检测
开环闭环反应:分别取总提液1 mL于试管中,加入 1% 氢氧化钠溶液2 mL 在沸水浴上加热3~4 min,再加入2% 盐酸酸化,放置一段时间液体出现浑浊或沉淀。以乙醇液为对照,同法进行操作。
⑧ 酚类和鞣质的定性检测
氯化钠- 明胶试剂反应:分别取总提液各2 mL于试管中,加入试剂,出现白色沉淀。以乙醇液为对照,同法进行操作。
三氯化铁试剂反应:分别取总提液2 mL于试管中,滴加2~3滴醋酸酸化,摇匀,再加入试剂,呈蓝或墨绿色。以乙醇液为对照,同法进行操作。
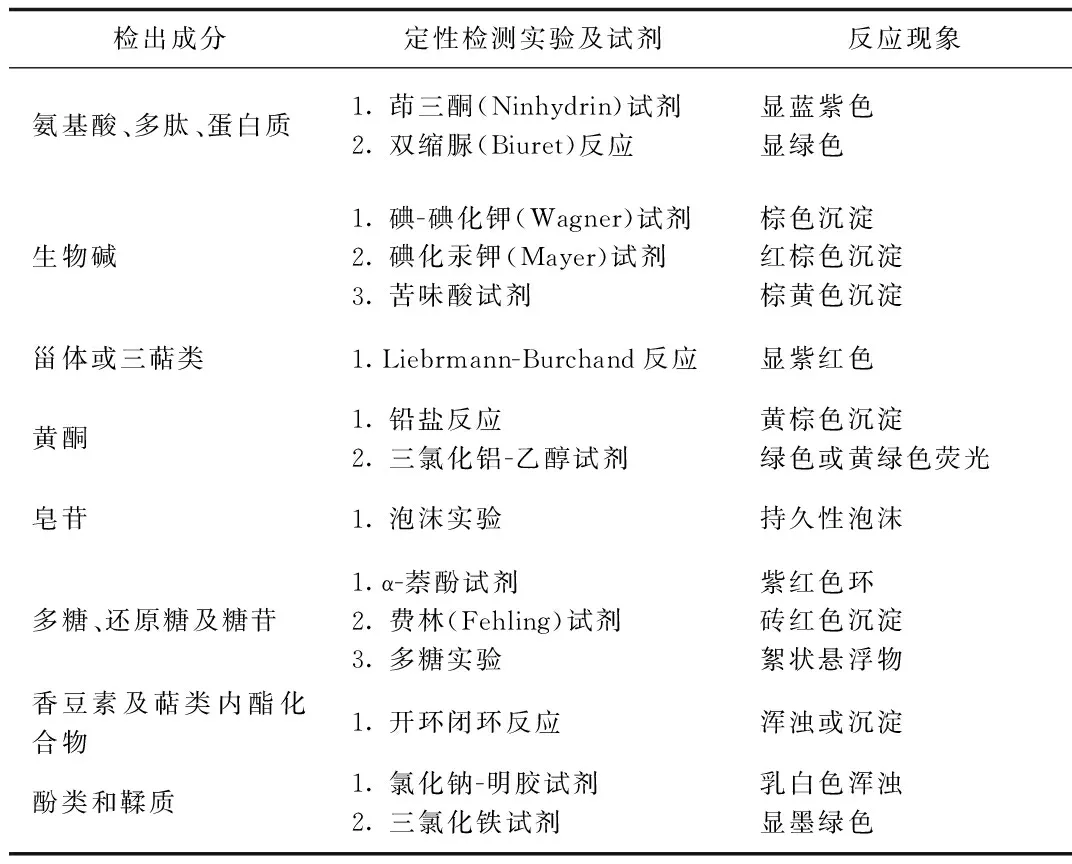
表2 定性检测实验现象Tab.2 Phenmenon of qualitative detection experiment
2 结果
2.1 提取单因素实验结果
2.1.1 料液比对质量提取率的影响:随着料液比的增加,提取率一直是递增趋势,料液比为1:50时提取率达到最高为22.31%。但是在料液比1:30之后升高趋势变得缓慢,说明在料液比为1:30时提取很充分。提取溶剂体积太大会给后续的过滤、浓缩等工作带来困难,综合上述因素,因此选择最佳的料液比在1:30为宜。见图1。
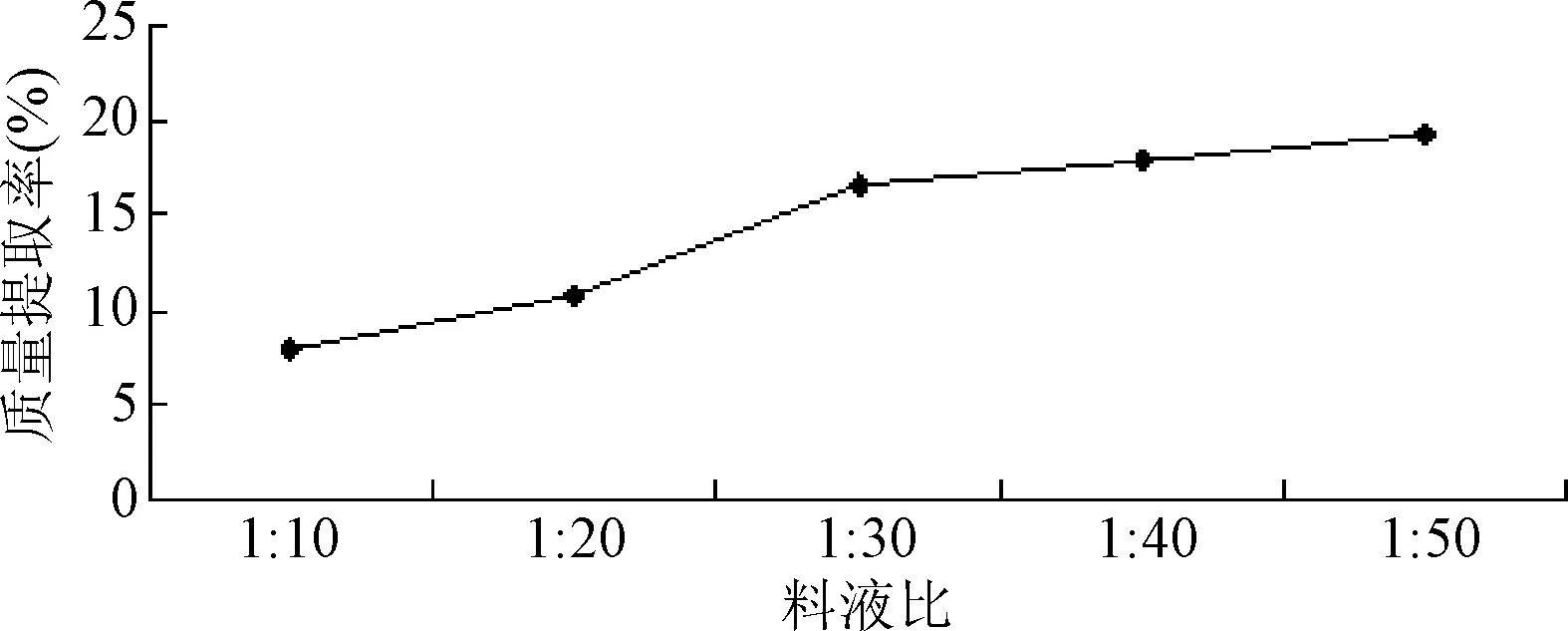
图1 料液比对提取率的影响Fig.1 Effect of the ratio of material to liquid on extraction yield
2.1.2 浸泡时间对质量提取率的影响:提取率随着浸泡时间的增加,也逐渐增大,而且一直是递增趋势,当浸泡时间为2.5 h时提取率达到最高点,但2.0 h和2.5 h的质量提取率相差不大,结合实际生产,提高生产效率,因此选择浸泡时间在2.0 h较适宜。见图2。
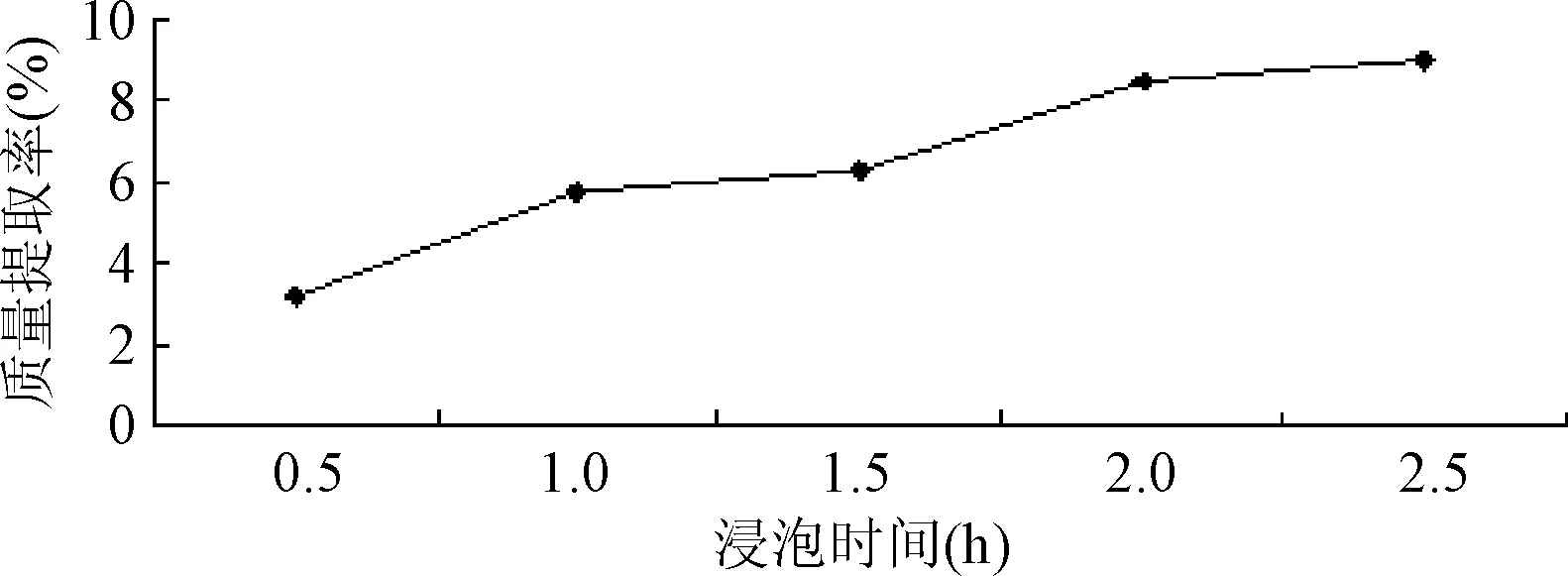
图2 浸泡时间对提取率的影响Fig.2 Effect of steeping time on extraction yield
2.1.3 提取时间对质量提取率的影响:提取率在2 h时达到最高点,在此之后提取率下降,说明药材中某些有效成分可能因为提取时间的延长而发生了分解,综合考虑工业生产的效率等问题,因此选择最佳的提取时间在2.0 h为宜。见图3。
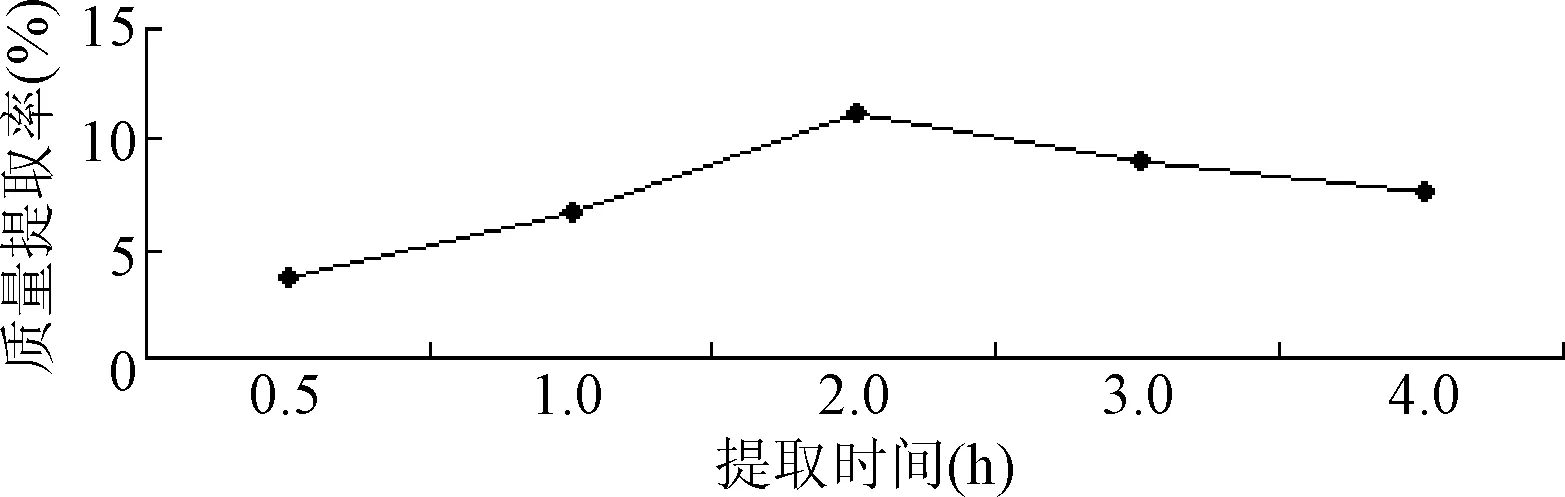
图3 提取时间对提取率的影响Fig.3 Effect of extract time on extraction yield
2.1.4 提取次数对质量提取率的影响:从图4可知,提取率随着提取次数的增加而增大,提取3次时达到最大10.03%,由于提取3次与提取4次的提取率相差不大,从节约成本、时间的角度考虑,本实验认为3次提取已经较为充分,效果较好,选择最佳的提取次数为3次。见图4。
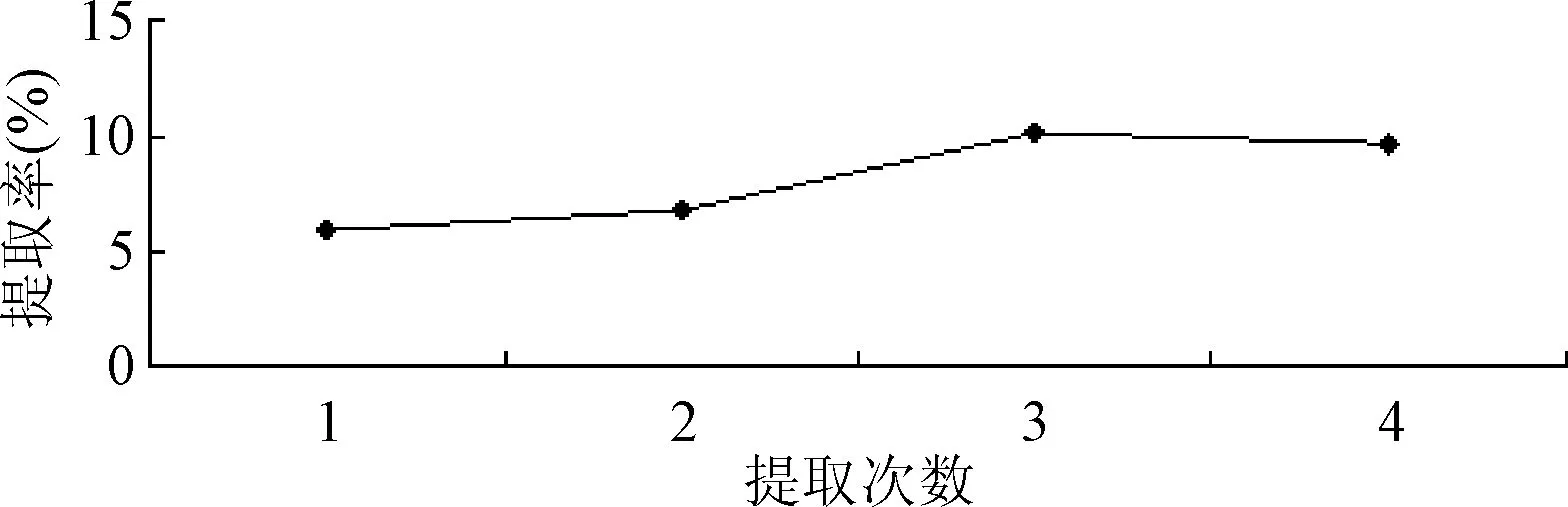
图4 提取次数对提取率的影响Fig.4 Effect of extract times on extraction yield
2.2 正交试验结果 正交试验结果见表3,方差分析结果见表4。从表3的直观分析结果、表4的方差分析结果可知:其中A、C、D因素均有显著性差异、B因素没有显著性差异,C因素影响最大、其次是A因素、再次是D因素、B因素。即各因素对提取率的影响程度依次为提取次数>料液比>提取时间>浸泡时间。综合直观分析和方差分析的结果,提取的最佳水平组合为A3B2C3D3即以1:30倍体积的溶剂浸泡药物粉末2.0 h,加热回流提取3次,每次提取2.0 h。
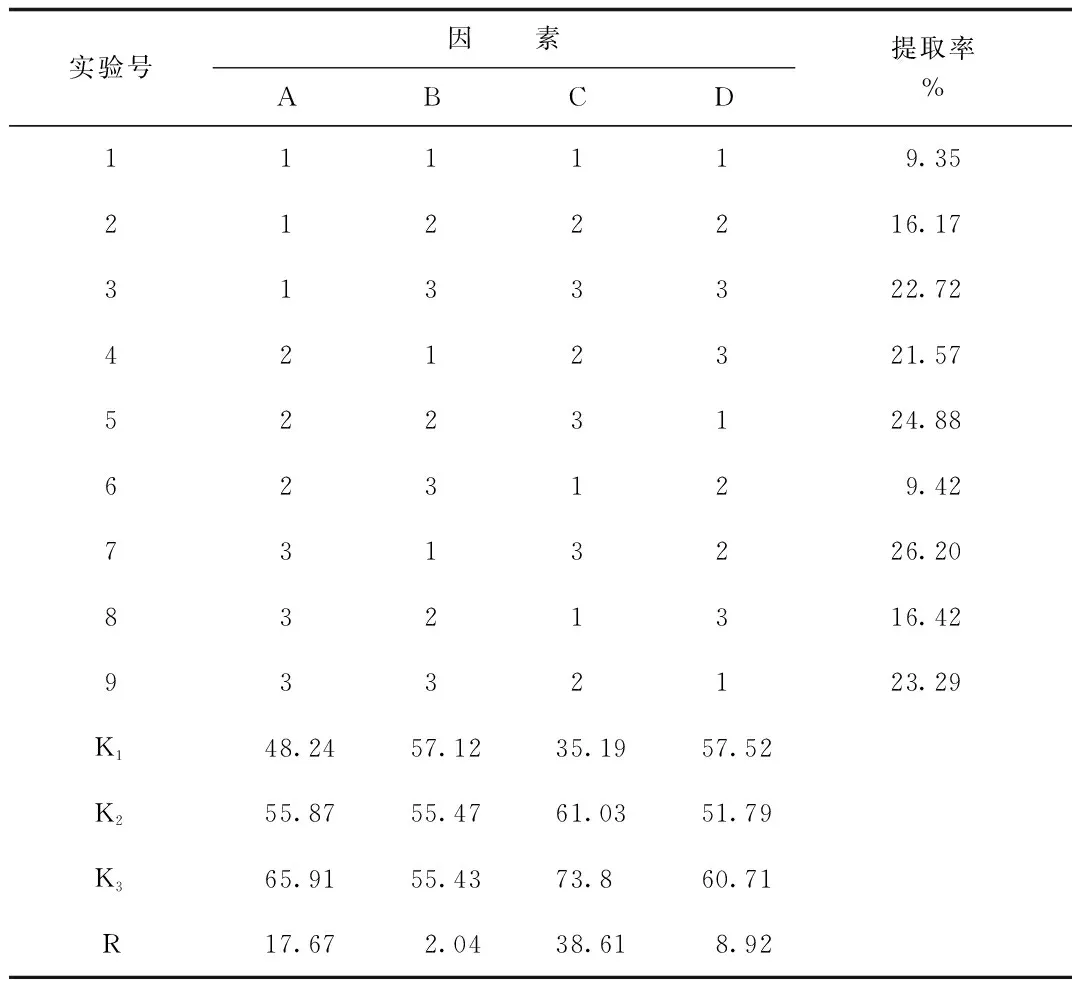
表3 L9(34)正交试验结果Tab.3 Results of orthogonal test L9(34)
质量提取率=冷冻干燥后提取物粉末质量/毛蒟粗粉末质量×100%
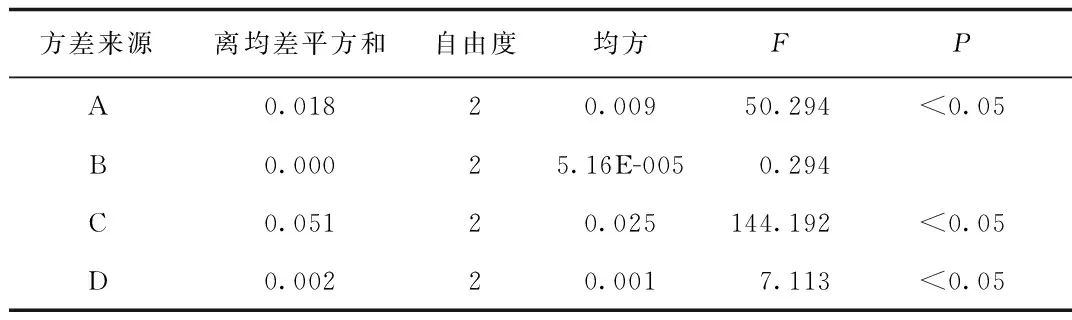
表4 方差分析结果Tab.4 Result of variance analysis
2.3 提取工艺验证试验结果 测定的结果均优于正交实验表中的任何一组,重现性很好,说明该工艺稳定可行。见表5。

表5 最佳提取工艺的验证试验 (n=3)Tab.5 Verification test of the optimum extraction process(n=3)
2.4 定性检测结果 总提物、水洗物、醇洗物初步定性实验结果见表6、图5。
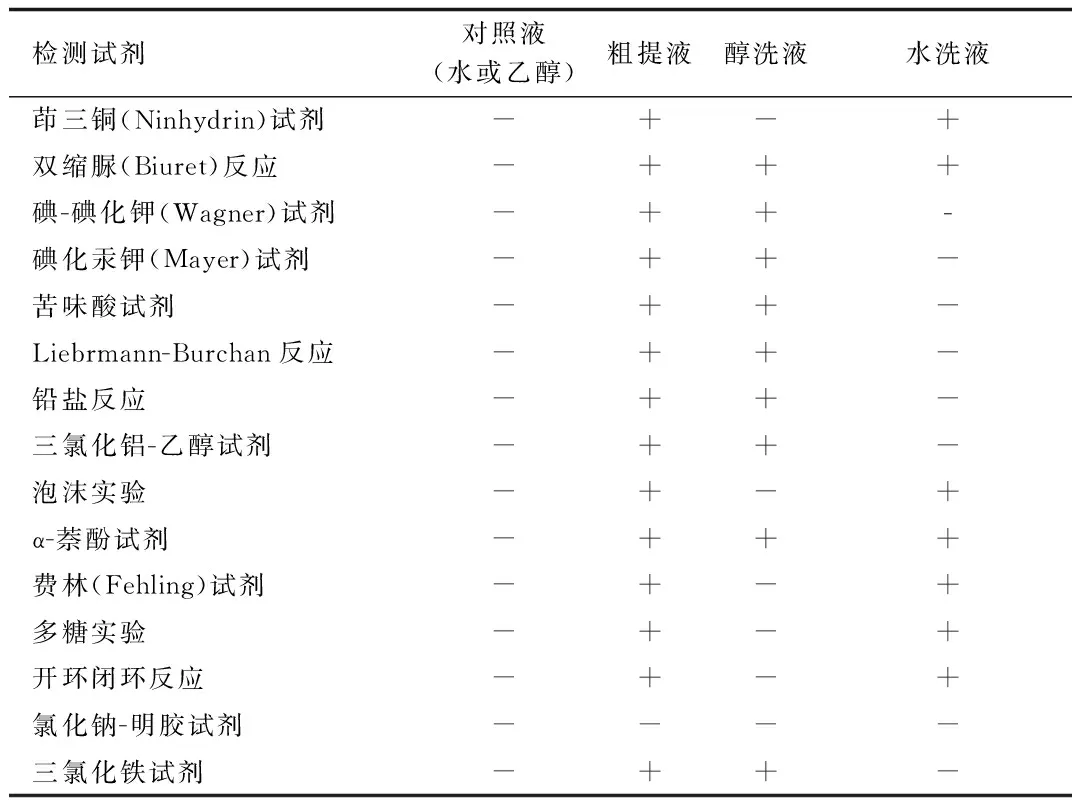
表6 定性实验结果Tab.6 Results of qualitative detection experiment
+:反应阳性;-反应阴性


图5 定性检测结果1.对照液;2.粗提液;3.醇提液;4.水洗液Fig.5 Results of qualitative detection experiment1.control solution; 2.crude extracts; 3.ethanol extracts; 4.water extracts
3 讨论
中药有效成分的提取工艺考察,是通过比较不同的提取工艺参数,从中选择一种有效成分溶出率高、操作简单、成本消耗少的提取方法。由于药材之间差别较大,每种植物中所含的成分不同,故其提取没有一种通用的方法,在遵循浸提原理[8]的基础上应根据不同药材特点、采用不同的方法。中药在传统应用中均以水煎常见,在民间流传用毛蒟煮水喝治疗肝脏疾病很有效,说明其有效成分有可能是水溶性的,因此本实验选用了水提法。
大孔吸附树脂具有物理化学稳定性高、吸附选择性独特,不受无机物存在的影响、再生简便、解吸条件温和、使用周期长、节省费用等诸多优点,广泛用于植物中有效成分的分离纯化[9-10],是提取分离中草药有效成分的一种有效方法。该工艺操作简便,成本较低,树脂可反复使用,越来越受到人们的重视。综合以上因素,本实验选择了大孔树脂对毛蒟粗提取液进行初步的分离纯化。
直观分析结果及方差分析结果表明对提取率影响最大的是提取次数,其次是料液比和提取时间,影响最小的是浸泡时间;因此,在进行提取时,必须注意各工艺参数的调控。提取工艺验证实验3次提取率均高于正交实验里任何一组,说明优选出来的工艺参数组合是可行、稳定的。
从总提物、水洗物、醇洗物的初步定性检测结果可知,水洗物和醇洗物有些成分是交叉的,即水洗物与醇洗物中均含有,本实验只是初步分离,定性鉴定,后期药效学实验完成后,需对药理活性强的提取部位进行深入的分离纯化研究。
[1] 朱华,曾锦燕,颜萍花,等.广西不同产地毛蒟的水溶性浸出物、水分及灰分测定[J].大众科技,2014,16(176):55-57.
[2] 张丹.金属硫蛋白的昼夜节律变化及对肝脏的保护作用[J].遵义医学院,2013,S1.
[3] 饶高雄,阮志国,王金萍,等.胡椒科植物中胡椒碱的测定[J].云南中医学院学报,1995,18(4):7-8.
[4] 李晓光,罗焕敏.广东海风藤挥发油化学成分研究[J].中国药物化学杂志,2002,12(2):89-91.
[5] 任风芝,张丽,牛桂云,等.海风藤的化学成分研究[J].中草药,2005,36(2):184-185.
[6] 宋艳平,徐明志,梁勇.假蒟挥发油化学成分气质联用分析研究[J].分析实验室,2006,25(1):24-28.
[7] 张雄,王伟,阮旭中,等.海风藤新木脂素类成分对缺血脑区血小板活化因子及花生四烯酸代谢的影响[J].中华老年心脑血管病杂志,2002,4(4):270-273.
[8] 范必亭.中药药剂学[M].第2版.上海:上海科学技术出版社,2004,90-92.
[9] 聂丽,罗万芳,王兴文.大孔树脂分离纯化三七黄酮类成分研究[J].云南中医学院学报,2007,30(1):10-12.
[10] 刘飞,赵莹.大孔吸附树脂及其在天然产物分离纯化中的应用[J].齐鲁药事,2008,27(10):679-681.
(编校:王冬梅)
Analysis ofPiperpuberulum(Benth.) Maxim.extracts preparation and the preliminary qualitative chemical composition
YANG Yan1, WU Qin2, GONG Qi-hai2, XU Shi-bing3, SHI Jing-shan2Δ
(1.Department of Pharmacy, Affiliated Hospital of Zunyi Medical College, Zunyi 563003, China; 2.Department of Pharmacology, Zunyi Medical College, Zunyi 563002, China; 3.Meitan People’s Hospital, Zunyi 564100, China)
ObjectiveTo investigate optimal extraction process ofPiperpuberulum(Benth.) Maxim.and qualitative analyze the chemical component of the extracts.MethodsMethod of solvent heating reflux was used for extraction.On the basis of single factor experiment, L9(34) orthogonal experiment was designed with the variants of extraction frequency, time, material-liquid ratio, and immersion time.Extraction rate as index, extraction processes were optimized to achieve best extraction.The extracts, including total extract, water elution, and ethanol elution, were physiochemically analysed to achieve an initial qualitative result.ResultsThe optimal extraction process was: extractions 3 times for 2 hours, with an 1︰30 material - liquid ratio and 2 hours of immersion, Initial qualitative analyzed the total extracts containing amino acids, polypeptides, proteins, alkaloids, steroids or triterpenes, flavones, saponins, polysaccharides, reducing sugars or glucosides, cumarins, terpene lactones, phenols, and tannins.The water elution containing: amino acids, polypeptides, proteins, saponins, polysaccharides, reducing sugars or glucosides, cumarins, and terpene lactones.The ethanol elution containing: amino acids, polypeptides, proteins, alkaloids, steroids or triterpenes, flavones, polysaccharides, reducing sugars or glucosides, phenols, and tanins.ConclusionThe experiments show that optimal extraction process can achieve high extraction yield, stable and practical.
Piperpuberulum(Benth.) Maxim.;extraction process;qualitative analysis; orthogonal experiment design
杨艳,女,硕士,副教授,研究方向:医院药学工作,E-mail:ZYFYYYmY@163.com;石京山,通讯作者,男,博士,教授,博士生导师,研究方向:药理学,E-mail:shijs@zmc.edu.cn。
R284
A
1005-1678(2015)05-0169-05

