神经节苷脂GM1对大鼠急性脑损伤的保护作用及相关机制研究
张波,戚利坤,李立新
(1.青海省人民医院 神经内科,青海 西宁 810007;2.青海省第五人民医院 神经内科,青海 西宁 810007;3.南京医科大学,江苏 南京 210029)
神经节苷脂GM1对大鼠急性脑损伤的保护作用及相关机制研究
张波1Δ,戚利坤2,李立新3
(1.青海省人民医院 神经内科,青海 西宁 810007;2.青海省第五人民医院 神经内科,青海 西宁 810007;3.南京医科大学,江苏 南京 210029)
目的 探究单唾液酸四己糖神经节苷脂(monosialoganglioside,GM1)对大鼠急性脑损伤的保护作用及相关机制。方法 采用落体撞击法使大鼠左顶叶形成局部性脑挫裂伤。将65只SD大鼠随机分为假手术组(n=5)、脑损伤组(n=30)和GM1组(n=30),分别在造模给药后3、7、14、28、56、168 h时,每次各组随机选取5只(假手术组为1只),通过免疫组化染色检测脑组织Bcl-2、Bax的蛋白表达以及PARP降解情况,TUNEL法观察神经细胞凋亡的情况。 结果 脑损伤组各时间点Bax、Bcl-2蛋白表达与假手术组比较差异有统计学意义(P<0.05),GM1组各时间点Bax、Bcl-2蛋白表达与脑损伤组比较差异有统计学意义(P<0.05),且GM1组在14 h后Bax、Bcl-2蛋白表达与假手术组差异无统计学意义。给药后Bax/Bcl-2比值有所下降,在14 h下降最为明显。脑损伤组PARP降解及细胞凋亡率在各时间点显著高于假手术组(P<0.05),GM1组PARP降解在28、56、168 h显著低于脑损伤组(P<0.05),神经细胞凋亡率在各时间点显著低于脑损伤组(P<0.05)。结论 神经节苷脂GM1能够降低急性脑损伤大鼠Bax/Bcl-2比值,同时PARP降解缓解,凋亡细胞减少。
单唾液酸四己糖神经节苷脂;急性脑损伤;细胞凋亡
单唾液酸四己糖神经节苷脂(monosialoganglioside,GM1)主要分布于脑内,GM1是神经系统发育不可缺少的因子,且对神经系统的发育起着保护作用。近来的研究发现[1],缺血再灌注形成脑损伤时,脑组织内源性GM1含量下降,是脑损伤后神经元损伤、功能损害的重要原因。内源性GM1可能是通过参与调节细胞凋亡相关蛋白Bal-2、Bax的含量控制细胞凋亡,从而达到保护脑损伤的作用[2-3]。目前研究证实,外源性GM1能够通过血脑屏障,对神经元的凋亡起着一定的抑制作用,同时促进脑损伤后神经元的修复[4],但是对于GM1在急性脑损伤中修复的作用和机制尚不清楚。本实验通过构建大鼠急性脑损伤模型,探究外源性GM1对大鼠急性脑损伤修复的影响以及相关机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:65只雄性SPF级Sprague-Dawley大鼠购自南华大学实验动物学部,动物许可证号:SCXK(湘)2010-0004,体质量250~300 g,2月龄,给予正常饲料喂养。本研究遵循《实验动物保护条例》。
1.1.2 试剂与仪器:Bax、Bcl-2单克隆抗体购自Cell Signaling公司;TUNEL试剂盒购自罗氏(Roche)公司;Anti-PARP p85 Fragment pAb试剂盒购自Promega公司。HMIAS-2000高清晰彩色医学图文分析系统购自武汉千屏影像技术有限责任公司;OCT冰冻切片包埋剂购自上海基剑生物科技有限公司。
1.2 方法
1.2.1 动物分组及急性脑损伤大鼠模型的建立:SD大鼠65只,随机分为假手术组(n=5)、脑损伤组(n=30)、GM1组(n=30)(脑损伤10 min后腹腔注射GM1,50mg/kg)。
脑损伤的模型建立采用Feeney等[5]的落体冲撞法以致左顶叶局部性脑挫裂伤,形成挫伤冲击力大小为500g/cm。2组大鼠分别于造模后3、7、14、28、56、168 h时,每次各随机选取5只(假手术组为1只)处死,将假手术组大鼠各时点相关指标表达情况合并统计,处死后均取损伤左顶叶与对侧脑组织,用4%的多聚甲醛固定后,OCT冰冻切片包埋剂包埋,常规切片5~6μm,用于免疫组化检测。
1.2.2 实验动物模型评价系统:评价急性脑损伤模型采用Feeney等[5]评定方法,共4级:0级,神经功能无损伤;1级,提尾见大鼠瘫痪侧前肢回收弯曲,正常侧往前展开;2级,1级表征外,触碰大鼠瘫痪侧遇阻力低于正常侧;3级,2级表征外,大鼠爬动时往瘫痪侧旋转;模型建立后2 h开展评分,若大鼠评为0级则选入假手术组。评价为1、2、3级则模型建立成功,为脑损伤组。
1.2.3 免疫组化法检测Bcl-2、Bax蛋白:按Bcl-2、Bax单克隆抗体试剂盒说明书对切片进行染色,在显微镜下分别观察各组不同时间点的损伤局部与同侧部位。Bax和Bcl-2阳性细胞的细胞浆以及核膜判定为棕黄色颗粒状物质。染色结果利用HMIAS-2000高清晰彩色医学图文分析软件分析,每例切片各选取5个视野,测定阳性细胞灰度值,以及背景灰度值,计算相对灰度值(相对灰度值=背景灰度值-阳性灰度值)及平均相对灰度值, 相对灰度值越高, 表明蛋白表达越强。Bax/Bcl-2比值
越大凋亡率越高。
1.2.4 TUNEL染色检测脑损伤PARP降解:采用Anti-PARP p85 Fragment pAb和原位末端转移酶标记技术(TUNEL)分别检测各组大鼠不同时间点损伤局部与对侧部位的聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)降解情况及细胞凋亡情况,参照试剂盒说明书操作,凡能在细胞核内观测到棕黄色颗粒的为TUNEL染色阳性细胞。
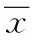
2 结果
2.1 模型评价 建立急性脑损伤模型2 h后进行模型评价,假手术组大鼠脑损伤评价6只均为0;脑损伤组1级11只,2级12只,3级7只;GM1组1级12只,2级12只,3级6只。
2.2 免疫组化检测Bcl-2与Bax蛋白的表达 Bcl-2与Bax蛋白免疫组化染色结果见图1。Bcl-2蛋白的表达在GM1腹腔注射后14 h时达到最大值,随后降低,而Bax蛋白的表达在腹腔注射后28 h达到最低。脑损伤组各时间点Bax、Bcl-2蛋白表达与假手术组比较差异有统计学意义(P<0.05),GM1组Bax、Bcl-2蛋白表达显著与脑损伤组比较差异有统计学意义(P<0.05),且GM1组在14 h后Bax、Bcl-2蛋白表达与假手术组差异无统计学意义。给药后Bax/Bcl-2比值有所下降,在14 h下降最为明显。见表1。
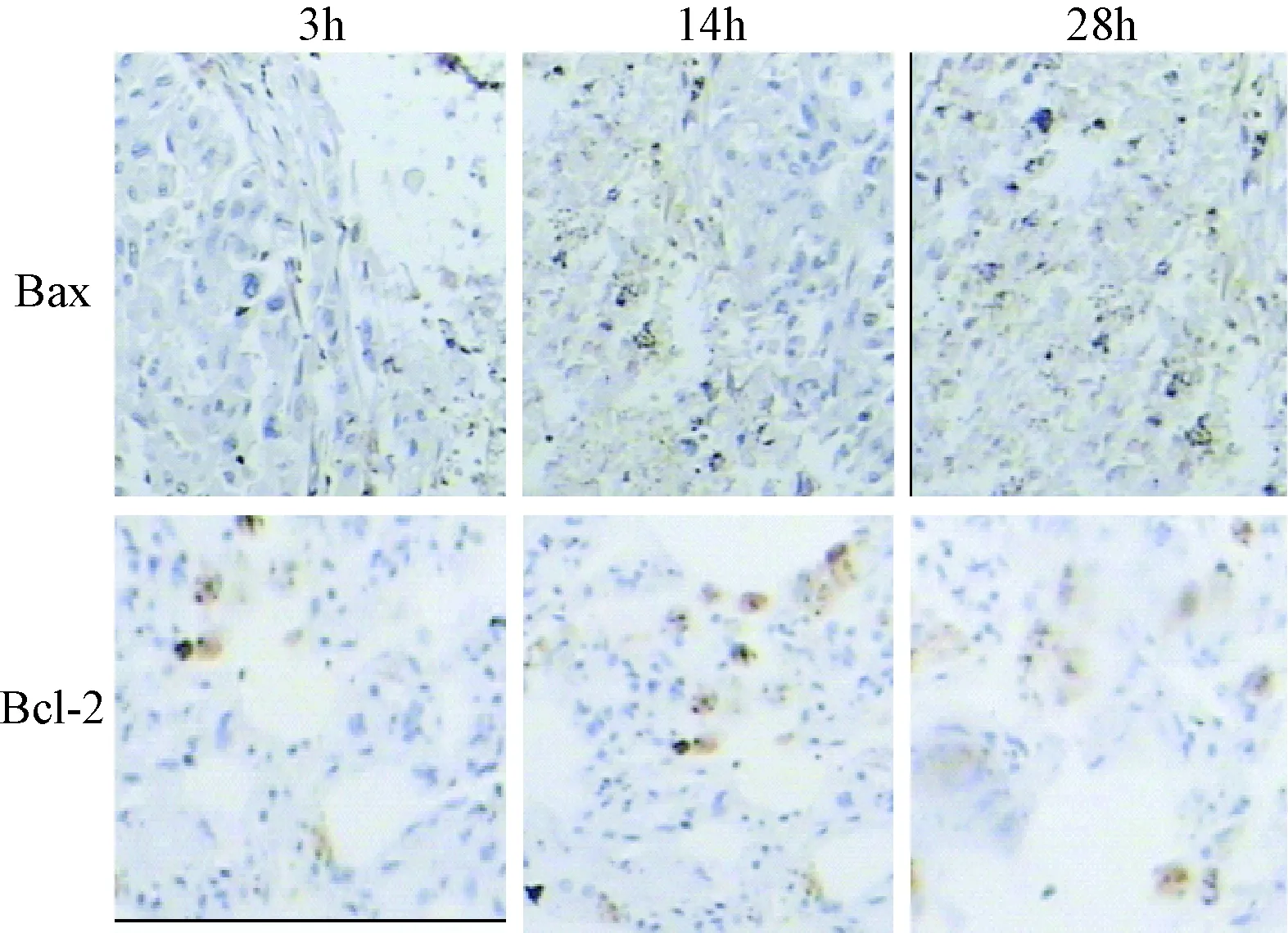
图1 免疫组化检测GM1组中Bax与Bcl-2蛋白表达(×200)Fig.1 Expression of Bax and Bcl-2 protein in GM1 group detected by immunohistochemistry(×200)

组别检测指标3h7h14h28h56h168h假手术组(n=6)BaxBcl-2Bax/Bcl-285.24±2.4189.00±6.800.93脑损伤组(n=5)Bax103.77±6.89*104.53±2.26*106.00±3.19*107.98±4.23*108.32±1.70*119.99±2.33*Bcl-2102.72±5.92*110.77±3.40*120.99±2.86*96.32±4.42*100.55±4.00*95.86±1.70*Bax/Bcl-21.011.071.001.101.071.22GM1组(n=5)Bax92.53±2.41*#93.39±1.11*#94.00±2.44#95.95±4.49#86.23±1.76#85.12±2.58#Bcl-2102.07±3.30*89.11±3.46#88.66±3.42#86.55±3.72#90.66±1.11#87.45±4.22#Bax/Bcl-20.900.850.720.880.940.96
*P<0.05,与假手术组比较,compared with sham-operation;#P<0.05,与脑损伤组比较,compared with brain injury group
2.3 TUNEL染色与脑急性损伤PARP降解测定 脑损伤组PARP降解及细胞凋亡率在各时间点显著高于假手术组(P<0.05),GM1组PARP降解在28、56、168 h显著低于脑损伤组(P<0.05),细胞凋亡率在各时间点显著低于脑损伤组(P<0.05),其中PARP降解在14 h后开始减缓。见表2。
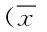
表2 各组大鼠急性脑损伤后不同时间点PARP降解与细胞凋亡的变化±s,%)Tab.2 Changes of PARP degradation and neuronal apoptosis at different time points after traumatic brain injury in each ±s,%)
*P<0.05,与假手术组比较,compared with sham-operation;#P<0.05,与脑损伤组比较,compared with brain injury group
3 讨论
单唾液酸四己糖神经节苷脂(GM1)具有介导细胞与细胞、细胞与基质间的相互作用,可以调控细胞膜中蛋白质的功能。Bcl-2和Bax 2者形成了凋亡的正负控制,其比值决定了细胞是否出现凋亡。实验从急性脑损伤大鼠的脑皮质免疫组化观察到损伤的不同时间下GM1对Bcl-2,Bax蛋白表达及PARP降解的变化。GM1能够通过血脑屏障与GM1受体结合,作用至神经元,从而加速蛋白的合成,起到促进神经系统发育,防止损伤的神经元凋亡的作用,可能与GM1的量有关。急性脑损伤中已经发现有GM1含量的下降以及神经元的损伤,补充GM1在一定程度上可以抑制损伤造成的细胞凋亡[6-7]。Bax蛋白有对抗Bcl-2蛋白抑制而细胞凋亡的作用,Bcl-2蛋白抑制细胞凋亡必须通过与Bax形成异源二聚体来实现,2者复杂的反应与调控,产生细胞存亡的不同结果。
本研究免疫组化的结果显示,脑损伤组的大鼠Bcl-2的蛋白表达明显下降,而Bax的表达明显升高,与很多研究报道的结论一致[8-9],Bcl-2和Bax与脑损伤细胞凋亡密切相关,可能是由于线粒体氧代谢的改变,细胞氧化应激等原因[10-11]。本实验结果显示腹腔注射外源性GM1可以显著地降低Bax蛋白的含量,增加Bcl-2的含量,可能与外源性GM1通过调控线粒体通路蛋白含量,抑制神经元凋亡发挥作用。本研究还发现,腹腔注射GM1后,Bax/Bcl-2的比值在14 h时达到最低值,且此时PARP降解的测定与TUNEL染色均显示凋亡细胞的数目减少,提示GM1腹腔注射14 h后效果最好。因此,外源性GM1不仅对急性脑损伤后神经元的凋亡有抑制作用,而且在14 h药物效果较好。
本研究探究了GM1 在急性脑损伤的作用及相关机制,结果证实GM1能够通过Bax,Bcl 2蛋白抑制神经细胞凋亡,促进脑损伤组织修复。但外源性GM1调节Bax/Bcl-2的含量的具体机制,以及外源性GM1的药效学特征、药物代谢动力学特征对其神经保护作用的影响,仍需要进一步基础研究支持,从而为临床上治疗急性脑损伤提供有利的保证。
[1] 张卿,左萍萍.神经节许脂GM1神经保护机制的研究进展[J].中国药理学通报,2004,20(12):1329-1333.
[2] 王江雁,张卫宁,张雪静,等.神经节苷脂GM1对大鼠急性脑损伤后神经细胞凋亡的抑制作用[J].华西药学杂志,2014,29(1):39-41.
[3] Xu R,Zhou Y,Fang X,Lu Y,Li J,Zhang J,Deng X,Li S.The possible mechanism of Parkinson’s disease progressive damage and the preventive effect of GM1 in the rat model induced by 6-hydroxydopa mine[J].Brain Res,2014(10):73-81.
[4] Hall ED,Springer JE.Neuroprotection and acute spinal cord injury: a reappraisal[J].NeuroRx, 2004,1(1):80-100.
[5] Feeney DM,Boreson MG,Linn RF,et al.Response to cortical injury I: methodology and local effects of contusion in the rat[J].Brain Res,1981(211):67-77.
[6] Mocchetti I.Exogenous gangliosides, neuronal plasticity andrepair,and the neurotrophins[J].Cell Mol Life Sci,2005,62(19-20):2283-2294.
[7] 骆纯,卢亦成,朱诚,等.人鼠液压脑损伤后Bax/Bcl-XL的表达在mRN A和蛋自质水平的相关性[J].第二军医人学学报,2001,22(6):546-550.
[8] 王长峰,魏海峰,滕红林,等.急性脊髓损伤后神经细胞黏附分子L1和Bcl-2,Bax表达的相关性研究田[J].中华神经外科杂志,2006,22(10):602-605.
[9] Mao W,Yi X,Qin J,et al.CXCL12 inhibits cortical neuron apoptosis by increasing the ratio of Bcl-2/Bax after traumatic brain injury[J].Int J Neurosci,2014,124(4):281-290.
[10] He Q,Liu T,Zhou L,et al.Effect of mild to moderate hypothermia on casepase-3,Bcl-2 and Bax expressions inbrain tissue of rats after cardiopulmonary resuscitation[J].NanFang Yike Daxue Xuebao,2013,33(10):1489-1493.
[11] Liao ZB,Jiang GY,Tang ZH,et al.Erythropoietin can promote survival of cerebral cells by downregulating Bax gene after traumatic brain injury in rats[J].Neurol India,2009,57(6):722-728.
(编校:王俨俨)
Protective effect of ganlioside GM1 on rats with acute brain trauma and its relevant mechanism
ZHANG Bo1Δ, QI Li-kun2,LI Li-xin3
(1. Department of Neurology, Qinghai Provincial People’s Hospital, Xining 810007, China; 2. Department of Neurology, Fifth People’s Hospital of Qinghai Province, Xining 810007, China; 3. Nanjing Medical University, Nanjing 210029, China)
ObjectiveTo explore the protective effect of monosialoganglioside (GM1) on rats with acute brain trauma and its relevant mechanism. MethodsLocalized brain contusion model in rats were constructed by Feeney’s method. 65 SD rats were randomly divided into three groups: sham-operation group (n=5), brain injury group (n=30) and GM1 group (n=30). The rats were killed at 3, 7, 14, 28, 56, 168 h after administration, 5 rats in each group (1 rats in sham-operation group). Bax and Bcl-2 protein expression and PARP were decected by immunohistochemical method. The neuronal apotosis was detected by TUNEL. ResultsThere were significant differences in expression of Bax and Bcl-2 protein between brain injury group and sham-operation group at each time point (P<0.05). There were significant differences in expression of Bax and Bcl-2 protein between GM1 group and brain injury group at each time point (P<0.05), while there were no significant differences in expression of Bax and Bcl-2 protein after 14 h between GM1 group and sham-operation group. After administration, the Bax/Bcl-2 values decreased and was obvious at 14 h. Degradation of PARP and rate of neuronal apotosis in brain injury group at each time point were significantly higher than those in sham-operation group (P<0.05). Degradation of PARP in GM1 group at 28 h, 56 h, 168 h were significant lower than those in brain injury group (P<0.05), and rate of neuronal apotosis was lower at each time point than those in brain injury group (P<0.05). ConclusionGM1 could reduce value of Bax/Bcl-2, degradation of PARP and apoptosis in rats with traumatic injury brain.
monosialoganglioside; acute brain trauma; apoptosis
国家自然科学基金(81171147)
张波,通讯作者,女,本科,主治医师,研究方向:神经内科常见病、多发病及神经重症医学,E-mail: qch1821460057@163.com。
R96
A
1005-1678(2015)09-0048-03

