131I-Herceptin联合高能X线对HER2高表达人乳腺癌细胞的协同杀伤及机制研究
张迎,袁胜利,郑勤,张全安,徐瀚峰
(1.南京市第二医院 肿瘤科,江苏 南京 210003;2.山东省青岛市市立医院 肿瘤二科,山东 青岛 266011)
131I-Herceptin联合高能X线对HER2高表达人乳腺癌细胞的协同杀伤及机制研究
张迎1,袁胜利2Δ,郑勤1,张全安1,徐瀚峰1
(1.南京市第二医院 肿瘤科,江苏 南京 210003;2.山东省青岛市市立医院 肿瘤二科,山东 青岛 266011)
目的 研究131I-Herceptin联合高能X线对HER2高表达人乳腺癌SK-BR-3细胞的协同杀伤及机制。方法 运用免疫组化法、荧光原位杂交法(fluorescence in situ hybridization,FISH)检测SK-BR-3细胞的人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)蛋白表达和基因扩增,采用Iodogen法制备131I-Herceptin,MTT法筛选131I-Herceptin杀伤SK-BR-3细胞的IC15浓度。根据是否应用131I-Herceptin分为对照组及加药组,分别给予高能X线(0、2、4、6 Gy),以克隆形成试验分析协同杀伤效应;将细胞分为空白对照组、药物组(131I-Herceptin)、高能X线组(2Gy)、联合组(131I-Herceptin+2Gy),以A0/EB法检测细胞凋亡率及死亡率,以流式细胞仪检测各组细胞周期。结果 SK-BR-3细胞为HER2高表达细胞。131I-Herceptin的标记率为86.8%,放射化学纯度为93.9%,放射性比活度为868.3 μci/mg。131I-Herceptin的IC15为15.625 μci/mL。发现131I-Herceptin(F=628.008,P<0.05)及高能X线(F=964.970,P<0.05)对SK-BR-3细胞均有显著的杀伤作用,可明显降低细胞的SF值,且2者具有交互作用(F=113.046,P<0.05),即2者协同降低SF值。空白组、外照射组、药物组及联合组细胞凋亡率与死亡率比较差异均有统计学意义(F=103.324,F=13.330,均P<0.05),且两两比较差异均有统计学意义(P<0.05);经外照射及131I-Herceptin联合作用后,细胞周期均发生明显改变,由G1期向G2期和S期转移。结论131I-Herceptin 联合高能X线对HER2高表达人乳腺癌SK-BR-3细胞具有协同杀伤作用。
乳腺癌;人表皮生长因子受体2;放射免疫治疗;协同杀伤
乳腺癌是女性最常见的恶性肿瘤。人类表皮生长因子受体2(human epidermal growth factor-2,HER2或 HER2/neu)在20%~30%的浸润性乳腺癌中过表达。HER2的过表达是判定乳腺癌恶性高及预后不良的金标准之一,且提高了肿瘤的放射抗拒性[1]。本实验将放射性核素131I与Herceptin连接,制备放射免疫药物131I-Herceptin。已证实131I-Herceptin对HER2过表达乳腺癌细胞SK-BR-3的杀伤较131I、Herceptin均明显增强[2]。而Herceptin可增加HER2过表达乳腺癌细胞对外照射的敏感性[1]。研究外照射与131I-Herceptin同时作用时是否具有协同杀伤作用,是进一步增加治疗效果的有效探索。
1 材料与方法
1.1 主要试剂及仪器 RPMI-1640及胰蛋白酶为Gibco公司产品,Herceptin购于上海罗氏公司,胎牛血清为Hyclon公司产品,辣根过氧化物酶标记山羊抗小鼠IgG及鼠抗人c-erbB-2单克隆抗体购于中山金桥生物技术有限公司,膀胱癌细胞染色体及基因异常检测试剂盒FISH购于北京金菩嘉医疗科技有限公司,Na131I为青岛大学医学院附属医院核医学科惠赠,Iodogen为Sigma公司产品,MTT为Amersco公司产品,AO/EB染料购自北京索莱宝科技有限公司。BX41荧光显微镜为日本Olympus公司产品,FACS10流式细胞仪为美国BECTON DICKISON公司产品。Sephadex G25柱购于北京韦氏博慧色谱科技有限公司。
1.2 细胞培养 SK-BR-3细胞购自中国科学院典型培养物保藏委员会细胞库。10%胎牛血清RPMI-1640培养,贴壁率达90%以上。在37 ℃,5%CO2饱和湿度下传代培养。选取对数生长期细胞进行试验。
1.3 免疫组化法检测细胞HER2蛋白的表达 以1:80的鼠抗人c-erbB-2单克隆抗体作为一抗,以1:200的辣根过氧化物酶标记的山羊抗小鼠IgG为二抗,检测细胞表面HER2蛋白的表达。同时设立对照组,以缓冲液代替一抗进行染色。
1.4 荧光原位杂交(fluorescence in situ hybridization,FISH)法检测HER2表达 胰酶消化收集SK-BR-3细胞,滴片,参照膀胱癌细胞染色体及基因异常检测试剂盒FISH产品说明书步骤,判断SK-BR-3细胞Her2/neu基因的扩增。红色荧光为HER2基因扩增,绿色荧光为17号染色体着丝粒序列标记。计数20个细胞,观察红绿信号的比值,若红绿信号比值≥2或红色信号呈团块状认为HER2阳性[2]。
1.5131I-Herceptin的制备及质量控制 采用Iodogen法[3]标记131I-Herceptin;运用纸层析法测定131I-Herceptin的放射化学纯度;计算131I-Herceptin的标记率、131I-Herceptin的放射性比活度。
放射化学纯度=纸层析中131I-Herceptin的放射性计数/纸层析中所有纸段的放射性计数(cpm)之和×100%;
131I-Herceptin的标记率=第一峰(131I-Herceptin)的放射性测量值/所有洗脱液的放射性测量值×100%;
131I-Herceptin的放射性比活度(μci/mg)=标记时Na131I的投入量(μci)×标记率/标记时投入的Herceptin量(mg)。
1.6 MTT法131I-Herceptin杀伤SK-BR-3细胞的IC15浓度 消化计数SK-BR-3细胞,台盼蓝染色测定细胞活力。按4 000个/瓶接种于12.5 cm2培养瓶,待细胞贴壁,131I-Herceptin以完全培养基稀释,倍比稀释6个浓度。每瓶加入以完全培养基稀释的131I-Herceptin液2mL(分别为125、62.5、31.3、15.6、7.8、3.9及1.8 μci/mL),并设不加药的细胞对照和背景对照,每个浓度设4个平行样本。药物作用12 h后,更换新鲜培养基。培养24 h后,更换为1 mL PBS液和5 mg/mL的MTT液2 mL。继续培养4 h后,弃上清,加入DMSO1.5 mL溶解沉淀,震荡10 min,使结晶物充分溶解。转移液体于96孔板,测570 nm的吸光度A值,计算抑制率。抑制率=1-试验组的A值/对照度的A值。计算15%细胞死亡的药物作用浓度(15% inhibiting concentration,IC15)。
1.7 克隆形成试验 培养SK-BR-3细胞,分为加药组与对照组,均给予不同剂量的外照射(0、2、4、6 Gy)。按照射剂量由小到大分别接种4000、6000、8000、10 000个细胞,每个剂量点设3个平行对照。接种细胞后继续培养24 h。待贴壁后,对照组更换2 mL的完全培养基1次;加药组更换131I-Herceptin浓度为15.625 μci/mL的培养基2 mL。培养12 h后2组均更换为2 mL完全培养基。继续培养12 h后予以高能X线外照射。由直线加速器产生6MV的X线,剂量率为3 Gy /min,照射野为40 cm×40 cm。照射时培养瓶内充满培养基,SSD100 cm。照射后继续培养10 d。计数≥50个细胞的克隆为1个克隆。计算克隆形成率(plating efficicy,PE)和存活分数(surviving fraction,SF)。PE=克隆形成数目/接种的细胞数,SF=PE受照细胞/PE未加任何处理因素的空白组。
1.8 AO/EB检测细胞凋亡 SK-BR-3细胞以10%胎牛血清RPMI-1640培养,贴壁率达90%以上。在37 ℃,5%CO2饱和湿度下传代培养。选取对数生长期细胞进行试验。接种2 000个细胞于12.5 cm2的培养瓶。实验分4组:①空白组:无处理因素组;②药物组:IC15131I-Herceptin组;③外照射组:2Gy高能X线照射;④联合组:IC15131I-Herceptin+2Gy高能X线照射。每组设3个平行对照。处理因素作用24 h后,弃去培养液,加入AO/EB染料4 μL混匀,置于培养瓶中1 d,荧光显微镜下计数200个细胞并观察结果。
1.9 流式细胞仪测细胞周期 按照1.8项下条件培养细胞,细胞浓度约(1~5)×106/mL。实验分4组:①空白组:无处理因素组;②药物组:IC15131I-Herceptin作用组;③外照射组:2Gy高能X线照射;④联合组:IC15131I-Herceptin+2Gy高能X线照射。每组设3个平行对照。处理因素作用24 h后以流式细胞仪检测细胞周期。
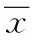
2 结果
2.1 免疫组化检测细胞表面HER2表达 低倍镜下评估染色的强度和百分比,随机观察10个高倍视野,所有SK-BR-3细胞表面均见褐色染色,其中约30%的细胞呈深褐色。SK-BR-3细胞经免疫组化染色证实为HER2蛋白高表达细胞,同以缓冲液代替一抗的对照组形成鲜明对比。见图1。
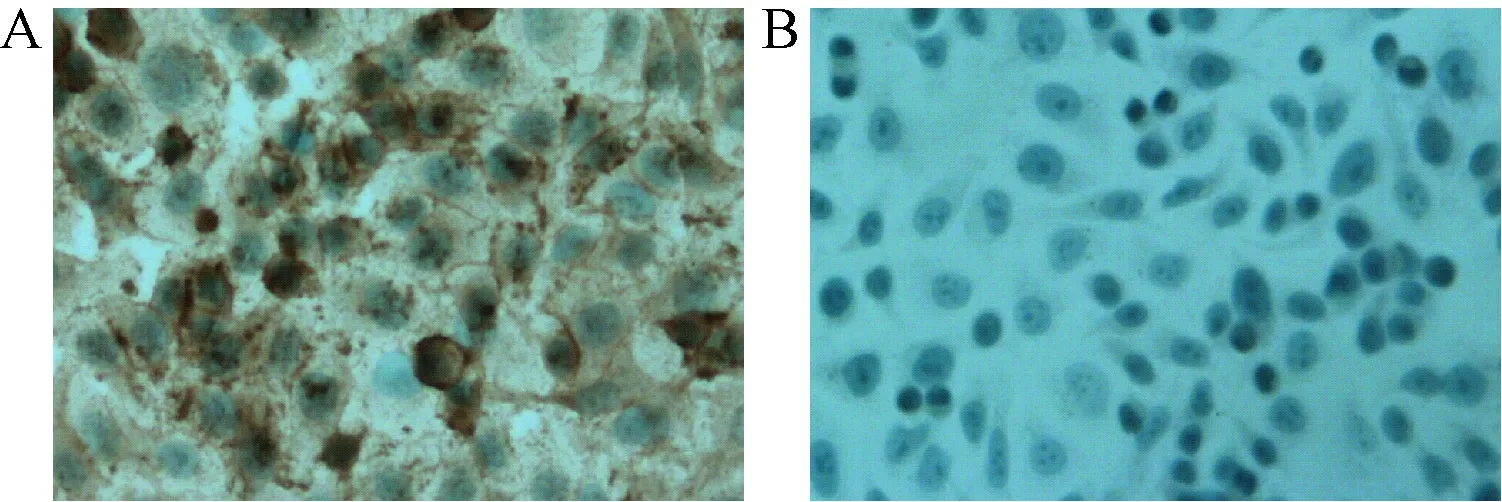
图1 SK-BR-3细胞2种染色结果(×100)A:SK-BR-3细胞免疫组化染色(HER2蛋白为褐色标记);B:对照组Fig.1 Two cell staining methods of SK-BR-3 cells(×100)A:immunohistochemical staining of SK-BR-3 cells(HER2 protein marked by brown);B:control group
2.2 荧光免疫杂交法(FISH)法检测HER2/neu的扩增 20个细胞核中的信号计数结果,红绿信号的比值均≥10,其中9个细胞的红色信号连接成簇。见图2。经FISH法检测SK-BR-3细胞存在HER2/neu基因扩增。

图2 FISH法检测SK-BR-3细胞Her2/neu基因扩增(×1 000)Fig.2 Gene amplification of Her2/neu in SK-BR-3 cells by FISH method(×1 000)
2.3131I-Herceptin的制备及质量控制131I-Herceptin的标记率为86.8%,放射化学纯度为93.9%,放射性比活度为868.3 μci/mg。
2.4 MTT法筛选131I-Herceptin的作用浓度 不同浓度131I-Herceptin作用于SK-BR-3细胞抑制率见图3,IC15(15%致死浓度)为15.625 μci/mL。
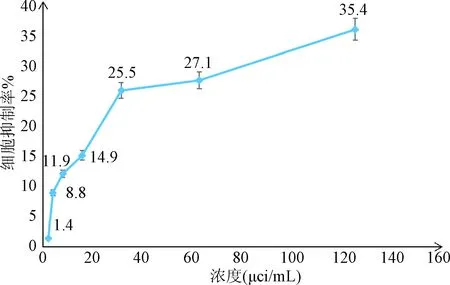
图3 MTT法检测不同浓度131I-Herceptin作用于SK-BR-3细胞的抑制率曲线(n=4)Fig.3 Inhibition ratio curve of SK-BR-3 cells treated with different concentrations of 131I-Herceptin by MTT(n=4)
2.5 克隆形成试验 SK-BR-3细胞加药组和对照组的存活分数见表1。采用单变量两因素方差分析进行统计,发现131I-Herceptin(F=628.008,P<0.001)及高能X线(F=964.970,P<0.001)对SK-BR-3细胞均有显著的杀伤作用,可明显降低细胞的SF值,且2者具有交互作用(F=113.046,P<0.001),即2者协同降低SF值。

表1 2组SK-BR-3细胞的SF值Tab.
2.6 AO/EB检测凋亡 4组细胞凋亡率比较差异有统计学意义(F=103.324,P<0.05),进一步进行q检验,每2组间差异均有统计学意义,以联合组凋亡率最高。而4组细胞死亡率比较差异有统计学意义(F=13.330,P<0.05),进一步进行q检验,每2组间差异均有统计学意义(P<0.05)。进行凋亡率两因素方差分析,131I-Herceptin与高能X线照射2者存在交互作用(F=23.742,P<0.05)。表明外照射与药物对细胞凋亡具有协同杀伤作用。见表2。
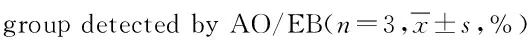

组别细胞凋亡率细胞死亡率空白组0.67±0.581.00±0.00外照射组28.00±4.004.00±1.00药物组38.00±2.003.33±0.58联合组46.00±5.003.67±0.58
2.7 流式细胞仪检测的各组细胞周期 G1、G2、S、G2/G1期时各组之间的细胞比率差异有统计学意义(F=36381.942、2918.75、6844.37、11.45,均P<0.001)。进一步行q检验,两两比较显示,空白组、放疗组、药物组间差异无统计学意义,但联合组与其余3组间差异显著(P<0.05)。由此得到,经外照射及131I-Herceptin联合作用后,细胞周期均发生明显改变,由在空白组占主要地位的G1期向G2期和S期转移。见表3。

表3 流式细胞仪检测各组的细胞周期±s,%)Tab.3 Cell cycle in each group detected by flow ±s,%)
3 讨论
乳腺癌的发病率占女性恶性肿瘤的第1位,并且逐年升高。近年来发病率和死亡率有明显上升趋势。有效的治疗是改善预后和降低乳腺癌死亡率一个重要的方法。手术、放疗、化疗、内分泌治疗及靶向治疗为其常见的治疗手段。如何能在现有治疗水平上进一步提高治疗效果是目前研究方向。乳腺癌是放疗中度敏感性肿瘤,药物对放射线的协同杀伤效应机制的探讨是目前众多研究的热点[4]。
人类表皮生长因子受体2(HER2)为分子量185KD的受体,在HER2过度表达的乳腺癌患者中,疾病进展快,预后差,对化疗及内分泌治疗如三苯氧胺抗拒,缺乏有效治疗手段。HER2过表达提示了乳腺癌的高度恶性及放疗抗拒。
Herceptin的作用靶点是HER2基因调控的细胞表面P185糖蛋白。通过下调膜表面HER2蛋白的表达、抑制细胞内酪氨酸激酶活化、降低HER2信号转导链中Akt和MARP的磷酸化水平,从而抑制了HER2过表达的生物效应[5]。在体外实验中已证实[1],Herceptin具有放疗增敏作用,其中Akt是放疗增敏作用中的关键性信号传导通路。Herceptin的分子作用可能是与高能X线有协同杀伤效应的机制之一。
131I-Herceptin是一种放射免疫性药物,将放射性核素131I与Herceptin相连接。本实验中的标记率为86.8%,放射化学纯度为93.9%,放射性比活度为868.3 μci/mg。131I主要发射β射线,其最大能量为0.606MeV,平均能量为191 keV,空气中1 m处剂量率为1.2 mSv/h/GBq,在组织中穿透距离为2~8 mm[6]。131I 已常规应用于甲状腺癌的治疗,使细胞内DNA变性、坏死,直至细胞死亡[7]。通过Herceptin与SK-BR-3细胞的紧密连接,将131I带到SK-BR-3细胞的表面,靶向于HER2高表达肿瘤,对荷瘤裸鼠模型具有明显的肿瘤抑制作用。且131I- Herceptin对HER2表达阳性的肿瘤细胞株的杀伤作用较Herceptin、131I明显增强[8]。
有研究证实[9],Herceptin可将Her2过表达细胞的周期阻滞于G2期。试验中对照组细胞主要处于G1期,经131I-Herceptin和外照射作用后均明显向G2和S期转化。而联合组,即先用131I-Herceptin处理,再给予外照射时,更多的细胞被阻滞于G2期。4个组G2期细胞的含量差异均具有统计学意义(P<0.05)。而G2期正是放疗敏感的周期,这有可能是131I-Herceptin与高能X线具有协同杀伤作用的机制之一。
在体内应用时,131I-Herceptin与外照射联合使用,可起到优势互补的作用。由于外照射为分次、短时间、大剂量照射,而131I为持续照射,从使肿瘤细胞的潜在致死性损伤的修复受到抑制,增加了对肿瘤的杀伤作用。同时由于β线穿透能力的限制,正常组织的受照射量远小于肿瘤组织,可在使肿瘤细胞得到足够照射量的同时,减轻对正常组织的损伤,使治疗增益比变大。131I- Herceptin与高能X线联合是一种具有临床价值的治疗方法。
[1] Liang K,Lu Y,Jin WD,et al.Sensitization of breast cancer cells to radiation by trastuzumab[J]Mol Cancer Ther,2003,2(11):1113-1120.
[2] 乳腺癌HER2检测指南(2014版)编委.乳腺癌HER2检测指南(2014版)[J].中华病理学杂志,2014,43(4):262-267.
[3] 杨志学,蒋国勤,邢春根,等.131I-Herceptin对乳腺癌细胞株的放射免疫治疗[J].江苏医药,2011,31(11):1273-1275.
[4] 刘方欣,李晓愚,任庆兰,等.COX-2抑制剂对乳腺癌放射增敏作用的实验研究[J]重庆医科大学学报,2008,33(1):49-52.
[5] 陈贤玉,王昆华.曲妥珠单抗1治疗HER2过表达乳腺癌的研究进展[J].昆明医科大学学报,2013(12):145-148.
[6] 香港特别行政区卫生署放射卫生部.放射核素安全数据表[R].香港:香港特别行政区卫生署放射卫生部,2009.
[7] 康增寿.131I治疗甲状腺癌[J].中国普外基础与临床杂志,2006,13(3):252-253.
[8] 林菁,罗荣城,李爱民,等.131I-Herceptin对乳腺癌细胞株的体外杀伤效应[J].第一军医大学学报,2005,25(6):663-666.
[9] 李红智,郑易,林鹏,等.赫赛汀诱导乳腺癌细胞凋亡及对其细胞周期的影响[J].基础医学与临床,2007,27(11):1251-1256.
(编校:王俨俨)
Synergism effect of131I-Herceptin and high-energy X-ray on HER2 overexpressed breast cancer cells
ZHANG Ying1, YUAN Sheng-li2Δ, ZHENG Qin1, ZHANG Quan-an1, XU Han-feng1
(1. Department of Oncology, The Second Hospital of Nanjing, Nanjing 210003, China; 2. Department of Oncology, Qingdao Municipal Hospital, Qingdao 266011, China)
ObjectiveTo study the synergism effect of131I-Herceptin and high-energy X-ray on HER2 overexpressed breast cancer SK-BR-3 cells. MethodsThe protein expression and gene amplification of human epidermal growth factor receptor-2 (HER2) in SK-BR-3 cells were identified by immunohistochemistry and fluorescence in situ hybridization (FISH) method,131I-Herceptin was prepared by iodogen method, and the IC15 concentration of131I-Herceptin on SK-BR-3 cell were selected by MTT method. The cells were divided into control group and drug group according to131I-Herceptin used or not, and were delivered five different doses of external irradiation (0,2,4 and 6Gy), and the synergism effect was detected by colonogenic assay. The cells were divided into blank group, drug group(131I-Herceptin), X-ray group(2 Gy external irradiation) and combination group(131I-Herceptin+2 Gy external irradiation), the apoptosis rate and death rate were detected by AO/EB method and cell cycle were detected by flow cytometry. ResultsThe labling rate, radiochemical purity and specific radioactivity of131I-Herceptin were 86.8%,93.9% and 868.3 μci/mg, respectively. The IC15 of131I-Herceptin was 15.625 μci/mL.131I-Herceptin and high-energy X-ray significantly reduced surviving fraction (SF)(F=628.888,F=964.97,P<0.05) and there were interactions between them (F=113.046,P<0.05). There were significant differences in apoptosis rate and death rate among blank group, drug group, X-ray group and combination group(F=103.324,F=13.33,allP<0.05),and there were significant differences of pairwise comparison (P<0.05). After irradiation and131I-Herceptin administration, the cell cycle changed obviously from G1-phase to G2- and S-phase. Conclusion131I-Herceptincombined with high-energy X-ray has the synergism effect on HER2 overexpressed breast cancer SK-BR-3 cells.
breast cancer;human epidermal growth factor receptor-2;radioimmunotherapy; synergism
张迎,女,硕士,住院医师,研究方向:恶性肿瘤的放化疗,E-mail:zhangyingqddx@163.com;袁胜利,通讯作者,男,硕士,主任医师,研究方向:肺癌、乳腺癌、消化道肿瘤的放化疗及靶向治疗,E-mail:huziandy@163.com。
R737.9
A
1005-1678(2015)09-0044-04

