地黄多糖对糖尿病肾病大鼠模型的治疗作用及对PPAR-γ信号通路的影响
康伟,王肃
(天津第五中心医院 内分泌科,天津 300450)
地黄多糖对糖尿病肾病大鼠模型的治疗作用及对PPAR-γ信号通路的影响
康伟,王肃Δ
(天津第五中心医院 内分泌科,天津 300450)
目的 研究地黄多糖对糖尿病肾病(diabetic nephropathy,DN)大鼠的治疗作用并初步探索其分子机制。方法 注射链脲佐菌素(streptozotocin,STZ)诱导糖尿病肾病大鼠模型,分为模型组,地黄多糖低剂量组(10 mg/kg)、中剂量组(20 mg/kg)、高剂量组(30 mg/kg),罗格列酮处理组以及正常对照组。检测各组大鼠24 h尿蛋白、肾质量指数(肾质量/体质量)和血糖以及肾功能参数三酰甘油(TG)、尿素氮(BUN)及肌酐(Scr)水平。酶联免疫吸附试验(ELISA)检测各组大鼠血清中转化生长因子(TGF)-β含量。逆转录-聚合酶链反应(RT-PCR)和免疫印迹实验(Western blot)检测各组大鼠骨骼肌中过氧化物酶体增殖物激活受体γ(PPARγ)、脂肪细胞脂肪酸结合蛋白(aP2)和葡萄糖转运蛋白4(GLU4)mRNA和蛋白表达水平。结果 糖尿病肾病大鼠模型 (DN模型) 24 h蛋白、肾质量指数、血糖、TGF-β、TG、BUN和Scr高于正常对照组(P<0.05),PPARγ、aP2和GLUT4水平低于正常对照组(P<0.05),显示造模成功。随着地黄多糖剂量增加,aP2/GAPDH和GLUT4/GAPDH水平增高(P<0.05),其余指标随着剂量增加而降低(P<0.05)。高剂量组地黄多糖治疗效果略低于罗格列酮组。模型组DN大鼠骨骼肌中PPARγ、aP2和GLUT4蛋白水平显著低于对照组(P<0.05),地黄多糖能够明显上调各蛋白表达水平。结论 地黄多糖能够通过调节PPARγ信号通路相关蛋白的表达对糖尿病肾病大鼠起到治疗作用,且该治疗作用有剂量依赖性。
糖尿病肾病;葡萄糖转运蛋白;过氧化物酶体增生物激活受体;罗格列酮
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的并发症之一,研究表明,地黄多糖具有增强造血、降低血糖[1]、抑制肿瘤生长等作用[2]。过氧化物酶体增殖物激活受体γ(PPARγ)的激动剂对于包括糖尿病肾病在内的多种肾病具有保护和治疗作用,可成为肾脏疾病的潜在治疗靶点[3],PPAR γ激动剂(如吡格列酮)是临床上治疗2型糖尿病运用最广泛的药物[4]。本研究旨在通过构建糖尿病肾病大鼠模型探索地黄多糖对糖尿病肾病是否有治疗作用,并初步探索其作用机制。
1 材料与方法
1.1 材料
地黄多糖由本实验室提取分离;链脲佐菌素(STZ)购自美国Sigma公司;胰岛素检测试剂盒购自法国CIS公司;葡萄糖检测试剂盒购自上海荣盛生物技术有限公司,马来酸罗格列酮片购自葛兰素史克公司;PCR引物购自Biomics公司;PPARγ、脂肪细胞脂肪酸结合蛋白(aP2)、葡萄糖转运蛋白4(GLUT4)抗体购自美国Sigma公司;免疫印迹化学发光(ECL)系统购自Syngene公司;大鼠血清转化生长因子(TGF)-β酶联免疫吸附试验(ELISA)试剂盒购自美国TPI公司。
1.2 方法
1.2.1 动物模型的建立:选取45只8周龄SPF级Wistar大鼠(购自北京实验动物中心),体质量(220±20)g,按照随机数字表法取40只进行单肾切除加单次腹腔注射STZ 40 mg/kg,建立DN大鼠模型[5],剩余5只为正常对照组(NC)。
1.2.2 动物分组与处理:造模72 h检测大鼠血糖,随机血糖高于16.7 mmol/L,尿糖“++++”者为造模成功,选出DN造模成功的35只,分为DN模型组、低剂量组、中剂量组、高剂量组和罗格列酮组,每组7只。低、中、高剂量组分别以10、20、30 mg/kg地黄多糖腹腔注射给药,每天1次,每次0.2 mL,罗格列酮组每天1 mg/kg灌胃1次。正常对照组和DN模型组注射等体积的生理盐水,给药12周。
1.2.3 尿蛋白含量检测:糖尿病模型建立并给药12周,每4周检测1次各组大鼠24 h尿蛋白,将大鼠置于代谢笼中24 h,不禁食,自由饮水,记录每只大鼠24 h尿量,取1.5 mL,用考马斯亮蓝G-250法检测尿蛋白浓度,计算24 h尿蛋白含量。
1.2.4 生化分析与肾重指数测定:给药4周后,抽取各组大鼠血样,EDTA抗凝。检测各项指标:血糖测定采用葡萄糖氧化酶法;三酰甘油(TG)、尿素氮(BUN)及肌酐(Scr)采用全自动生化分析仪进行测定。肾质量指数检测,将小鼠颈椎脱臼处死,称重后记录,取肾,称质量记录,按照肾质量指数=肾质量/(体质量×103)的公式计算肾质量指数。
1.2.5 ELISA检测大鼠血清TGF-β水平:注射地黄多糖12周后心脏采血,3000 r/min离心10 min分离出血清,用ELISA试剂盒检测血清中TGF-β水平。
1.2.6 大鼠肾组织RNA提取:检测各组生化指标后,取各组肌肉组织,用Qiagen组织RNA提取试剂盒进行组织RNA的提取。通过紫外分光光度计测定A260/A280后,计算RNA的浓度,用DEPC水调节所提的RNA至相同浓度。
1.2.7 RT-PCR测定PPARγ信号通路相关基因的表达:用Promega公司的逆转录试剂盒将组织总RNA反转成cDNA,以GAPDH为内参,反应体系为50 μL,其中10×Reaction Buffer 5 μL,dNTP混合物2 μL,引物各1 μL,Taq DNA聚合酶1 μL,ddH2O补加到50 μL 体系。PCR 扩增仪中扩增,检测各组大鼠肾组织PPARγ,aP2以及GLUT4的表达水平。引物序列如下:内参GAPDH上游:ACAGCAACAGGGTGGTGGAC,下游:TTTGA-GGGTGCAGCGAACTT,产物大小为252 bp;PPARγ上游:CACA-AGAGCTGACCCAATGGTTGCTG,下游:CGCAGCTCAGCAGA-CTCTGGGTTC,产物大小为470bp;aP2上游: GACCTGG-AAACTCGTCTCCA,下游: CATGACACATTCCACCACCA,产物大小为349 bp;GLUT4上游: TCTTTGAGATTCGTCCTGGC,下游: TACTGGGTTTCACCTCCTGC,产物大小为312 bp。反应条件:94 ℃,5 mim;94 ℃,5 mim,60 ℃,30 s,72 ℃,30 s,40个循环;72 ℃,5 min,4 ℃保存。
1.2.8 Western blot检测PPARγ信号通路相关蛋白表达:检测各组大鼠生化指标后,取各组大鼠骨骼肌组织,用Qiagen 组织提取试剂盒进行组织总蛋白的提取。SDS-PAGE凝胶电泳分离,恒流300 mA转移至PVDF膜。5%脱脂牛奶封闭2 h后,加入一抗,4 ℃孵育过夜。次日PBST洗膜,二抗室温孵育2 h,PBST洗膜。用化学发光法显色,凝胶成像系统采集成像。以β-actin为内参,检测PPARγ、aP2及GLUT4蛋白的表达水平。
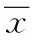
2 结果
2.1 造模对大鼠生化指标及基因的影响 DN模型组24 h蛋白、肾质量指数、血糖、TGF-β、TG、BUN和Scr高于正常对照组,PPARγ/GAPDH、aP2/GAPDH和GLUT4/GAPDH低于正常对照组(P<0.01)。见表1、表2。
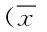
表1 正常对照组与DN模型组大鼠各指标比较±s)Tab.1 Comparison of indexes between normal control group and DN model ±s)
**P<0.01,与对照组比较,compared with control group
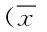
表2 正常对照组与DN模型组大鼠各指标比较±s)Tab.2 Comparison of indexes between normal control group and DN model ±s)
2.2 地黄多糖对DN生化指标及基因表达的影响 不同剂量组间各指标的差异均有统计学意义,3个时间点24 h尿蛋白、血糖、TGF-β、aP2/GAPDH和GLUT4/GAPDH组间两两比较差别均有统计学意义,aP2/GAPDH和GLUT4/GAPDH随着剂量增加而增高,其余指标随着剂量增加而降低。其余指标组间两两比较结果见表3、表4。
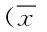
表3 DN模型组及不同剂量组大鼠各指标比较±s)Tab.3 Comparison of indexes between DN model group different and dose group ±s)
*P<0.05,与DN模型组比较,compared with DN model group;#P<0.05,与低剂量组比较,compared with the low dose group;△P<0.05:与中剂量组比较,compared with middle dose group
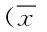
表4 DN模型组及不同剂量组大鼠各指标比较±s)Tab.4 Comparison of indexes between DN model group different and dose group ±s)
*P<0.05,与DN模型组比较,compared with DN model group;#P<0.05,与低剂量组比较,compared with the low dose group;△P<0.05:与中剂量组比较,compared with middle dose group
2.3 地黄多糖高剂量组与罗格列酮对DN生化指标及基因表达影响的比较 2组间3个时间点24 h尿蛋白、血糖、TGF-β、GLUT4/GAPDH比较差别均有统计学意义,地黄多糖高剂量组GLUT4/GAPDH仍低于罗格列酮组,其余指标仍高于罗格列酮组;2组肾质量指数、TG、BUN、Scr和aP2/GAPDH比较差别无统计学意义。见表5、表6。
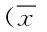
表5 高剂量组与罗格列酮组大鼠各指标比较±s)Tab.5 Comparison of indexes between high dose group rats and rosiglitazone ±s)
*P<0.05,与罗格列酮组比较,compared with rosiglitazone group
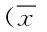
表6 高剂量组与罗格列酮组大鼠各指标比较±s)Tab.6 Comparison of indexes between high dose group rats and rosiglitazone ±s)
*P<0.05,与罗格列酮组比较,compared with rosiglitazone group
2.4 地黄多糖对各组大鼠PPARγ、aP2及GLUT4 蛋白表达水平影响 Western blot结果如图2所示,与对照组相比,模型组大鼠肌肉组织中的PPARγ 及其下游基因aP2和GLUT4 蛋白表达水平显著降低,地黄多糖注射组DN大鼠PPARγ、aP2及GLUT4表达相对于模型组升高,并且地黄多糖剂量越高,其蛋白表达升高越明显。
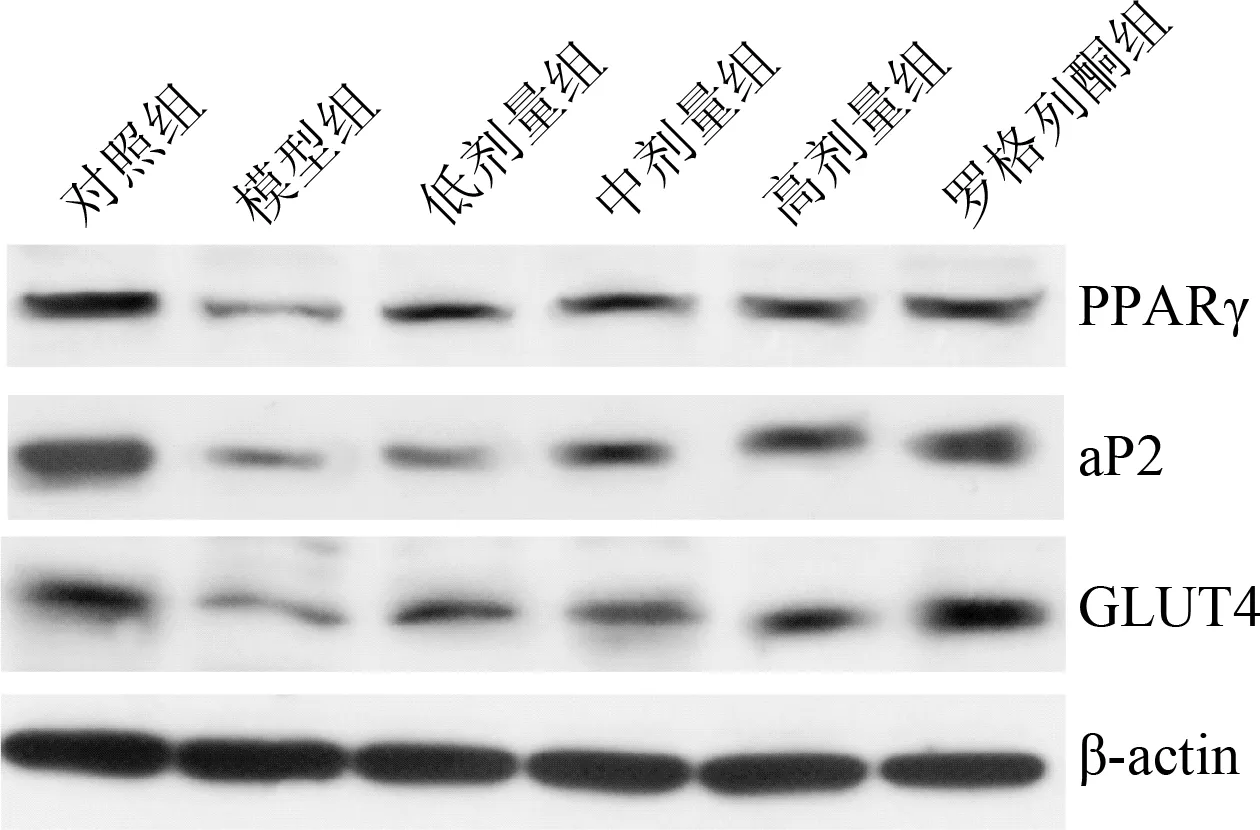
图1 各组大鼠PPARγ,aP2以及GLUT4 蛋白表达水平Fig.1 The expressiom level of PPARγ,aP2 and GLUT4 protein in rats of all groups
3 讨论
糖尿病肾病(DN)是糖尿病最常见的并发症之一[6],也是引起糖尿病患者死亡的重要原因,至今其确切发病机制尚未阐明[7]。近年来,中医临床辨证治疗糖尿病肾病的研究越来越多[8],中药在DN治疗方面也取得一定进展[9],研究表明,许多单味中药及其提取物具有降糖、降脂及改善肾功能的作用[10],可作为临床治疗DN的潜在有效药物。地黄(Rehmanniaglutinosa,RG)为玄参科植物地黄的干燥块根,是一种常见中药,能改善进行性肾功能衰竭和糖尿病肾病[11],地黄多糖作为地黄的有效成分之一,具有增强造血功能,降低血糖,抑制肿瘤生长等作用。
为探究地黄多糖是否对糖尿病肾病有治疗作用,本研究首先采用单肾切除加单次腹腔注射STZ 法构建了DN大鼠模型,造模后24 h蛋白、肾质量指数、血糖、TGF-β、TG、BUN和Scr高于正常对照组,说明该造模方法成功有利于后续研究。造模成功后,向DN大鼠注射不同剂量的地黄多糖进行疗效观察。结果显示,注射地黄多糖后,与对照组相比,大鼠24 h尿蛋白量、肾质量指数和血糖都显著降低(P<0.05),并且降低程度与地黄多糖的剂量呈正相关。并且,注射地黄多糖后,大DN鼠血TG、BUN以及Scr水平也显著降低,说明地黄多糖对DN大鼠肾功能恢复具有一定作用。为进一步研究地黄多糖的治疗作用,本研究比较了高剂量组地黄多糖与罗格列酮组各项指标,结果显示,地黄多糖高剂量组GLUT4/GAPDH略低于罗格列酮组,其余指标略高于罗格列酮组,提示,30 mg/kg地黄多糖的疗效略低于与罗格列酮,后续可以加大地黄多糖剂量进一步研究。另外本实验发现,地黄多糖能够显著降低DN大鼠血清中糖尿病肾病重要的致病因子TGF-β的水平,以上结果表明,地黄多糖对糖尿病肾病大鼠的确有一定的治疗作用。
过氧化物酶增殖物激活受体(PPAR)是一类配体激活的核转录因子,其亚型之一PPARγ在降低血糖、调节脂类代谢和抗炎过程中发挥重要作用[12,13]。研究表明,其激动剂罗格列酮对糖尿病肾病具有显著的治疗作用[14-15]。本研究以罗格列酮治疗DN大鼠组作为阳性对照,探索地黄多糖对DN大鼠的治疗作用是否是通过对PPARγ信号通路的调控作用实现的。
本研究首先检测了地黄多糖对PPARγ下游调控脂类储存和代谢的靶基因aP2的调控作用,结果显示,地黄多糖能够上调aP2在DN大鼠的转录和翻译水平,与PPARγ激动剂罗格列酮的调节作用是一致的。研究表明,PPARγ配体通过激活PPARγ增强GLUT4的表达而促进葡萄糖的摄取[16],因地黄多糖有降低血糖作用,本研究接着检测了其GLUT4在DN大鼠表达的影响,结果显示地黄多糖能够上调GLUT4在DN大鼠的转录和翻译的水平,与PPARγ激动剂罗格列酮的调节作用一致,说明地黄多糖在一定程度上可激活PPARγ信号通路。
综上所述,地黄多糖对糖尿病肾病大鼠有一定的治疗作用,其作用可能是通过激活PPARγ信号通路实现的,当然,其具体分子机制还有待在体外细胞水平上进一步验证,地黄多糖对糖尿病肾病的治疗效果以及能否成为治疗糖尿病肾病的有效药物也需要临床样本的进一步验证。
[1] 蔡春沉,王洪玺,王肃.地黄多糖对肥胖糖尿病大鼠模型的治疗作用及对血清中 GLP-1,GIP水平的影响[J].中国老年学杂志,2013,33(18): 4506-4507.
[2] 崔瑛.地黄多糖药理研究进展[J].中国自然医学杂志,2000,2(3):186-188.
[3] Yang J,Zhou Y,Guan Y.PPARγ as a therapeutic target in diabetic nephropathy and other renal diseases[J].Curr Opin Nephrol Hypertens,2012,21(1):97-105.
[4] 廖丽姿,刘磊,田卫东.PPARγ天然激动剂的研究进展[J],现代生物医学进展,2009,9(7):1381-1383.
[5] 高苹,贾汝汉.两种糖尿病肾病大鼠模型的比较[J].中国中西医结合肾病杂志,2007,8(6):316-319 .
[6] Giacco F,Du X,D’Agati VD,et al.Knockdown of glyoxalase 1 mimics diabetic nephropathy in nondiabetic mice[J].Diabetes,2014,63(1): 291-299.
[7] Sun YM,Su Y,Li J,et al.Recent advances in understanding the biochemical and molecular mechanism of diabetic nephropathy.Biochemical and biophysical research communications[J].Biochem Biophys Res Commun,2013,433(4):359-361.
[8] 周强,仝小林,刘桂芳,等.糖尿病肾病的中医临床治疗概况[J].中医药信息,2011,28(1):95-97.
[9] 孙富华.中医药干预糖尿病肾病的治疗进展[J].哈尔滨医药,2014,1(34): 58-59.
[10] 张新颖,钱秋海,王营营.单味中药及其提取物治疗糖尿病肾病研究进展[J].云南中医中药杂志,2013,34(12):84-85.
[11] 赵晓娟,王德云,胡元亮,等.地黄多糖体外对小鼠淋巴细胞增殖及树突状细胞活性的影响[C].中国畜牧兽医学会中兽医学分会,2013 年学术年会论文集.
[12] Wang FF,Mullican SE, Dispirito JR,et al.Lipoatrophy and severe metabolic disturbance in mice with fat-specific deletion of PPARγ[J].Proc Nati Acad Sci,2013,110(46): 18656-18661.
[13] 张宁,孟爱民,王莉莉,等.PPARγ调节剂治疗二型糖尿病的分子机制研究进展[J].中国药理学通报,2013,29(2):157-160.
[14] 汤文兵.罗格列酮联合卡托普利治疗早期糖尿病肾病的疗效分析[J].医学临床研究,2013,30(12): 2366-2368.
[15] Breunig IM,Shaya FT,McPherson ML,et al.Development of heart failure in Medicaid patients with type 2 diabetes treated with pioglitazone,rosiglitazone,or metformin[J].J Manag Care Pharm,2014,20(9): 895-903.
[16] Gandhi GR,Stalin A,Balakrishna K,et al.Insulin sensitization via partial agonism of PPARγ and glucose uptake through translocation and activation of GLUT4 in PI3K/p-Akt signaling pathway by embelin in type 2 diabetic rats[J].Biochim Biophys Acta, 2013,1830(1):2243-2255.
(编校:谭玲)
Therapeutic effect of rehmannia polysaccharide on diabetic nephropathy rat model and its effects on PPARγ signal pathway
KANG Wei, WANG SuΔ
(Department of Endocrine, The Fifth Central Hospital, Tianjin 300450, China)
ObjectiveTo investigate therapeutic effect and molecular mechanism of RPS on Diabetic Nephropathy rats.MethodsDN rats were induced by STZ injection and grouped into model group,low-dose RPS group,middle-dose RPS group,high-dose RPS group,Rosiglitazone group and normal group.24 h urine protein,kidney weight index,blood glucose level and TG, BUN and Scr level in normal and DN rats were detected.TGF-β level of serum of rats in all groups by ELISA were detected.mRNA and protein expression level of PPARγ,aP2 and GLUT4 by RT PCR and Western blot were also detected.ResultsDN rats were induced successfully because the 24 h urine protein, kidney weight index and the levels of blood sugar and TG,BUN,Scr l and TGF-βevels, and the mRNA level of PPARγ,aP2 and GLUT4 level in DN rats increased than normal group(P<0.05).The mRNA level of PPARγ,aP2 and GLUT4 level increased(P<0.05) and other indexes decreased(P<0.05) as the doses of RPS increasing.The therapeutic effects of Rosiglitazone group was better than high dose PRS group.The protein level of PPARγ, aP2 and GLUT4 in DN rat skeletal muscle were significantly lower than normal group(P<0.05), and RPS can increase their expression level obviously.ConclusionRPS has a dose-dependent therapeutic effect on DN rats by improving the expression level of related protein in PPAR gamma signaling pathways.
diabetic nephropathy; GLUT4; PPARγ; rosiglitazone
康伟,女,本科,副主任医师,研究方向:糖尿病肾病的发病机制及治疗,E-mail:kangweitianjin@163.com;王肃,通讯作者,女,硕士,主任医师,研究方向:糖尿病肾病的发病机制及治疗,E-mail:tianjinkang123@126.com。
R285
A
1005-1678(2015)09-0030-05

