MR干细胞标记在替莫唑胺干预脑胶质瘤血管生成及治疗研究中的应用
陈伟志,杨重恒
(1.辽宁医学院附属第一医院 放射科,辽宁 锦州 121001;2. 辽宁医学院附属第一医院 口腔科,辽宁 锦州 121001)
MR干细胞标记在替莫唑胺干预脑胶质瘤血管生成及治疗研究中的应用
陈伟志1Δ,杨重恒2
(1.辽宁医学院附属第一医院 放射科,辽宁 锦州 121001;2. 辽宁医学院附属第一医院 口腔科,辽宁 锦州 121001)
目的 探究MR干细胞标记在替莫唑胺干预脑胶质瘤血管生成及治疗中的作用。方法 通过C6胶质瘤细胞株静脉注射建立大鼠脑胶质瘤的动物模型,采用MR干细胞标记技术以及免疫组化观测肿瘤生长及新生血管的生成,对比影像学与免疫组化检测结果,进行2者间的相关性分析。结果 本研究成功运用MR扫描示踪SPIO-PLL共同标记的骨髓干细胞,动态检测了脑胶质瘤模型大鼠脑内肿瘤血管生成情况。影像学与免疫组化相关性分析结果显示,2者呈现良好的负相关性(P<0.05)。结论 SPIO对于骨髓干细胞的磁性标记标记和MR示踪技术是活体动态观察脑胶质瘤血管生成的有效手段。
MR;干细胞标记;脑胶质瘤;血管生成
近年来,恶性肿瘤的发病率及死亡率正呈逐年上升的趋势严重威胁着人类健康,其中胶质瘤是脑部最常见、浸润性最强的原发性肿瘤,其侵袭性的生长方式导致术后复发率高,治疗效果不理想[1-2]。肿瘤的发展与血管的生成密不可分,无论原发性还是转移性,肿瘤的持续生长都必须依赖于血管的新生,目前抗肿瘤血管生成是肿瘤治疗的研究热点之一,监测肿瘤的血管新生情况也成为有效的抗肿瘤治疗评价指标[3-4]。磁性标记骨髓干细胞能够直接显示肿瘤的新生血管,评价抗血管生成的治疗效果,使活体检测肿瘤的新生血管及抗血管生成治疗效果成为可能[5-6]。本研究采用超顺磁氧化铁(superparamagnetic iron oxide,SPIO)及聚左旋赖氨酸(PLL)进行大鼠脑胶质瘤的干细胞标记及MR示踪,观察肿瘤的血管生成及治疗情况。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞:1月龄雄性SPF级SD大鼠5只,体质量(100±12)g;2月龄雄性SPF级SD大鼠50只,体质量(200±25)g(大连医科大学实验动物中心,合格证号:2014-7A004);胶质瘤细胞为C6胶质瘤细胞株。
1.1.2 药品与试剂:胎牛血清(美国Hyclone公司);DMEM培养基(美国Gibco公司);胰酶(Shanghai生物工程技术服务有限公司);替莫唑胺(江苏天士力帝益药业有限公司);聚左旋赖氨酸(Sigma公司);超顺磁氧化铁(德国拜尔公司)。
1.1.3 实验仪器:HH.CP-01型CO2培养箱(上海凯朗仪器设备厂);CKX41倒置显微镜(日本奥林巴斯);ACB-A超净工作台(新加坡艺思高科技有限公司);1.5 T磁共振成像系统(Sonata Siemens公司)。
1.2 方法
1.2.1 骨髓干细胞分离及培养:取体重指数为(100±12)g的大鼠,颈椎脱臼处死后,取动物的胫骨及股骨,用不加血清的DMEM培养基冲洗骨髓腔,获得的细胞悬液2000 rpm离心 3 min, 弃去上清,沉淀中加入含有10%胎牛血清的DMEM培养基,反复吹打制成细胞悬液并计数,以2×107个/mL接种入含10%胎牛血清的DMEM培养基内,置于CO2培养箱中,37 ℃,5%CO2的条件下培养,每2 d换液1次,每周传代1次,传代至第4代时-20 ℃冻存备用。
1.2.2 骨髓干细胞的SPIO-PLL共同标记:将20 g/mL的磁性标记物SPIO与0.4 μg/mL的PLL混合,并加入到含有骨髓干细胞DMEM培养基中,37 ℃条件下孵育24 h。
1.2.3 大鼠脑胶质瘤模型的建立:采用立体脑定位仪对大鼠进行固定,于冠状缝向前1 mm,中线旁开3 mm,深度5 mm处用微凉注射器注射C6胶质瘤细胞悬液5 μL,速度为1 μL/min。
1.2.4 SPIO-PLL共同标记的骨髓干细胞的移植:注射C6胶质瘤细胞2周后,对于大鼠进行MR扫描观察肿瘤生长情况,对50只大鼠进行造模,选取造模成功的40只进行试验,尾静脉注射SPIO-PLL共同标记的骨髓干细胞悬液0.5 mL。
1.2.5 实验动物分组及给药:将40只已标记的模型大鼠随机分成2组,每组20只,分别为替莫唑胺组和对照组,替莫唑胺组按照1 mg/kg给予替莫唑胺,1次/周,连续给药2周,对照组给予等量生理盐水。
1.2.6 MR示踪脑胶质瘤内SPIO-PLL共同标记的骨髓干细胞分析方法:分别于标记的骨髓干细胞的移植前1 d,给药前 1 d 以及给药2周后1、2 d进行MR检查,项目包括T1 WI,T2WI以及T2*map。T1 WI扫描:TE=400 ms,TR=9.5 ms;T2WI扫描:TE=3000 ms,TR=45 ms;T2*map扫描TE=3000 ms,TR=2.5-37 ms;采用常规横断位扫描层厚度1.0 mm,层间距0.0 mm,层数10,FOV=50-80 mm。观察和分析T1 WI ,T2WI以及T2*map图像上大鼠脑胶质瘤的形态,信号特征,边缘等情况,计算肿瘤体积。
1.2.7 MR扩散加权成像扫描分析方法:采用SE-EPI的序列中10个扩散敏感度的b值进行加权扩散成像,采用横断位扫描。TE=1800 ms,TR=85 ms,层厚度1.0 mm,层间距0.0 mm,层数10,FOV=70 mm。将不同b值的DWI图像输入Biomap软件中进行拟合,得到10个不同b值的表观扩散系数(ADC10b),对照组和替莫唑胺组分别于治疗前、治疗后5 d以及治疗后10d随机选取12、14、14只大鼠进行ADC10b拟合。
1.2.8 免疫组化检测:2组分别于治疗后5 d、10 d各14只大鼠经MR扫描后处死相应组别大鼠,取出瘤体并用10%甲醛固定,经石蜡包切片、脱蜡至水,治疗后5 d、10 d各14个的样本随机平均分成两组分别进行后进行微血管密度(MVD)计数和血管内皮生长因子(VEGF)表达的检测。经过石蜡包埋,切片,脱蜡至水,热修复,3%过氧化氢的PBS封闭内源性过氧化物酶,分别滴加一抗CD34(1:100)、一抗VEGF(1:100),4 ℃过夜,冲洗,滴加二抗20 min,冲洗,DAB显色,苏木精复染,PBS返蓝,脱水,封片。2组分别于治疗后5、10 d经MR扫描后处死相应组别大鼠,取出瘤体并用10%甲醛固定,经石蜡包切片、脱蜡至水后进行微血管密度(MVD)计数和血管内皮生长因子(VEGF)表达的检测。
1.2.9 ADC10b拟合结果与免疫组化结果相关性分析:分别将2组MR扩散加权成像扫描中不同b值拟合出的ADC10b与免疫组化检测中获得的MVD计数及VEGF计分进行Pearson线性相关性的分析。

2 结果
2.1 常规MR示踪检测结果 在注射SPIO-PLL共同标记的骨髓干细胞前的模型大鼠的MR扫描结果可见大鼠脑右侧基底节区域显示T1WI信号稍低,T2WI信号稍高,肿瘤瘤体区域强化,肿瘤区域T2*map可见线状针道信号,而肿瘤组织的T2*map信号未见明显异常。将 T2WI 数据输入 Biomap 软件内进行拟合,获得肿瘤组织的体积, 所有模型大鼠肿瘤的体积分布在50 mm3-100 mm3之间。划取3次最大感兴趣区,取其平均值计算肿瘤体积注射SPIO-PLL共同标记的骨髓干细胞后的模型大鼠的MR扫描结果可见,T1WI和T2WI在肿瘤区域周围均有低信号出现,但信号有逐渐消散的趋势,表明被标记的骨髓干细胞开始迁移和分化,由此可以证实SPIO-PLL标记的骨髓干细胞向瘤体迁移的进程可以被MR所示踪。在给予抗肿瘤药物治疗后可见T2WI上出现一部分肿瘤信号不均匀,呈现斑块状的高信号液化坏死区域。见图1。

图1 治疗前后模型大鼠常规MR扫描(n=3)Fig.1 Conventional MR scan in the model rats pre- and post-treatment(n=3)
2.2 ADC10b拟合 治疗前替莫唑胺组和对照组的ADC10b值没有显著性差异,ADC图像显示肿瘤区呈现低信号,肿瘤边界清晰。治疗后5d和10d时,替莫唑胺组的ADC10b均高于对照组(P<0.05)。ADC图像上显示信号不均匀的现象,并可见斑块状液化坏死区域。见表1、图2。
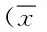
表1 2组脑胶质瘤模型大鼠治疗前后不同时段ADC10b值的测量结果±s)Tab.1 The measurement results of different time ADC10b value of the two groups pre-and post-treatment of brain glioma ±s)
*P<0.05,与对照组相比,compared with control group

图2 治疗前后ADC10b图Fig.2 ADC10b figure pre-and post-treatment
2.3 免疫组化检测结果 替莫唑胺组在治疗后5 d和10 d,MVD计数值低于对照组(P<0.05)。在VEGF计分检测中,替莫唑胺组在治疗后5 d和10 d,VEGF计分值低于对照组(P<0.05)。见表2、表3、图3、图4。
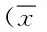
表2 2组脑胶质瘤模型大鼠治疗后不同时段MVD计数的测定结果±s)Tab.2 The determination results of MVD counting of rat brain glioma model after treatment in different periods of two ±s)
*P<0.05,与对照组相比,compared with control group

表3 2组脑胶质瘤模型大鼠治疗后不同时段VEGF计分的 测定结果Tab.3 Determination results of VEGF score of rat brain glioma model after treatment in different periods of two ±s)
*P<0.05,与对照组相比,compared with control group

图3 2组脑胶质瘤模型大鼠治疗后不同时段MVD结果图A:替莫唑胺组治疗后5 d;B:替莫唑胺组治疗后10 d;C:对照组治疗后5 d;D:对照组治疗后10 dFig.3 MVD results of brain glioma model between two groups atdifferent time post-treatmentA: temozolomide group 5 d after post-treatment;B: temozolomide group 10 d after post-treatment;C: control group 5 d after post-treatment;D: control group 10 d after post-treatment
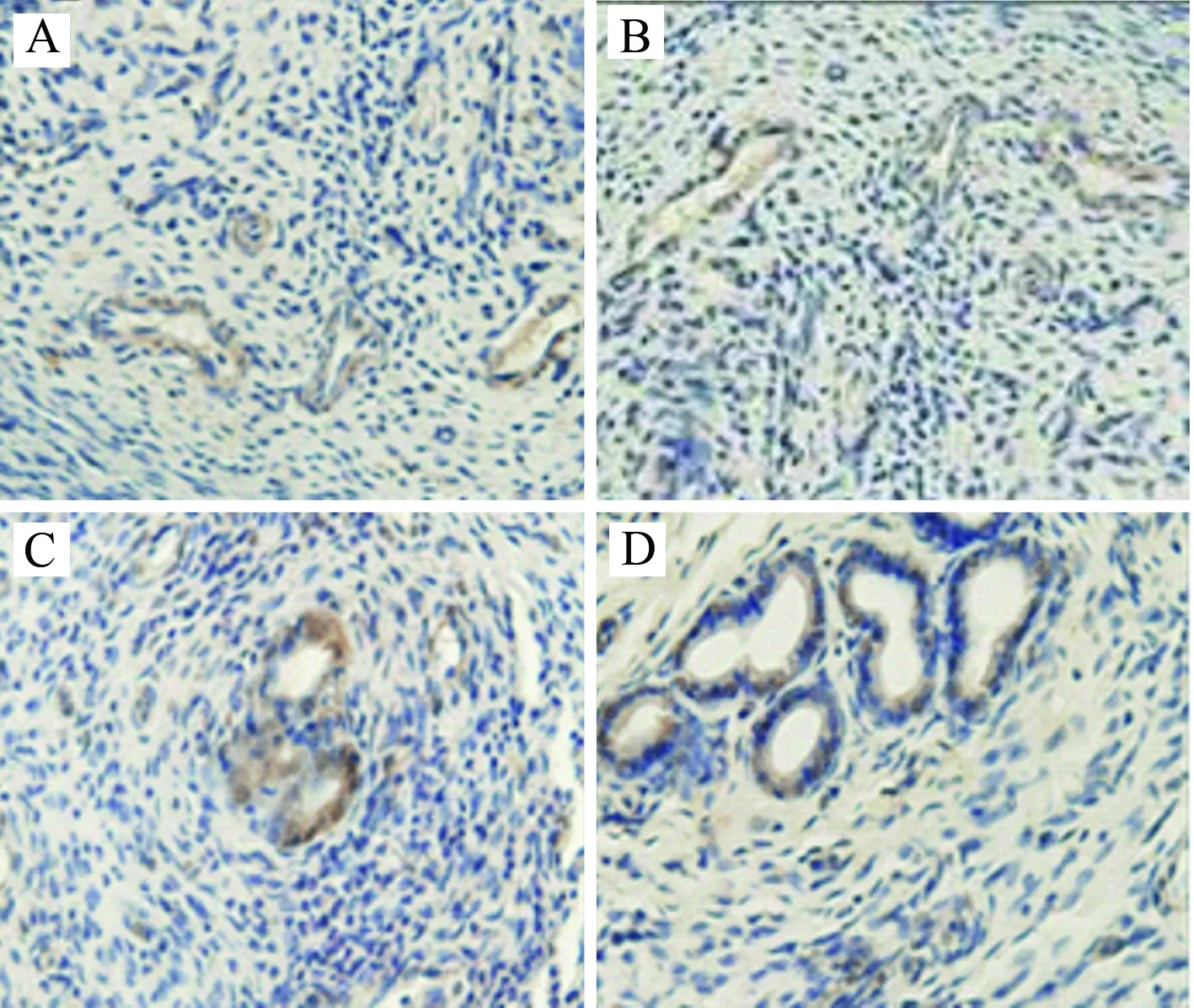
图4 2组脑胶质瘤模型大鼠治疗后不同时段VEGF结果图A:替莫唑胺组治疗后5 d;B:替莫唑胺组治疗后10 d;C:对照组治疗后5 d;D:对照组治疗后10 dFig.4 VEGF results of brain glioma model between two groups atdifferent time post-treatment A: temozolomide group 5 d after post-treatment;B: temozolomide group 10 dafter post-treatment;C: control group 5 d after post-treatment;D: control group 10 d after post-treatment
2.4 ADC10b拟合结果与免疫组化结果相关性分析 分别将2组MR扩散加权成像扫描中不同b值拟合出的ADC10b与免疫组化检测中获得的MVD计数及VEGF计分进行Pearson线性相关性的分析。结果显示,ADC10b与免疫组化检测中获得的MVD计数(r=-0.647,P=0.000)及VEGF计分(r=-0.571,P=0.000)均显示出良好的负相关性,结果具有统计学意义(P<0.05)。这充分说明了采用MR示踪SPIO-PLL共同标记的骨髓干细胞方法进行脑胶质瘤血管生成的检测是可行的。
3 讨论
肿瘤的新生血管在肿瘤的生长与转移中具有十分重要的作用,它不仅为肿瘤的生长提供血液等营养物质,更为肿瘤细胞的浸润和转移提供通道[7]。病理学中常采用MVD来评判肿瘤的血管生成情况。CD34是血管内皮细胞特异性标记物之一,能够特异性的表达于血管内皮细胞,MVD可以借助于CD34特异性表达从而直接定量的反映肿瘤组织的血管生成情况[8-9]。血管的新生依赖于多种细胞因子的调控,其中血管内皮生长因子(VEGF)是目前已知的最强的血管渗透剂,可以增加微血管的渗透性,促进血管内皮细胞增殖、迁移,诱导毛细血管管腔的形成,达到促进血管生成的作用。VEGF体内促进血管内发生,体外促进内皮细胞增生,VEGF不仅对血管内皮细胞有趋化和生长刺激作用,而且诱导产生相关的蛋白产物参于血管外基质的降解,使VEGF从基质中释放,参与血管的形成[10-12]。
虽然MVD和VEGF等指标均能有效地反映机体内肿瘤组织的血管生成情况,但在临床应用中存在诸多限制,不能进行实时、动态、可重复的操作和观察。随着分子影像学技术的发展,新的影像学技术能显示早期的细胞代谢及血流灌注等相关信息,其中MR以其安全无辐射、可定量等优势在观察机体内肿瘤的变化和发展方面越来越受到关注[13-14]。在体外使用SPIO对目标干细胞进行标记,通过转染剂的修饰进一步提高有效磁标记率,利用磁共振成像追踪干细胞的增殖、移行等情况来判断肿瘤组织的变化,从而达到实时、高效、可重复的观察目的,有利于临床的治疗与研究的开展[15]。
同时,本研究采用相关性分析,进一步验证了MR示踪SPIO-PLL共同标记的骨髓干细胞方法进行脑胶质瘤血管生成的检测的可行性。本研究中选取的ADC10b与细胞增值的情况密切相关,可以动态的反映肿瘤区域血管增值的情况,实验结果表明其变化与免疫组化的结果呈现良好的负相关性,且在可操作性、数据采集的连续性以及患者依从性方面较免疫组化方法更加具有优势。随着该项技术在实验和临床实践中的不断进步,它将会得到越来越广泛的应用。
[1] 葛竑,纪红.呋喃二烯康脑胶质瘤的研究[J].中国新药杂志,2015,24(9):1053-1056.
[2] 冯利明,罗林.胶质瘤的现代治疗进展[J].云南医药,2015,36(1):78-80.
[3] 刘艳,杨林.脑胶质瘤抗血管生成的治疗进展[J].安徽医学,2015,36(3):371-374.
[4] 刘志勇,孙保存.肿瘤干细胞与肿瘤血管异质性[J].中国肿瘤临床,2014,41(2):134-137.
[5] 牛艳君,李莹,白仲添,等.干细胞标记及示踪技术的应用研究[J].基础医学与临床,2015,35 (4):528-530.
[6] 巩青松.SPIO标记干细胞移植后MR活体示踪的研究进展[J].中国癌症防治杂志,2012,4(3):291-294.
[7] 杨丹,王继华.肿瘤血管供应模式及其分子机制[J].中南医学科学杂志,2014,42(2):196-200.
[8] Rahmah NN, Sakai K, Sano K, et al. Expression of RECK in endothelial cells of glioma: comparison with CD34 and VEGF expressions[J]. J Neurooncol, 2012, 107(3):559-564.
[9] 杜学松,刘恒,陈晓,等.动态对比增强MRI评价大鼠C6胶质瘤肿瘤边缘新生血管的实验研究[J].中国医学影像学杂志,2015,23(2):81-86.
[10] Kim BS, Kim SK, Choi SH, et al. Prognostic implication of progression pattern after anti-VEGF bevacizumab treatment for recurrent malignant gliomas[J]. J Neurooncol, 2015, 124(1): 101-110.
[11] 隋锐,张烨,陈一,等.MMP-2及VEGF在脑胶质瘤中的表达及其临床意义[J].华南国防医学杂志,2014,28(5):443-444.
[12] 于慧玲,麻春杰,盖聪.小柴胡汤对C6胶质瘤大鼠ESM-1、VEGF表达的实验研究[J].中国实验诊断学,2014,18(5):708-711.
[13] 刘丽.肿瘤血管生成的影像学评价及新进展[J].医学研究生学报,2012,25(10):1102-1108.
[14] 陈伟志.内皮祖细胞磁性标记及MR示踪在大鼠脑胶质瘤血管生成研究中的应用[J].中国老年学杂志,2013,33(15):3682-3684.
[15] 李祥,朱文珍,魏黎.氧化铁纳米粒子神经干细胞标记技术的比较研究[J].中国医学影像学杂志,2014,22(1):7-11.
(编校:王冬梅)
Application of MR stem cell markers in research of temozolomide intervention gliomas angiogenesis and therapy
CHEN Wei-zhi1Δ, YANG Zhong-heng2
(1.Department of Radiology, First Affiliated Hospital of Liaoning Medical University, Jinzhou 121001, China; 2. Department of Stomatology, First Affiliated Hospital of Liaoning Medical University, Jinzhou 121001, China)
ObjectiveTo explore the role of MR stem cell markers in temozolomide intervention gliomas angiogenesis and therapy.MethodsC6 glioma cells were intravenously injected in glioma model rat. MR stem cell markers and immunohistochemistry were used to observe the tumor growth and angiogenesis. Correlation of contrast imaging and immunohistochemistry results were studied.ResultsIn this study, MR scanning was successfully used to trace the SPIO-PLL marked bone marrow stem cells, dynamic testing of angiogenesis in rat brain glioma tumor. Correlation analysis of imaging and immunohistochemical showed that they had a good negative correlation (P<0.05).ConclusionSPIO magnetic markers for bone marrow stem cells and MR tracing technique is an effective means of dynamic observation in vivo glioma angiogenesis.
MR; stem cell markers; glioma; angiogenesis
国家自然科学基金计划(2013022027)
陈伟志,通信作者,男,硕士,主治医师,研究方向:神经影像诊断,E-mail:lnchenwwizhi@163.com。
R445
A
1005-1678(2015)12-0009-04

