GM-CSF分泌型肝癌疫苗对移植性肝癌小鼠CTL杀伤活性的作用机制
吴天山,肖开提·伊布拉因Δ,阿尔帕提·买买提,李相成
(1.新疆医科大学第一附属医院 急诊外科,新疆 乌鲁木齐 830054;2.南京医科大学 临床医学系,江苏 南京 210029)
GM-CSF分泌型肝癌疫苗对移植性肝癌小鼠CTL杀伤活性的作用机制
吴天山1,肖开提·伊布拉因1Δ,阿尔帕提·买买提1,李相成2
(1.新疆医科大学第一附属医院 急诊外科,新疆 乌鲁木齐 830054;2.南京医科大学 临床医学系,江苏 南京 210029)
目的 研究粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)分泌型肝癌疫苗对移植性肝癌小鼠细胞毒性T淋巴细胞杀伤活性的作用机制。方法 本实验建立3个组别:肝癌疫苗组(A组),肝癌组(B组)及PBS对照组(C组)。在小鼠体内注入H 22肝癌细胞构建移植性肝癌组,同时建立GM-CSF分泌型肝癌疫苗组及PBS对照组;采用流式细胞术检测每组小鼠外周血中CD8+T细胞免疫效应分子的表达水平;采用MTT方法检测各组脾细胞细胞毒T淋巴细胞(CTL)的杀伤活性;采用Western blot方法检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和γ-干扰素(γ-interferon,γ-INF)的表达水平。结果 流式细胞术结果表明,与肝癌组相比,GM-CSF分泌型肝癌疫苗可显著地增加小鼠外周血中CD8+T细胞的表达(P<0.01);MTT结果表明,与肝癌组相比,GM-CSF分泌型肝癌疫苗可显著地增加脾细胞细胞毒T淋巴细胞的杀伤活性(P<0.01);Western blot结果表明,与肝癌组相比,GM-CSF分泌型肝癌疫苗组可显著下调TNF-α和γ-INF蛋白的表达(P<0.01)。结论 GM-CSF分泌型肝癌细胞疫苗可显著地抑制H22肝癌细胞H22的活性,其作用机制可能是通过活化CD8+T细胞的表达和提高脾细胞细胞毒T淋巴细胞的杀伤活性,降低TNF-α和γ-INF蛋白的表达。
粒细胞巨噬细胞集落刺激因子;移植型肝癌;分泌型肝癌疫苗;细胞毒性T淋巴细胞
肿瘤疫苗是肿瘤治疗的模式之一,相关的治疗方法包括体细胞疗法、放射靶向治疗法、细胞因子治疗法等[1]。以往研究表明[1-2],肿瘤疫苗的抗肿瘤作用机制可能是通过激活体内特异性细胞免疫和体液免疫反应,发挥其治疗肿瘤的作用。佐剂在肿瘤疫苗中发挥着提高免疫原性的作用。在以肿瘤细胞为基础的主动免疫疗法中,粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)佐剂的主动免疫疗法是当前研究的热门课题之一[2]。以往临床试验研究表明,GM-CSF的疫苗免疫佐剂在前列腺癌、肾癌、恶性黑色素瘤等多种癌症治疗中也发挥一定的抗肿瘤疗效[3-5]。因此,本文旨在研究GM-CSF分泌型肝癌疫苗对移植型肝癌小鼠的肝细胞细胞毒性T淋巴细胞杀伤活性作用的影响及其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雌性ICR小鼠60只,5周龄,体质量18~22 g,购自安徽龙科马生物制药有限责任公司,许可证号:SYXK(皖)2006-02。本试验遵循《实验动物保护条例》。
1.1.2 实验细胞:GM-CSF 分泌型细胞(每支0.4 mL,含3×106个细胞)购于康乃欣检验试剂生物技术有限公司;H22小鼠肝癌细胞株(每支0.1 mL,含有3×106个细胞)购于science cell公司。
1.1.3 主要试剂:MTT、原代肿瘤细胞处理试剂盒(美国Sigma公司);DMEM培养基(HyClone公司,批号:NYA0598);胎牛血清(HyClone公司,批号:NM0877);鼠抗β-actin、鼠抗TNF-α抗体、鼠抗γ-INF抗体(Santa Cruz,批号:#L0610);辣根酶标记山羊抗鼠IgG(中山金桥,批号:107015)。
1.2 实验方法
1.2.1 细胞培养:取对数生长期的H 22肝癌细胞,调整成1×105个细胞接种于培养瓶中,采用含有10%胎牛血清的高糖DMEM培养H 22肝癌细胞,将其置于培养箱37 ℃、5%CO2的条件下培养。密切观察,待细胞贴壁生长后,采用0.25%胰蛋白酶消化传代,每3~5 d传代1次。
1.2.2 GM-CSF 分泌型肝癌疫苗的制备:首先将H22肝癌细胞株进行高温灭活处理,再将其和具有GM-CSF分泌功能的细胞混合(2者的比例为5:3),当GM-CSF分泌量大于 2 μg/(106个细胞·24 h)时,将其分装冻存,溶化后每份取1 mL的105/ mL处理后的H22肝癌细胞接种于小鼠淋巴区。
1.2.3 肝癌细胞移植瘤动物模型的建立:将小鼠肝癌细胞株H 22按照3×106个细胞/只注入小鼠腹腔内,在小鼠腹腔内传代8 d后取出腹水,PBS洗涤3遍,将细胞浓度调整为3×106/mL,取细胞混悬液1 mL接种于小鼠右前肢皮下。待接种7天后,进行皮下免疫治疗,接种主动免疫制剂1支(每支0.1 mL)。将上述肝癌细胞移植瘤动物模型随机分为3组(每组8只):A组为H 22-GM-CSF组:接种GM-CSF分泌型H 22肝癌疫苗,0.1 mL的H22肝癌细胞与30 μL的GM-CSF分泌细胞的融合液混合后注射小鼠体内;B组为H22肝癌细胞组:接种H22肝癌细胞疫苗,每只小鼠注射H22肝癌细胞0.1 mL;C组为PBS阴性对照组:接种PBS,每只小鼠注射0.1 mL PBS。每周免疫注射1次,总共注射3次。
1.2.4 外周血中CD8+T细胞免疫效应的检测:分别于每组免疫前和免疫后7 d处死小鼠,采取腹主动脉法取荷瘤鼠外周血液,用流式细胞仪检测CD8+T细胞免疫效应分子的表达水平。
1.2.5 小鼠脾细胞细胞毒T淋巴细胞细胞杀伤活性的检测:将免疫前和免疫结束后的小鼠分别处死后,提取其相应的脾细胞,制备成适当的效应细胞混悬液,将上述效应细胞与H 22肝癌细胞(靶细胞)混合后,对靶细胞进行重复刺激,观察效应细胞对靶细胞的杀伤作用。采用MTT方法进行检测,将对数生长期的小鼠H 22肝癌细胞配成(1×107个/mL)的混悬液接种于96孔板中,每孔加入100 μL的细胞混悬液,设立靶细胞对照组、效应细胞组和空白对照组。加药结束后将其置于培养箱孵育5 h。作用结束后,每孔加入MTT溶液后置于37 ℃的培养箱中孵育4 h,用针头吸出培养上清液,每孔加入100 μL二甲基亚砜震荡溶解甲瓒,采用酶标仪测定各孔吸光度490 nm(absorbance,A)值,计算脾细胞细胞毒T淋巴细胞的杀伤活性,计算公式:杀伤活性(%)=[1-(效/靶混合细胞的平均A值-效应细胞的平均A值)/对照孔的平均A值]×100%。
1.2.6 Western blot检测TNF-α和γ-INF蛋白的表达:分别于免疫前和免疫后7 d处死小鼠,采取腹主动脉法收集荷瘤鼠外周血液,收集外周血中CD8+T细胞后,加入含PMSF的蛋白裂解液150 μL,吹打后置于冰上裂解。离心(5 000 r/min)取上清液即为细胞总蛋白。采用DAB试剂盒(Sigma)检测蛋白含量。采用5% SDS-PAGE 电泳分离蛋白样品;利用PVDF膜进行转膜;转膜完毕后,取出 PVDF 膜,采用PBST清洗3次,每次10 min;加入5%BSA封闭液室温封闭1 h;加入一抗(1:1000)4 ℃冰箱孵育过夜;再用PBST洗膜3次,每次10 min;加入相应的二抗(1:2000),室温孵育1 h;PBST漂洗3次,每次10 min,采用ECL发光试剂盒(Bioword)检测蛋白表达,曝光,显影,定影。经Adobe Photoshop 6.0(Adobe Systems,San Jose,CA)分析蛋白表达。

2 结果
2.1 小鼠外周血中CD8+T细胞免疫效应的检测 采用流式细胞术检测小鼠外周血中CD8+T细胞免疫效应分子的表达水平(荧光抗体CD8-FITC标记细胞表面抗体),每组CD8+T细胞亚群所占比例结果表明,免疫后,A组外周血中的CD8+T细胞的含量明显高于B组、C组(均P<0.01),见表1。

表1 免疫前后各组小鼠外周血中CD8+T细胞免疫效应的检测±s)Tab.1 Detection of CD8+T cell immunity of mice in peripheral blood before and after ±s)
**P<0.01,与B组相比,compared with B group;##P<0.01,与C组相比,compared with C group
2.2 MTT法检测小鼠脾细胞细胞毒T淋巴细胞细胞杀伤活性 每组小鼠分别于免疫前及免疫后7 d处死,收集各组小鼠的脾细胞制备效应细胞的混悬液,以小鼠肝细胞H22(靶细胞)重复刺激后,观察各组效应细胞的杀伤活性。如图所示,与B和C组相比,A组效应细胞的杀伤活性显著性增加(P<0.01);而B组与C组相比无统计学差异。
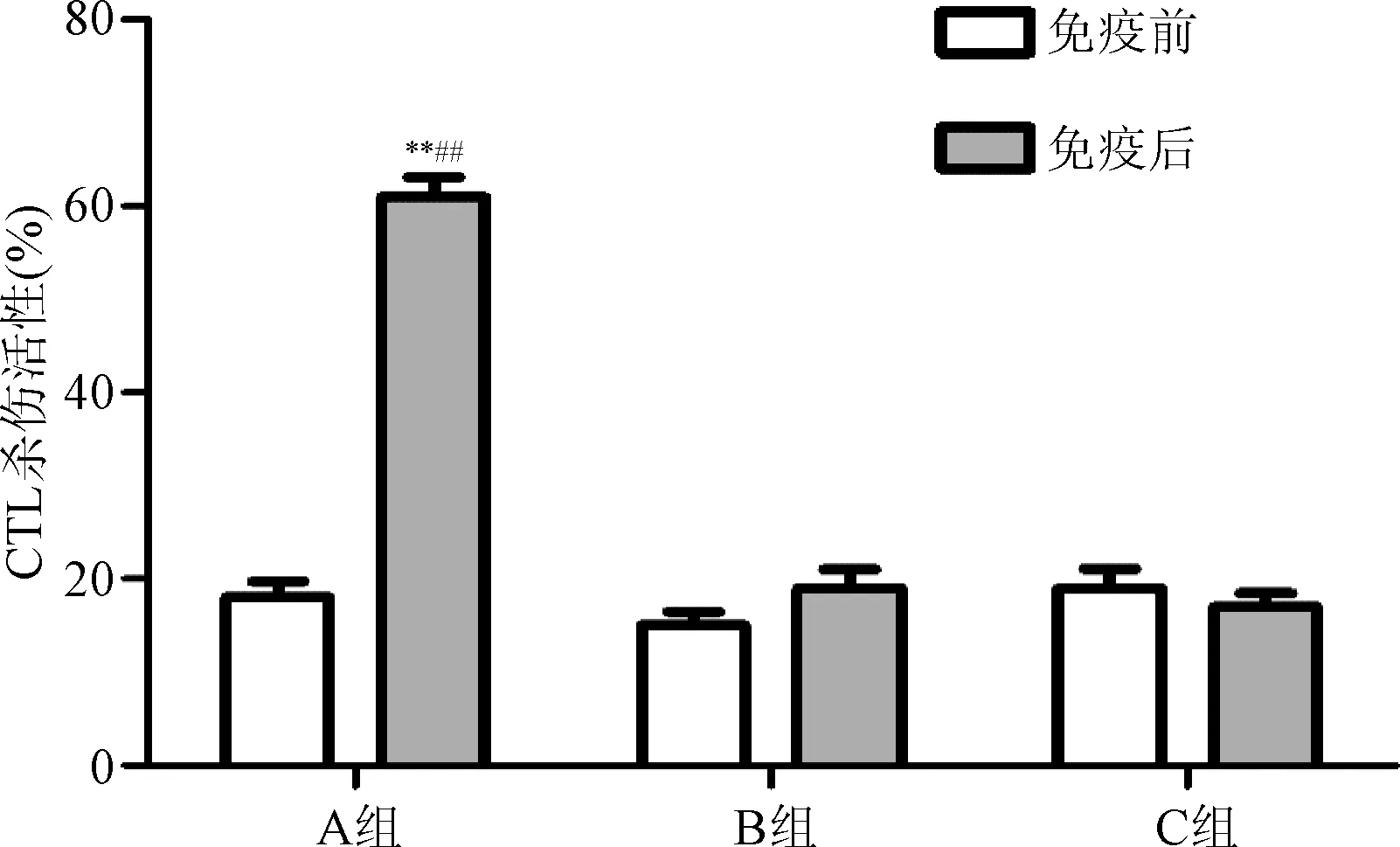
图1 MTT法检测小鼠的CTL的杀伤活性(n=3)A组:H 22-GM-CSF组;B组:H 22肝癌细胞组;C组:PBS组**P<0.01,与B组相比;##P<0.01,与C组相比Fig.1 The cytotoxicity of CTL examined by MTT assay in each group(n=3)A group:H 22-GM-CSF group; B group:H 22 hematoma cells group; C group:PBS group**P<0.01,compared with B group;##P<0.01,compared with C group
2.3 Western blot检测TNF-α和γ-INF蛋白的表达 实验结果显示,与B组和C组相比,A组的TNF-α和γ-INF蛋白的表达均有显著性下调,见图2。

图2 Western blot法检测小鼠的CTL中TNF-α,γ-INF的蛋白表达水平(n=3)A组:H 22-GM-CSF组;B组:H 22肝癌细胞组;C组:PBS组**P<0.01,与B组相比;##P<0.01,与C组相比Fig.2 The expression of TNF-α,γ-INF in CTL examined by Western blot assay in each group(n=3)A group:H 22-GM-CSF group; B group:H 22 hematoma cells group;C group:PBS group**P<0.01,compared with B group;##P<0.01,compared with C group
3 讨论
肿瘤疫苗是目前肿瘤治疗的较为新颖的方法之一。以往研究发现肿瘤疫苗的缺点是由于肿瘤抗原的免疫原性表达较弱,因此机体免疫系统不能识别肿瘤细胞竟而针对性的杀死肿瘤组织[6]。目前,由于免疫辅助剂和药物缓蚀剂的联合应用,免疫抗原的表达水平和主动免疫反应明显提高。GM-CSF作为肿瘤疫苗免疫佐剂,具有刺激造血系统和免疫系统细胞抗原呈递细胞分化和成熟的功能,此外,GM-CSF还具有增强中性粒细胞和巨噬细胞的抗体依赖性细胞介导的细胞毒作用,对粒细胞和巨噬细胞具有趋化作用,诱导树突状细胞的分化和成熟[7-9]。因此,GM-CSF已在黑色素瘤、肾癌、非小细胞肺癌等多种癌症的临床试验中发挥显著的疗效[10-12]。肝癌的治疗方法较多,目前公认的最有效方法是外科切除,但其具有潜在的复发率,因此寻找更为安全的治疗方法显得尤为重要。因此,本文在此探究GM-CSF为免疫佐剂治疗肝癌,为肝癌的治疗提供更多的理论支持。
以往研究表明,肿瘤的发生过程与机体免疫有着紧密的关系,细胞免疫是抗肿瘤免疫的主要免疫应答之一,其中T细胞介导的细胞免疫应答尤为重要。在T细胞抗原应答反应中,组织相容性复合体(MHC I)类限制性的CD8+T细胞的CTL是抗肿瘤免疫反应的主要效应细胞之一[13]。相关研究表明,CD8+T细胞通过多种细胞因子发挥溶细胞作用,进而杀伤肿瘤细胞的效应。目前的研究表明,IL-6、INF-γ、TNF-α、穿孔素、溶细胞素、脂酶等多种细胞因子和酶在溶解靶细胞中发挥着重要的调控作用[14-15]。因此,本实验在此选择检测CD8+T细胞的表达和相关细胞因子蛋白的表达,探究GM-CSF分泌型肝癌细胞疫苗对移植型肝癌的作用及其可能的作用机制。
本次实验的结果表明:与H 22肝癌细胞组和PBS对照组相比,GM-CSF分泌型肝癌疫苗免疫小鼠后,可显著地提高其外周血中CD8+T细胞亚群的表达水平。同时,MTT法检测GM-CSF分泌型肝癌疫苗对CTL的杀伤作用,结果表明,与H 22肝癌细胞组和PBS对照组相比,GM-CSF分泌型肝癌疫苗可显著地增强效应细胞的杀伤作用。根据以上结果,由此推测,GM-CSF分泌型肝癌疫苗通过可诱导自体T细胞向CTL增值和分化,发挥特异性抗肿瘤免疫应答功能,而这种功能的发挥与直接活化效应细胞CD8+T细胞有着密切的关系。Western blot检测了CD8+T细胞表达的INF-γ、TNF-α细胞因子,结果表明,与H 22肝癌细胞组和PBS对照组相比,GM-CSF分泌型肝癌疫苗组可显著地提高INF-γ、TNF-α蛋白的表达。此结果表明,GM-CSF分泌型肝癌疫苗治疗肝癌的作用机制可能与下调INF-γ、TNF-α蛋白的表达有关。
综上所述,GM-CSF分泌型肝癌疫苗对移植型肝癌具有显著抑制作用;其抑制作用可能与提高细胞免疫功能有关,作用机制为提高外周血中CD8+T细胞的表达水平、提高效应细胞的杀伤作用以及降低细胞因子INF-γ、TNF-α蛋白的表达有关。
[1] Yang JM,Peng ZH,Si SH,et al.KAI1 gene suppresses invasion and metastasis of hepatocellular carcinoma MHCC97-H cells in vitro and in animal models[J].Liver Int,2010,28(1):132-139.
[2] Tani K,Azuma M,Nakazaki Y,et al.Phase I study of autologous tumor vaccines transduced with the GM-CSF gene in four patients with stage IV renal cell cancer in Japan:clinical and immunological findings[J].Mol Ther,2014,10(4):799-816.
[3] Soiffer R,Hodi FS,Haluska F,et al.Vaccination with irradiated, autologous melanoma cells engineered to secrete granulocyte macrophage colony-stimulating factor by adenoviral mediated gene transfer augments antitumor immunity in patients with metastatic melanoma[J].Clin Oncol,2013,21(17):3343-3350.
[4] Nemunaitis J,Jahan T,Ross H,et al.Phase 1/2 trial of autologous tumor mixed with an allogeneic GVAX vaccine in advanced-stage non-small-cell lung cancer[J].Cancer Gene Ther,2009,13(6):555-562.
[5] Bruix J,Llovet JM.Prognostic prediction and treatment strategy in hepatocellular carcinoma[J].Hepatology,2012,35 (3):519-524.
参考文献
[6] Patya M,Zahalka MA,Vaniehkin A,et a1.Allicin stimulates lymphocytes and elicits an antitumor effect:a possible role of p2l ras[J].Int lmmunol,2014,16(2):275-281.
[7] 唐小龙,江振友,蔡淑玉.通过肿瘤致敏的DCs活化的CD8+T细胞可有效地杀死肿瘤细胞[J].中国病理生理杂志, 2008,24 (4):645-649.
[8] Van den Eynde BJ,van der Bruggen P.T.Cell defined tumor antigens[J].Curr Opin Immunol,2013,9(5):684-693.
[9] Kaufman HL, Ruby CE, Hughes T, et al.Current status of granulocyte-macrophage colony-stimulating factor in the immunotherapy of melanoma [J].J Immunother Cancer,2014,13(2):11-14.
[10] Däbritz J.Granulocyte macrophage colony-stimulating factor and the intestinal innate immune cell homeostasis in Crohn's disease[J].Am J Physiol Gastrointest Liver Physiol,2014,306(6):G455-465.
[11] Berois N, Osinaga E.Glycobiology of neuroblastoma: impact on tumor behavior, prognosis, and therapeutic strategies [J].See comment in PubMed Commons below Front Oncol,2014, 23(4):114-116.
[12] Haan JM,Bevan MJ.A novel helper role for CD4 Tcells [J].Proc Natl Acad Sci USA,2013,97(24):12950-12952.
[13] Gasson JC.Molecular physiology of granulocyte-macrophage colony-stimulating factor[J].Blood,2013,77(6):1131-1142.
[14] Broughton SE, Hercus TR, Hardy MP,et al.Dual mechanism of interleukin-3 receptor blockade by an anti-cancer antibody [J].Cell Rep,2014, 8(2):410-419.
[15] Paoliello-Paschoalato AB, Azzolini AE, Cruz MF,et al.Isolation of healthy individuals‘ and rheumatoid arthritis patients’ peripheral blood neutrophils by the gelatin and Ficoll-Hypaque methods: Comparative efficiency and impact on the neutrophil oxidative metabolism and Fcγ receptor expression [J].J Immunol Methods,2014 ,11(5):13-15.
(编校:王俨俨 吴茜)
Research on mechanism of GM-CSF secreting liver cancer vaccine on CTL killing activity of transplanted liver cancer mice
WU Tian-shan1,XIAOKAITI·Yibulayin1Δ,AERPATI·Maimaiti1,LI Xiang-cheng2
(1.Department of Emergency Surgery, First Affiliated Hospital of Xinjiang Medical University, Urumqi 830054, China; 2.Department of Clinical Medicine, Nanjing Medical University, Nanjing 210029, China)
ObjectiveTo study the effect of granulocyte-macrophage colony-stimulating factor (GM-CSF) secreting liver cancer vaccine on killing activity of cytotoxic T lymphocytes (CTL) of transplanted liver cancer mice and its mechanism.MethodsThere were three groups: liver cancer vaccine group (A group), liver cancer group (B group) and PBS group (C group).The transplanted liver cancer model was builded with injection of H 22 hepatoma cells, while the GM-CSF secreting liver cancer vaccine group and PBS group was builded. GM-CSF secreting liver cancer vaccine group and PBS group were establised.The levels of CD8+T cell in peripheral blood were detected by flow cytometry.The killing activity of cytotoxic T lymphocytes (CTL) of spleen cells was detected by MTT method.The expression levels of tumor necrosis factor-α (TNF-α) and interferon-γ (γ-INF) were detected by Western blot.ResultsThe flow cytometry results showed that, compared with B group, the levels of CD8+T cell of A group significantly increased (P<0.01).MTT results showed that, compared with B group, the killing activity of cytotoxic T lymphocytes (CTL) in A group significantly increased (P<0.01).Western blot results showed that, compared with B group, the expression levels of tumor necrosis factor-α (TNF-α) and interferon-γ (γ-INF) in A group significantly decreased (P<0.01). ConclusionGM-CSF secreting liver cancer vaccine can significantly inhibit the activity of H22 cell, and its possible mechanism of action may be to activated CD8+T expression, improve cytotoxic activity of CTL of spleen cells, and reduce TNF-α and γ-INF protein expression.
GM-CSF; transplanted liver cancer; secreting liver cancer vaccine; cytotoxic T lymphocytes
国家自然科学基金(81170415)
吴天山,男,学士,主治医师,研究方向:创伤、急腹症,E-mail:qch1821460053@163.com;肖开提·伊布拉因,通讯作者,男,硕士,主治医师,研究方向:创伤、急腹症,E-mail:qch1821460054@163.com。
R735.7
A
1005-1678(2015)03-0062-03

