注射用单磷酸阿糖腺苷与阿昔洛韦注射液的配伍研究
夏晓君,张迎春,荆俊丽,魏春雁
(1.解放军第107医院 药剂科,山东 烟台 264002;2.吉林省农业科学院农业质量标准与检测技术研究所,吉林 长春 130033)
注射用单磷酸阿糖腺苷与阿昔洛韦注射液的配伍研究
夏晓君1,张迎春1,荆俊丽1,魏春雁2
(1.解放军第107医院 药剂科,山东 烟台 264002;2.吉林省农业科学院农业质量标准与检测技术研究所,吉林 长春 130033)
目的 研究注射用单磷酸阿糖腺苷与阿昔洛韦注射液的最佳配伍方案。方法 选择温度、光照、放置时间、溶媒、溶媒用量5个影响因素,采用L18(35)正交试验表,用GWJ-4型智能微粒分析仪测定溶液中微粒含量,用HPLC法测定溶液中单磷酸阿糖腺苷与阿昔洛韦含量,对注射用单磷酸阿糖腺苷与阿昔洛韦注射液的配伍方案进行优选研究。结果 单磷酸阿糖腺苷与阿昔洛韦的回归方程分别为A=3.78×104C+2.32,r=0.9997(n=5);A=7.11×105C-4.65,r=0.9995(n=5),结果表明,2者分别在200~900 μg/mL与1000~4500 μg/mL范围内线性关系良好。优选的最佳配伍条件为A2B1C2D1E1,即25 ℃、尽量避光,注射用单磷酸阿糖腺苷1支(0.1 g/支)和阿昔洛韦注射液1支(10 mL:0.5 g)与100 mL 0.9%氯化钠注射液配伍,且在配伍后的4 h内滴完。结论 优选的最佳配伍方案重复性良好,溶液质量稳定,为临床安全合理用药提供科学参考。
注射用单磷酸阿糖腺苷;阿昔洛韦注射液;正交试验;最佳配伍
单磷酸阿糖腺苷为抗脱氧核糖核酸(desoxyribonucleic acid,DNA)病毒药,其药理作用是与病毒的脱氧核糖核酸聚合酶结合,使其活性降低而抑制DNA合成,目前临床上广泛用于病毒感染的治疗[1-2]。阿昔洛韦为一种合成的嘌呤核苷类似物,主要用于病毒性、皮肤或黏膜感染的预防和治疗,也用于乙型肝炎、单纯疱疹性角膜炎、带状水痘病毒感染等[3]。
临床证明,单磷酸阿糖腺苷与阿昔洛韦联合使用治疗带状疱疹较2种药物单独使用疗效更好[4],之前关于单磷酸阿糖腺苷、阿昔洛韦稳定性的研究均有文献报道[5-6],但2药配伍是否稳定未见相关文献,其安全性无确切的理论依据。
本文采用正交试验考察温度、光照、放置时间、溶媒、溶媒用量5个因素对注射用单磷酸阿糖腺苷与阿昔洛韦注射液配伍稳定性的影响,优选合理的配伍条件,为临床安全、合理用药提供理论依据。
1 材料与方法
1.1 仪器 高效液相色谱仪,包括1525溶液输送泵、2487紫外可变波长检测器; Breeze工作站(购自Waters公司);色谱柱:Dikxna Cl8(4.6 mm×250 mm, 5 μm);868型酸度计(购自美国奥立龙公司);8453型紫外可见分光光度计(购自安捷伦科技有限公司);GWJ-4 型智能微粒检测仪(购自天大天发科技有限公司); VS-840-1(2)型单人单净化工作台(购自苏州净化设备有限公司)。
1.2 药品与试剂 注射用单磷酸阿糖腺苷(广东先强药业有限公司,规格:0.1 g/支,批号:130704/1);阿昔洛韦注射液(成都平原药业有限公司, 规格:10 mL:0.5 g,批号:1308031);单磷酸阿糖腺苷标准品(中国药品生物制品检定研究院,批号:140710-200401);阿昔洛韦对照品(中国药品生物制品检定研究院,批号:130480-200302);0.9%氯化钠注射液(国内某厂家生产,规格:100、250、500 mL);5%葡萄糖注射液(国内某厂家生产,规格:100、250、500 mL);10%葡萄糖注射液(国内某厂家生产,规格:100、250、500 mL);甲醇为色谱纯,水为超纯水,其他试剂为分析纯。
1.3 方法
1.3.1 试验用具准备:于层流净化台上使用实验用水将实验用具冲洗至洁净,备用。
1.3.2 配伍液的配制:在层流净化台上进行配制。按正交试验设计要求,模拟临床用药[4],取注射用单磷酸阿糖腺苷1支(0.1 g/支)与阿昔洛韦注射液1支(10 mL:0.5 g)置量瓶中,分别用0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液稀释至刻度,摇匀,根据正交试验表安排试验(n=3),共制备54个样品溶液。
1.3.3 不溶性微粒检查:按照《中国药典》2010年版(二部)附录IXR不溶性微粒检查法,用GWJ-4 型智能微粒检测仪测定。
1.3.4 空白试验:取注射用单磷酸阿糖腺苷与阿昔洛韦注射液和溶媒各3份测定其不溶性微粒,取平均值。
1.3.5 样品溶液微粒测定:取“1.3.2” 项下的54个样品溶液进行不溶性微粒测定, 每个样品重复测定5次,取平均值。
1.3.6 样品溶液 pH 稳定性测定:取“1.3.2”项下各配伍液测定pH值,及其混合后0 h的pH,每个样本连测3次,取平均值,计算其差值。
1.4 含量测定[7]
1.4.1 色谱条件:流动相:水(含6.8 g磷酸二氢钾与15 mL四丁基氢氧化铵10%加至1000 mL)-甲醇(85:15);柱温:25 ℃;流速:1.0 mL/min;测定波长为258 nm;进样量:20 μL。
1.4.2 标准曲线的绘制:精密称取单磷酸阿糖腺苷对照品25 mg、阿昔洛韦对照品125 mg于25 mL量瓶中加流动相至刻度,取上述对照品混合溶液2、4、6、8、9 mL于10 mL量瓶中加流动相至刻度,配成系列浓度的单磷酸阿糖腺苷与阿昔洛韦的对照溶液。按“1.4.1”项下的色谱条件分别进样20 μL,记录峰面积。
1.4.3 配伍液中药物含量测定:按照“1.4.1”项下色谱条件和正交试验设计要求,取各条件的配伍液适量用0.45 μm滤膜过滤,取续滤液5 mL分别置于10 mL量瓶中,加流动相至刻度,摇匀,即得样品溶液,取以上样品溶液分别进样20 μL,每个样品测定3次,取平均值。
1.5 正交试验
1.5.1 因素水平确定:以溶液中的有效成分(单磷酸阿糖腺苷、阿昔洛韦)含量、微粒(10、25 μm)含量为指标,选择温度、光照[8]、放置时间、溶媒、溶媒用量5 个因素,每个因素3个水平,见表1。选用L18(35)正交试验表进行试验。

表1 因素水平表Fig.1 Factor and level of orthogonal design
1.5.2 验证试验:按正交试验优选结果,配制3份样品,分别测定样品中≥10 μm、≥25 μm微粒量以及配伍液中单磷酸阿糖腺苷、阿昔洛韦的的含量和ΔpH。
2 结果
2.1 标准曲线结果 以峰面积A为纵坐标,浓度C(μg/mL)为横坐标,进行线性回归,得单磷酸阿糖腺苷与阿昔洛韦的回归方程分别为A=3.78×104C+2.32,r=0.9997(n=5);A=7.11×105C-4.65,r=0.9995(n=5)。结果表明,单磷酸阿糖腺苷与阿昔洛韦检测浓度分别在200~900 μg/mL与1000~4500 μg/mL范围内线性关系良好。
2.2 正交试验结果 结合实际工作情况,得出注射用单磷酸阿糖腺苷与阿昔洛韦注射液最佳配伍条件为A2B1C2D1E1,即25 ℃、尽量避光,将注射用单磷酸阿糖腺苷1支(0.1 g/支)和阿昔洛韦注射液1支(10 mL:0.5 g)与100 mL 0.9%氯化钠注射配伍,且在配伍后的4 h内滴完。正交实验结果见表2,方差分析结果见表3。

表2 正交试验结果(n=3)Tab.2 Results of the orthogonal test(n=3)

表3 方差分析结果Tab.3 Result of variance analysis
2.3 验证试验结果 按照正交试验优选出的最佳方案进行验证,结果表明,配伍方案重复性良好,溶液质量稳定。见表4。
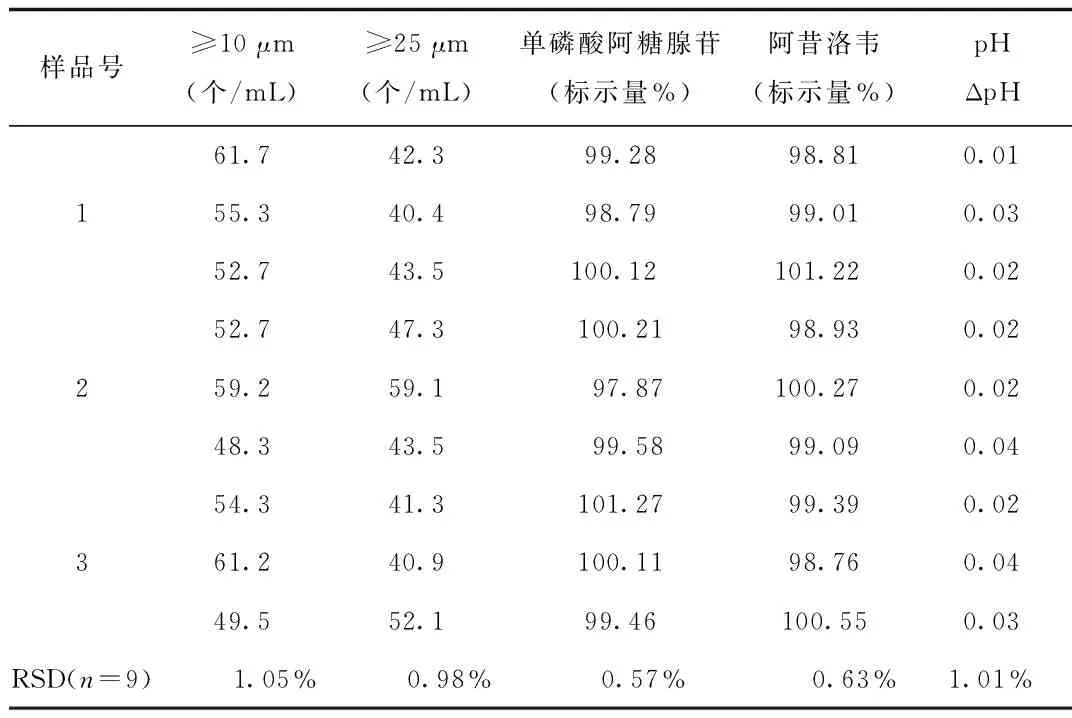
表4 验证试验结果Tab.4 The test results
3 讨论
单磷酸阿糖腺苷与阿昔洛韦配伍后稳定性所涉及的问题主要是放置条件。环境因素如光照和温度对药物的配伍稳定性会产生一定的影响。本实验结果表明, 注射用单磷酸阿糖腺苷与阿昔洛韦注射液于常用溶媒中,在避光和≤25 ℃的条件下,4 h内其溶液质量是稳定的。
溶媒种类对单磷酸阿糖腺苷含量有一定影响(P<0.01), 氯化钠注射液更适合作为注射用单磷酸阿糖腺苷与阿昔洛韦注射液配伍时的稀释溶媒。本实验表明,单磷酸阿糖腺苷与阿昔洛韦配伍液在氯化钠注射液中的稳定性优于5%葡萄糖注射液和10%葡萄糖注射液,这可能与葡萄糖注射液中含有某些分解产物,如5-羟甲基糠醛和酸性氧化物有关[9]。本研究优选出注射用单磷酸阿糖腺苷与阿昔洛韦注射液的最佳配伍方案为:取注射用单磷酸阿糖腺苷1支(0.1 g/支)和阿昔洛韦注射液1支(10 mL:0.5 g),溶于100 mL氯化钠注射液中,在25 ℃以下和避光环境中,在4 h内用完能保证药品质量。用氯化钠注射液作单磷酸阿糖腺苷与阿昔洛韦的配伍溶媒,不仅能保证单磷酸阿糖腺苷与阿昔洛韦的稳定性,而且具有适用性强、应用范围广的特点。
溶液中的不溶性微粒与配伍液中单磷酸阿糖腺苷、阿昔洛韦的分解率有一定关联,当配伍液中2主药成分含量下降时,溶液中≥10 μm的微粒数有所增加,而≥25 μm的微粒则无明显变化,可见,2主药成分分解所产生的微粒粒径主要介于10~25 μm之间。临床应用时,应注意控制2主药成分的稳定性,避免不溶性微粒的增加。
[1] 文九芳.注射用单磷酸阿糖腺苷治疗疱疹性咽峡炎的疗效观察[J].临床合理用药杂志,2011(24):64.
[2] 唐晓燕,田春,杨山,等.单磷酸阿糖腺苷治疗小儿支气管肺炎临床疗效观察[J].中国医药指南,2012,10(9):142.
[3] 邓晓莉,林涛.阿昔洛韦临床应用时应注意的问题[J].海峡药学,2003,15(6):84-85.
[4] 李卫红,范团起.阿昔洛韦联合单磷酸阿糖腺苷治疗带状疱疹74例疗效观察[J].山东医药,2009,5(15):98-99.
[5] 王嬛嬛,张少华.阿糖胞苷与7种输液配伍的稳定性[J].西北药学杂志,2000,4(15):164-165.
[6] 张碧玫,李娟.阿昔洛韦与3种注射液配伍稳定性试验[J].中国医院药学杂志,2005,11(4): 373-374.
[7] 国家食品药品监督管理局标准[S].YBH40032005.
[8] 李秀梅,黄罗生,富志军.光照条件对红花黄色素稳定性的影响[J].海峡药学,2011,23(5):64-66.
[9] 林小明,韦宝含,曾毅,等.正交试验法优选注射用硝普钠与输液配伍方案[J].中国现代应用药学,2014,31(7):878-881.
(编校:王冬梅)
《当代介入医学》征稿函
《当代介入医学》是由国家卫生计划生育委员会主管,中国医师协会和人民军医出版社主办,人民军医电子出版社出版的多媒体医学学术电子期刊;由“医视界”承办,《当代介入医学》编辑部编辑发行。其国内统一刊号为:CN11-9353/R;国际标准刊号为:ISSN 2095-834X。本刊于2015年4月创刊,官网同时上线。
办刊方针:以“大介入、大融合”为方向,整合介入医学在多学科领域应用的基础理论、临床实践、技术研发;促进中国介入医学整体水平的快速、健康发展。
办刊特色:以现代化多媒体技术为依托,充分借助图、文、声、像手段——实现介入医学理论与技术信息的立体化、交互式的传播;最终促进并实现多学科的交叉与融合。
栏目设置:刊首语、前沿、综述、基础研究、临床研究(血管介入、神经介入、肿瘤及非血管介入、心脏介入)、病例报告、述评、专题、介入新技术、介入护理、国外译文、名家讲堂、手术演示、会议通讯、介入圈等。
读者对象:①介入医学研究人员、介入医学临床医护人员、介入医药器械企业的从业人员等——涉及血管、肿瘤、神经、心脏、消化、放射、超声、护理等多个学科;②全国各医学专业相关图书馆、医疗卫生行政管理机构、医药器械企事业单位等机构。
一、文稿要求
稿件内容应具有科学性、实用性、创新性。论著、综述类文章不宜超过7200字,科研简报不宜超过3600字,病例报告不宜超过1800字。所有稿件的伦理道德问题、发表论文相关的出版和编辑问题等需要遵循国际医学期刊编辑委员会制定的《生物医学期刊投稿的统一要求》的基本原则。临床研究必须遵循《世界医学协会郝尔辛基宣言》的原则,对任何涉及人体的研究均应注明得到受试者知情同意,并获得伦理委员会的批准;任何动物实验研究均应声明遵循《实验动物保护条例》。
二、多媒体素材要求
音频:①人声发音准确,吐字清晰,标准普通话,语速150~200字/min;②生理音声音清晰,能体现生理性问题;③效果音清晰,主体明确;④格式以MP3为主。
视频:①内容真实,逻辑清楚,主题突出;②名家讲堂可采用课堂直录,授课教授以标准普通话讲解,发音清晰响亮;③手术视频需反映手术关键步骤和重要技巧;④操作视频应步骤清晰,重点突出,表述准确;⑤画面清晰,稳定,无抖动、扭曲、模糊等现象;⑥视频高清1920×1080,不低于720×560,不低于1500码流;⑦支持手机拍摄,不低于600万像素拍摄;⑧音频信号不失真,音量电平比例适当,音画同步;⑨字幕字体统一采用微软亚黑,字号40号,颜色黑、白,画面下端居中布局;⑩格式以MP4为主。
动画:①平面或空间效果展示,表述准确,重点突出;②视频高清1920×1080,不低于720×560,不低于1500码流;③音频信号不失真,音量电平比例适当,音画同步;④字幕字体统一采用微软亚黑,字号40号,颜色黑、白,画面下端居中布局;格式以MP4为主。
编辑部地址: 北京市朝阳区芍药居38号楼3层8302室(100029)
联系电话:010-84280076-8720;传真:010-84662099
投稿邮箱:intervmed@cyberzone.cn
官网网址:www.intervmed.com
Study on compatibility of vidarabine monophosphate for injection and aciclovir injection
XIA Xiao-jun1, ZHANG Ying-chun1, JING Jun-li1, WEI Chun-yan2
(1. Department of Pharmacy,The People’s Liberation Army 107th Hospital, Yantai 264002,China; 2. Institute of Quality Standard and Testing Technology for Agro Products of CAAS, Changchun 130033, China)
ObjectiveTo study optimal compatibility scheme of vidarabine monophosphate for injection combined with aciclovir injection.MethodsL18(35) of orthogonal design was used with five factors: temperature, illumination,storage time,solvent and solvent dosage;the insoluble particles were observed by GWJ-4 type particle analyzer.The content of vidarabine monophosphate and aciclovir was detected by HPLC. Optimization of the best scheme of vidarabine monophosphate for Injection combined with aciclovir injection was studied.ResultsThe regression equation of vidarabine monophosphate and aciclovir wereA=3.78×104C+2.32,r=0.9997(n=5)andA=7.11×105C-4.65,r=0.9995(n=5),The results showed that the relationship between the range of 200-900 μg/mL(vidarabine monophosphate) and the range of 1000-4500 μg/mL(aciclovir) was good.The optimal compatibility conditions are the follows:temperature of 25,as far as possible away from light;Vidarabine monophosphate for injection 1 (0.1 g/branch) and 1 acyclovir injection (10 mL:0.5 g) mixed with 100 mL 0.9% sodium chloride injection,and dropping out within 4 h after compatibility.ConclusionThe optimal compatibility scheme has good repeatability,injection solution stability is good.It prouides scientific reference for the safty of clinical rational drug use.
vidarabine monophosphate for injection;aciclovir injection;orthogonal test;optimize compatible
夏晓君,女,本科,副主任药师,研究方向:医院药学,E-mail:xxj_107@126.com。
R969.3
A
1005-1678(2015)06-0143-04

