复合微生物对水稻立枯病抑菌作用及田间应用效果研究
程茁,丁伟,王怀彪
复合微生物对水稻立枯病抑菌作用及田间应用效果研究
程茁1,丁伟2,王怀彪2
(1.东北农业大学资源与环境学院,哈尔滨150030;2.东北农业大学农学院,哈尔滨150030)
复合微生物NEB应用对解决水稻旱育秧田化学农药和工业浓硫酸大量应用产生的环境安全问题具有重要作用。文章采用室内抑菌和田间大棚育苗相结合的方法,研究复合微生物NEB对水稻立枯病抑菌作用和田间防治效果。从立枯病发病水稻根际土壤中分离得到立枯病病原菌尖孢镰孢菌(F.oxysporum),NEB对该病原菌具有显著抑菌效果。三年三个试验点田间应用表明,NEB应用后,仅在2014年绥化试验点水稻幼苗立枯病发病率为30%,与化学壮秧剂50%的发病率相比,立枯病发病率显著降低,NEB对水稻立枯病具有显著防治效果。
复合微生物;水稻;立枯病;抑菌作用
程茁,丁伟,王怀彪.复合微生物对水稻立枯病抑菌作用及田间应用效果研究[J].东北农业大学学报,2015,46(7)∶22-27.
Cheng Zhuo,Ding Wei,Wang Huaibiao.Study on bacteriostasis of compound microorganism preparation on rice blight pathogen and its application in fieldl[J].Journal of Northeast Agricultural University,2015,46(7)∶22-27.(in Chinese with English abstract)
Study on bacteriostasis of compound microorganism preparation on rice blight pathogen and its application in field
水稻是中国重要粮食作物,水稻旱育稀植技术自20世纪80年代引进到吉林和黑龙江以来,已在全国范围内进行大面积推广应用[1-3],该技术对大幅度提高寒地水稻产量和品质发挥了重要作用。旱育壮秧技术是水稻旱育稀植技术重要内容之一,包括土壤调酸、消毒、施肥和水分温度管理。20世纪90年代初期,科研工作者把秧田旱育壮秧关键技术进行集成和优化,使水稻壮秧剂得以大面积应用。但水稻壮秧剂中的化学杀菌剂、生长调节剂和工业浓硫酸会影响环境安全。利用具有杀菌活性微生物、产酸微生物与化学肥料结合,研制水稻秧田生物药肥制剂是解决目前水稻壮秧剂影响环境安全问题的有效方法。水稻旱育壮秧技术难点是立枯病防治和秧苗养分需求满足问题。本文研究蜡质芽孢杆菌(Bacillus cereus)、枯草芽孢杆菌(Bacillus subtilis)、放线菌(Actinomy⁃cete)和产酸菌等微生物复合菌剂对水稻立枯病菌抑菌作用,及其复合菌剂与N、P、K复配而成的复合微生物药肥在田间对水稻秧苗立枯病的防治效果,以期为利用微生物开发环境友好型水稻壮秧剂提供理论依据。
1 材料与方法
1.1 材料
供试水稻品种为龙粳29号,NEB复合微生物由蜡质芽孢杆菌(Bacillus cereus)、枯草芽孢杆菌(Bacillus subtilis)、放线菌(Actinomycete)和产酸菌复配而成,各菌种均由东北农业大学植保系提供,化学壮秧剂在市场上购买。
1.2 设计
室内试验在东北农业大学农业微生物实验室进行,从水稻立枯病发病植株根际土壤中分离并鉴定立枯病病原菌,采用抑菌圈法,分别对NEB复合菌及其单个菌株对立枯病病原菌的抑菌效果进行测定。
田间试验于2012~2014年在东北农业大学校内试验田、阿城区和绥化市北林区试验点大棚内进行,4月5日~4月10日播种。田间试验设3个处理(见表1),水稻苗床小区面积为10 m2,3次重复。田间试验采用机插盘育秧方法,秧盘规格为30 cm× 60 cm,播种前分别将供试的NEB复合生物菌及化学肥料复配成复合微生物药肥,用化学壮秧剂作对照,按设计用量与过筛旱田土混合均匀,每盘装3 kg并浇透底水,每盘播种催芽种子125 g后,再用上述混合土壤1.0 kg均匀覆盖。

表1 处理及药肥用量Table 1Treatments and use rate of pesti-fertilizer
1.3 方法
1.3.1 水稻立枯病病原菌分离和鉴定
采用稀释涂布平板法,称取10 g立枯病发病水稻根际土样,放入200 mL三角瓶中,加入90 mL无菌水,摇床震荡25 min,静止30 min,吸取1 mL土壤悬浮液,加入9 mL去离子水,在试管中充分摇匀,将土壤悬浮液逐级稀释至106倍,利用显微镜观察孢子数为10~40个的菌悬液,将0.1 mL菌悬液均匀涂布在PDA培养基中,25℃培养。依据菌落形态特征对立枯病病原菌进行初步镜检,把初步鉴定的病原菌在PDA培养基上进行纯化。
凹玻片和培养皿灭菌后,将凹玻片置于培养皿内,取45℃100 μL SNA培养基置于凹玻片凹下处,室温下冷却。用挑针在培养5 d后的PDA平板上挑取少量菌丝于SNA培养基内,盖上盖玻片,25℃下培养3 d。3 d后在显微镜下观察大、小分生孢子和厚垣孢子,参照王拱辰方法进行形态鉴定[4]。
将单孢分离出来的病原菌菌株在PDA培养基上培养24 h,菌株培养液送上海生物工程公司进行18S rDNA鉴定。
1.3.2 NEB复合菌对立枯病病原菌的抑菌作用
采用滤纸片法,用打孔器将定性滤纸打成直径为0.5 cm圆片,120℃高温灭菌30 min。向灭菌后培养皿中倒入适量(约4 mm厚)已灭菌PDA培养基,取1 mL浓度为108cfu·mL-1立枯病病原菌菌悬液滴入培养皿中,轻轻转动培养皿,使培养基与菌液混合均匀,静置凝成平板。将放线菌、枯草芽孢杆菌、蜡质芽孢杆菌和NEB复合菌悬浮液分别稀释到0、101、102、104、106、108、1010cfu·mL-1,用灭菌滤纸粘取各浓度菌悬液,并放在接种立枯病病菌平板中距离中心等距离的三点,用镊子稍用力按一下,使之与培养基充分紧贴,每个浓度5次重复,用灭菌水浸湿的滤纸片作空白对照。在恒温培养箱内25℃下培养并观察,测定抑菌圈直径。
1.3.3 NEB复合生物制剂对水稻立枯病防治效果的田间调查
2012~2014年,在东北农业大学校内、阿城区和绥化市北林区试验点,对每个处理的育苗棚内水稻立枯病发病率进行调查,每个试验点3次重复。立枯病发病率按以下公式进行计算。
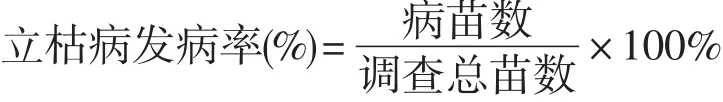
1.4 数据分析方法
采用Excel 2010进行数据整理,利用DPS 10.15软件对数据进行5%差异显著性分析。
2 结果与分析
2.1 水稻立枯病病原菌分离和鉴定
2.1.1 病原菌形态学鉴定
分离、提纯、筛选出的三种菌株分别命名为IS133、IS134、IS135,三种菌株形态上基本相近,菌落生长迅速。25℃条件下,PDA培养基上测定菌落直径为43~52 mm,7 d菌落直径为70~93 mm。气生菌丝表现为羊毛絮状,开始为白色,后变为粉色至紫色,背面常产生蓝紫色色素,菌株之间形态差异不大;小型分生孢子会产生大量假头生分生孢子,形状为椭圆形或肾形,0~1隔,镜检结果为(6~14)μm×(3~2.8)μm;分生孢子座容易产生粘状的分生孢子座;大型分生孢子是美丽型,细胞壁比较薄,细胞壁向两边均匀地逐渐变窄,大多为2~6隔,多数是3隔,镜检结果为(22~51)μm×(4~5)μm,没有观察到厚垣孢子(见图1)。这三种菌株类似尖孢镰孢菌(F.oxysporum)。
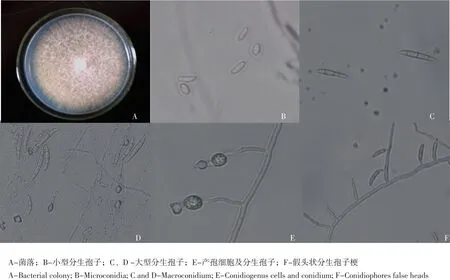
图1 立枯病病原菌孢子形态特征Fig.1Spore characters of blight pathogen(F.oxysporum)
2.1.2 立枯病病原菌分子生物学鉴定
18S rDNA法对菌株IS133、IS134、IS135进行PCR扩增,扩增产物DNA条带大小为520~540 bp,扩增产物条带清晰可见(见图2)。
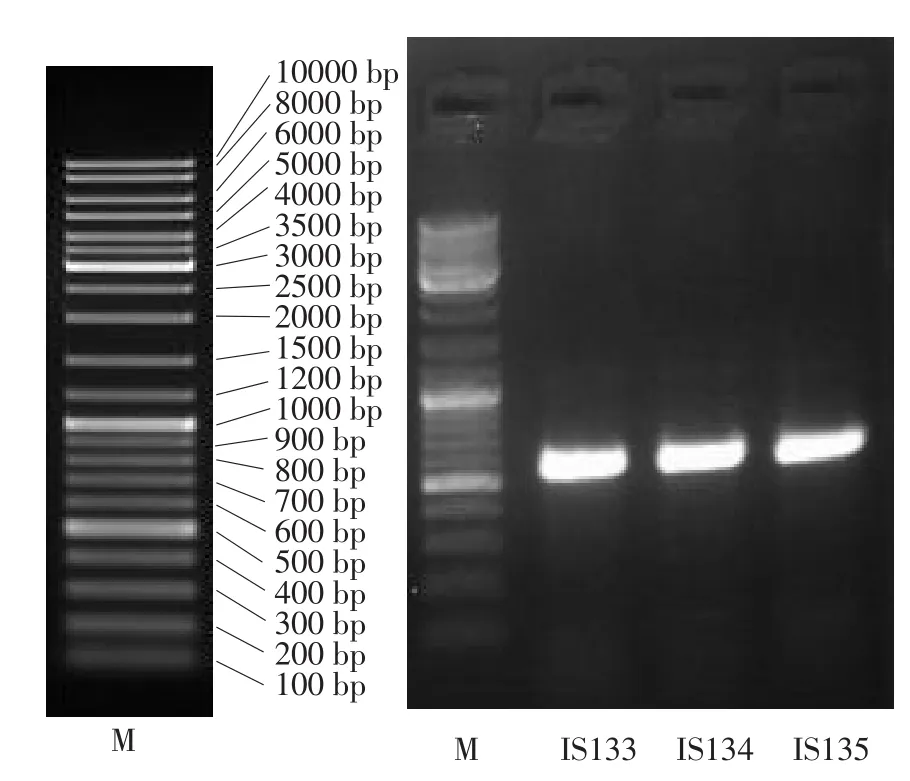
图2 三种病原菌株18S rDNA序列PCR扩增结果Fig.2PCR results of 18S rDNA suquence of three kinds of pathogens bacterial strains
把菌株基因序列结果提交至GenBank,进行相似度比对,结果显示菌株IS133碱基对数为535 bp,与尖孢镰孢菌(F.oxysporum)相似度为100%(见图3)。经分子生物学鉴定和形态学共同鉴定,证明该菌株为尖孢镰孢菌(F.oxysporum)。
2.2 NEB及其单菌株对立枯病病原菌抑菌效果
蜡质芽孢杆菌(Bacillus cereus)、枯草芽孢杆菌(Bacillus subtilis)、放线菌(Actinomycete)和NEB复合菌在不同浓度(101、102、104、106、108、1010cfu·mL-1)下,对浓度为108cfu·mL-1的IS133病原菌均产生明显抑菌带,其中单个菌种中,蜡质芽孢杆菌菌落直径最大,枯草芽孢杆菌菌落直径相对最小;复合菌NEB菌落生长直径大于单一菌株生长直径,表明NEB对病原菌IS133抑制效果最强。通过对不同浓度下单菌株和复合菌NEB菌落在含IS133立枯病病原菌培养基中的生长比较可见,当NEB接种浓度在60 cfu·mL-1下时,其菌落生长直径最大,表明该浓度是复合菌NEB最适抑菌浓度(见表2)。

图3 被测菌株IS133碱基序列与NCBI上收录的Fusarium oxysporum 18S rDNA序列之间对比结果Fig.3Comparison result between the base sequence of determined isolate IS133 and 18S rDNA sequence of Fusarium oxysporum included in NCBI
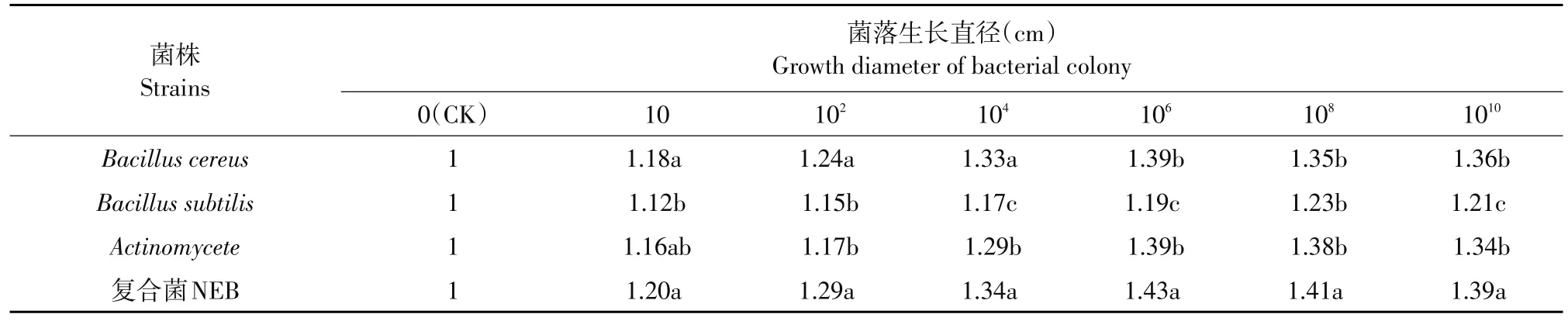
表2 NEB及其单菌株不同浓度对IS133的抑菌效果Table 2Inhibition effects of NEB and its single bacterial strain to IS133
2.3 NEB复合微生物对水稻立枯病田间防治效果
对不同试验点水稻苗期立枯病发病率调查结果(见表3)表明,2012年阿城试验点应用化学壮秧剂和只应用化学肥料处理的水稻立枯病发病率分别为20%和50%,绥化试验点发病率为50%和55%,NEB复合微生物药肥制剂立枯病发病率为0; 2013年各试验点水稻苗床幼苗均未发生立枯病;2014年绥化试验点各处理均有立枯病发生,但NEB复合微生物制剂应用后水稻幼苗立枯病发病率为30%,与化学壮秧剂和只应用肥料相比,立枯病发病率显著降低。田间试验进一步证明NEB复合微生物对水稻立枯病具有较好防治效果。
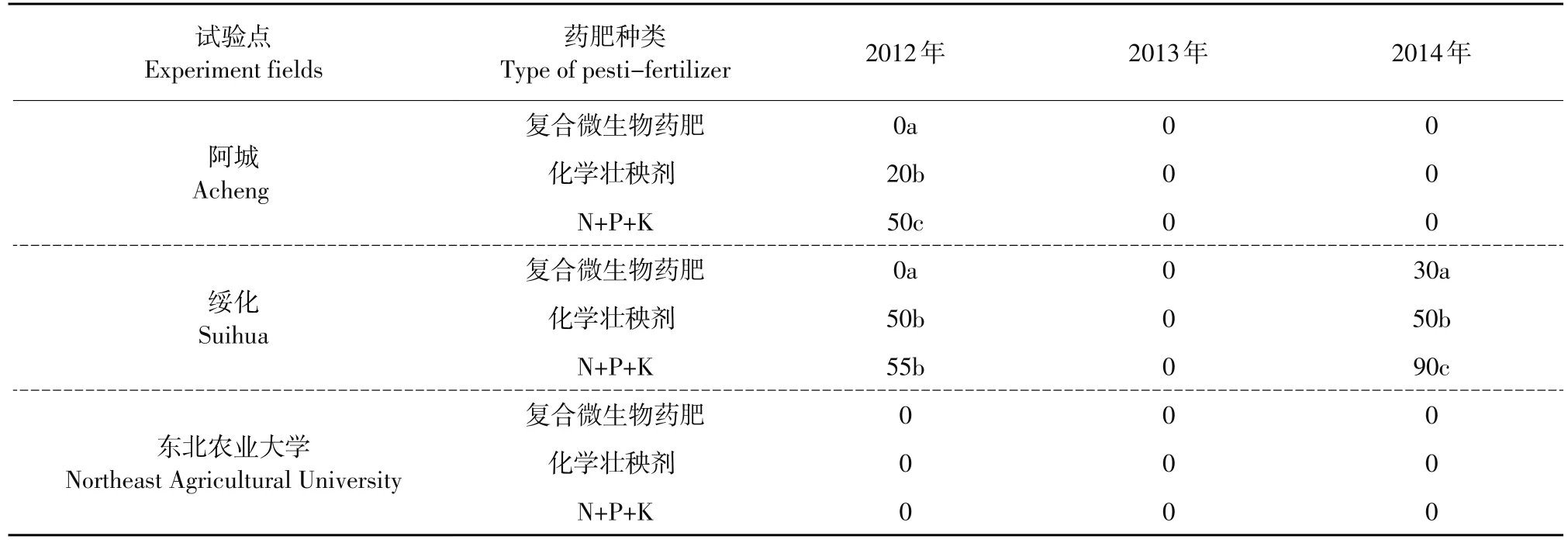
表3 NEB复合微生物对不同试验点水稻苗期立枯病发病率的影响Table 3Effect of NEB on rice seedling blight ratio in different experiment fields(%)
3 讨论
土壤中多种病原菌均可造成水稻发生苗期立枯病,包括腐霉菌(Pythium spp.)、镰孢菌(Fusari⁃um spp.)、根霉菌(Rhizopus spp.)均能引起秧苗在2~5叶期内发生立枯病[5-7];长蠕孢属(Helminthospo⁃rium spp.)、假单胞菌属(Pseudomonas spp.)某些种也可导致水稻秧苗干枯、腐败和幼苗扭曲[8-10];高同春等认为水稻秧苗立枯病致病的镰刀菌主要是串珠镰刀菌(F.moniliforme)[11]。郑雯等从黑龙江6个不同地区采集带病水稻秧苗,经人工分离后获得6个优势种中5个为镰孢菌,回接水稻立枯病发病率较高的是禾谷镰孢菌(F.graminearum)和尖孢镰孢菌(F.oxysporum)[12]。本文从发病水稻根际土壤中分离并鉴定尖孢镰孢菌,是目前黑龙江省已知水稻立枯病致病菌之一。因此,利用该病原菌验证NEB复合微生物及其构成NEB的单一菌株抑菌作用可行,室内研究结果证实NEB复合微生物对立枯病病原菌具有良好的抑菌效果,为NEB进一步在水稻育苗生产中的应用提供理论依据。
水稻苗床立枯病防治主要以预防为主,治疗为辅。立枯病预防关键措施是提高水稻秧苗抗病性。通过种子清选和消毒、土壤消毒和调酸、营养元素合理搭配施用及苗床早期温度和水分管理实现对水稻苗期立枯病的有效预防。NEB复合微生物制剂由放线菌(Actinomycete)、枯草芽孢杆菌(Bacil⁃lus subtilis)、蜡质芽孢杆菌(Bacillus cereus)和产酸菌复配而成,自从Johnson等从枯草芽孢杆菌中分离、鉴定出抗真菌肽后[13],枯草芽孢杆菌作为生防菌被广泛研究和应用[14]。蜡质芽孢杆菌具有极强抗逆性和抗菌能力,在抑制立枯丝核菌菌丝生长的同时可激发水稻对立枯丝核菌抗性[15]。放线菌可产生真菌胞璧水解酶,使病原真菌细胞壁溶解,对致病微生物具有良好抑制作用[16]。利用NEB复合微生物与无机N、P、K等营养元素复配成水稻秧田生物药肥,既可利用微生物抑菌和产酸功能,又可为水稻苗期生长提供充足养分。本文通过三年三地研究认为,NEB复合微生物与化学肥料复配应用于水稻旱育苗生产,可实现对苗期立枯病的有效预防。
4 结论
本试验分离并鉴定水稻立枯病病原菌,命名为IS133,NEB复合微生物对该病原菌具有显著抑菌作用。田间应用NEB复合微生物药肥对水稻旱育秧田秧苗立枯病发生具有明显防治效果。
[1]徐一戎,邱丽莹.寒地水稻旱育稀植三化栽培技术图历[M].哈尔滨:黑龙江科学技术出版社,1996:1-3.
[2]王玉生,谭玉琴,那宝林,等.新型水稻壮秧剂的试验研究[J].中国农学通报,1998,14(2):56-57.
[3]何鼎伦.水稻旱育稀植技术在我国南方发展迅速[J].中国稻米,1995(4):21.
[4]王拱辰.常见镰刀菌鉴定指南[M].北京:中国农业科技出版社,1997:15-16.
[5]周燮.早稻烂秧及防治[M].上海:上海科学技术出版社,1978: 1-20.
[6]高同春,叶钟音,王梅,等.水稻旱育秧苗立枯病致病镰刀菌分离、鉴定及致病性测定[J].中国水稻科学,2001,15(4): 320-322.
[7]林佩力,李涌,李静,等.恶霉灵防治水稻立枯病研究[J].黑龙江农业科学,1991(2):1-5.
[8]华致甫,丁晓民,李真,等.土菌消防治水稻立枯病[J].吉林农业大学学报,1989,11(8):19-23.
[9]李永春.水稻盘土立枯病的防治研究[J].吉林农业科学,1984 (1):47-55.
[10]俞孕珍.水稻免疫育苗的抗性研究[J].植物病理学报,1997,27 (2):119-124.
[11]高同春,马严明,陆悦建,等.水稻旱育秧立枯病致病菌鉴定及药剂防治研究[J].植物保护,2001,27(6):1-4.
[12]郑雯,刘立新,辛惠普.寒地水稻立枯病病原真菌的分离鉴定[J].黑龙江农业科学,2002(2):19-20.
[13]Johnson F H,Campbell D H.The retardation of protein denatur⁃ation by hydrostatic pressure[J].Journal of Cell Comp Physiol, 1945,26:43-46.
[14]刘雪,穆常青,蒋细良,等.枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用[J].中国生物防治,2006,22(增): 179-184.
[15]陈刘军,俞仪阳,王超,等.蜡质芽孢杆菌AR156防治水稻纹枯病机理初探[J].中国生物防治学报,2014,30(1):107-112.
[16]陈杰,汤琳,郭天文,等.马铃薯土传病原真菌拮抗放线菌的抗病促生作用[J].西北农林科技大学学报:自然科学版,2014,42 (1):111-119.
CHENG Zhuo1,DING Wei2,WANG Huaibiao2(1.School of Resources and Environmental Sciences,Northeast Agricultural University, Harbin 150030,China∶2.School ofAgriculture,NortheastAgricultural University,Harbin 150030,China)
Application of NEB with a kind of compound microorganism preparation had the important action on solving chemical pesticide and concentrated sulfuric acid used in dry land rice seedling culture. Bacteriostasis of NEB in laboratory and field experiments was conducted in this paper to study the effects of NEB on rice seedling blight pathogen inhibition and rice seedling blight management in greenhouse.Blight pathogen namedF.oxysporumwas separated from rhizosphere soil collected from blight infected rice seedlings,and it was used in this experiments which showed that NEB significantly inhibited the growth of the blight pathogen.Three field sites within three years experiments showed that only in Suihua experiment site rice blight seedling ratio(RBSR)was 30%in the year of 2014,and the ratio was significantly decreased compared with chemical seedling strengthening agent with 50%RBSR in control field.NEB had obvious effects on rice seedling blight management.
compound microorganism preparation;rice;blight pathogen;bacteriostasis
S511;S435.621.2+1
A
1005-9369(2015)07-0022-06
时间2015-7-9 14:42:50[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150709.1442.013.html
2015-01-15
黑龙江省科技攻关项目资助(GC12B103)
程茁(1970-),女,实验师,硕士,研究方向为农药作用机理。E-mail:dingchengzhuo@126.com

