阿特拉津和毒死蜱对鲤胚胎发育的影响
韩英,赵荣伟,郝其睿,姜旭阳,张红
阿特拉津和毒死蜱对鲤胚胎发育的影响
韩英,赵荣伟,郝其睿,姜旭阳,张红
(东北农业大学动物科学技术学院,哈尔滨150030)
研究旨在探讨不同浓度阿特拉津(Atrazine,ATR)、毒死蜱(Chlorpyrifos,CPF)及其混合物对鲤(Cyprinus carpio L.)胚胎发育、孵化率及抗氧化能力的影响。将鲤受精卵分别暴露在各自浓度为12.5、25、50、100、200 μg·L-1的ATR、CPF及ATR-CPF 1∶1混合液中,经96 h试验,观察发育形态,统计死亡率和畸形率,检测全鱼抗氧化能力。在暴露试验中,各处理组死亡率和畸形率随药物浓度增长呈上升趋势;初孵仔鱼体内SOD、GPx和CAT活性整体呈下降趋势。结果表明,阿特拉津和毒死蜱对鲤受精卵具有一定的致死、致畸效果,且两者生物毒性具有一定的叠加效应和协同作用,氧化胁迫是阿特拉津和毒死蜱对鲤发挥毒性作用的重要机制之一。
阿特拉津;毒死蜱;鲤;形态发育;抗氧化能力
农业生产中除草剂和杀虫剂大量使用,已成为严重的环境安全问题。阿特拉津(Atrazine,ATR),又名莠去津,属三氮苯类除草剂,具有中低程度毒性,具有使用量大、残留期长(半衰期为244 d)、污染范围广(水环境、土壤、大气)等特点[1],对人和哺乳动物有致癌作用[2-3]。毒死蜱(Chlorpyrifos,CPF),又名氯吡硫磷,是乙酰胆碱酯酶抑制剂,属磷酸酯类杀虫剂,可防除水稻三化螟,是广谱、高效的有机磷农药,是农作物、大棚蔬菜和其他经济作物的理想杀虫剂。这两种农药可随径流进入养殖水体,对鱼类、甲壳类等水生动物具有毒性作用[4-6],动物体内超氧化物歧化酶(SOD)经常被用作环境胁迫与水域污染的潜在指标[7],超氧化物歧化酶、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)因相互间的协同作用,常被联合测定用作研究氧化应激反应和组织病理学变化的指标[8]。
目前,有关鱼类毒理试验的研究报道相对较多[9],但针对阿特拉津和毒死蜱毒性的研究报道中[10-11],尚未发现与鲤早期发育的相关报道。本试验选用鲤受精卵为供试生物,旨在探讨ATR和CPF单独、联合暴露对鲤早期发育形态及组织抗氧化力的影响,为渔业用水控制及水环境保护提供参考。
1 材料与方法
1.1 试剂及仪器
1.1.1 主要试剂
毒死蜱和阿特拉津均购于Sigma公司,纯度分别为98.0%和99.5%。
考马斯亮兰蛋白测定试剂盒、总抗氧化能力(T-AOC)测定试剂盒、总超氧化物歧化酶(T-SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒和过氧化氢酶(Catalase-CAT)测定试剂盒均购自南京建成生物工程研究所。
1.1.2 主要仪器
TU-1900双光束紫外可见分光光度计,Motic实体数码显微成像系统。
1.2 试验生物处理
1.2.1 受精卵获取
从哈尔滨市水产技术推广站驯养的繁殖鲤亲鱼中挑选游动灵活、体色正常无创伤、摄食无异常的鲤鱼,雌雄分开饲养3 d,经催产和人工授精,获得优质受精卵。
1.2.2 水质条件
试验水体pH为(7.3±0.2),总硬度为225 mg·L-1(以CaCO3计),溶解氧(DO)为7.2 mg·L-1,水温为(20±1)℃。
1.2.3 暴露试验
李术等急性毒性试验显示,阿特拉津、毒死蜱及阿特拉津-毒死蜱1∶1混合药剂对鲤幼鱼(体重190±10 g)的96 h半致死浓度分别为2.142、0.582、0.565 mg·L-1,其对应安全浓度分别为214.2、58.2、56.5 μg·L-1[12]。本试验农药使用计量,ATR浓度组(12.5、25、50、100、200 μg·L-1)、CPF浓度组(12.5、25、50、100、200 μg·L-1)和阿特拉津与毒死蜱混合(ATR和CPF质量比1∶1混合)浓度组(12.5、25、50、100、200 μg·L-1)以及对照组(经曝气的地下水),共13组。在配制时,以丙酮为助溶剂,丙酮在最高剂量组中的浓度为0.1 mL·L-1,李术等研究表明,该剂量丙酮助溶剂对试验所造成的影响可忽略不计[12]。受精2 h后拣出未受精的卵,每组200枚受精卵,每组3个重复,分别置于36个孵育盆中,自然光照,静水孵育。水温为(20±1)℃,受精卵经59.5~62 h孵化破膜而出,破膜后仔鱼营养摄入为吸收卵黄养分的内源性营养,经2~3 d,由内源性营养向外源性营养转化,此时,初孵仔鱼可在水面平游并开口摄食,以烘干的蛋黄粉作为仔鱼的开口饲料。本试验药物暴露时长为96 h,包括胚胎期和前期仔鱼。
1.3 试验方法
1.3.1 形态观察及畸形率、死亡率计算
按照试验设定进行孵育,观察出膜仔鱼形态,并随时间推移累计各试验组仔鱼畸形数,统计最终每组总畸形尾数和各组试验最终死亡数。计算公式如下。

1.3.2 组织抗氧化测试
试验达到96 h时,取初孵仔鱼用生理盐水冲洗,并用4℃低温冷藏的0.86%生理盐水研磨制成10%组织匀浆,3 000 r·min-1,4℃离心30 min。吸取上清液用于抗氧化酶活性(SOD、CAT和GPx)检测。根据试剂盒提供测定方法,使用试剂盒给定的原药配置使用液,按使用说明要求标准操作,测定吸光度,再根据指定公式计算抗氧化酶活性值。
1.4 数据处理
应用Microsoft Excel 2000对试验数据进行初期处理;应用GraphPad Prism软件进行数据统计学分析及图形制作。
2 结果与分析
2.1 形态学观察
观察过程中发现,试验到达59.5 h时,对照组、ATR低浓度组(12.5、25 μg·L-1)中发现破膜仔鱼;当试验进行到59.67 h时,50 μg·L-1ATR及低浓度CPF、ATR-CPF混合组(12.5、25 μg·L-1)中发现破膜仔鱼;当试验进行到60.33 h时,ATR高浓度组(100、200 μg·L-1)陆续有仔鱼破膜;试验62 h时,CPF和ATR-CPF混合处理组有仔鱼孵出,且各组破膜时间较相近。
观察表明,用12.5、25、50、100、200 μg·L-1阿特拉津、毒死蜱及阿特拉津和毒死蜱混合处理的鲤胚胎均可以孵化破膜,各组均显现出不同程度的畸形现象,大多脊柱弯曲(见图1a);部分样本心包囊肿、黑色素缺乏(白化)、体腔发育异常(见图1b)。畸形率随处理浓度的增加而升高,且畸形程度加重;ATR、CPF及混合组组间比较,CPF组畸形现象较严重。

图1 阿特拉津和毒死蜱对鲤初孵仔鱼形态的影响Fig.1Effect of ATR and CPF on newly hatched larvae of common carp form
2.296 h死亡率及畸形率
对照组(即表1中0 μg·L-1浓度组)存在一定的自然死亡现象,死亡率为5.67%。各处理组胚胎死亡率均高于对照组,死亡率随药物浓度增加,总体呈上升趋势。与对照组比,ATR低浓度组(12.5、25、50 μg·L-1)死亡率无显著变化,而高浓度组(100、200 μg·L-1)死亡率均显著升高(P< 0.05);CPF低浓度组(12.5 μg·L-1)死亡率无显著变化,其他各组死亡率均显著升高(P<0.05);ATRCPF混合低浓度组(12.5、25 μg·L-1)死亡率无显著变化,高浓度组(50、100、200 μg·L-1)死亡率显著升高(P<0.05)(见表1)。
自然条件下,鱼类孵育存在较低概率的发育畸形,试验对照组畸形率为0.18%。ATR、CPF及ATR-CPF混合处理组均存在不同程度畸形现象,畸形率随药物浓度增加,总体呈上升趋势。与对照组比,ATR、CPF及ATR-CPF混合低浓度组(12.5、25 μg·L-1)畸形率无显著变化,高浓度组(50、100、200 μg·L-1)畸形率均表现出显著升高(P<0.05)(见表1)。
2.3 初孵仔鱼体内SOD活性
暴露末期(96 h),在3个处理组中,SOD活性随药物浓度增加,总体呈下降趋势(见图2)。与对照组相比,阿特拉津低浓度组(12.5、25、50 μg·L-1)初孵仔鱼SOD活性无显著变化,而高浓度组(100、200 μg·L-1)初孵仔鱼SOD活性均显著降低(P<0.05);毒死蜱各浓度组初孵仔鱼SOD活性均显著降低(P<0.05);阿特拉津和毒死蜱混合组低浓度组(12.5、25、50 μg·L-1)初孵仔鱼SOD活性无显著变化,100、200 μg·L-1初孵仔鱼SOD活性均显著降低(P<0.05)(见表2)。
2.4 初孵仔鱼体内CAT活性
暴露末期(96 h),各药物处理组中,CAT活性随药物浓度增加,总体呈下降趋势(见图3)。与对照组相比,暴露末期阿特拉津12.5、25、50、100 μg·L-1浓度组初孵仔鱼CAT活性无显著变化,200 μg·L-1高浓度组初孵仔鱼CAT活性显著降低(P<0.05);暴露末期毒死蜱低浓度组(12.5、25、50 μg·L-1)初孵仔鱼CAT活性无显著变化,高浓度组(100、200 μg·L-1)初孵仔鱼CAT活性显著降低(P<0.05);阿特拉津和毒死蜱混合组低浓度组(12.5、25、50 μg·L-1)CAT活性无显著变化,高浓度处理组(100、200 μg·L-1)初孵仔鱼CAT活性均显著降低(P<0.05)(见表2、图3)。

表1 阿特拉津和毒死蜱对鲤胚胎96 h死亡率及畸形率Table 1Mortality and deformity rates of ATR and CPF effects in embryo of carp 96 h

图2 仔鱼体内SOD活性测定结果Fig.2Determination results in SOD activity of carp larvae
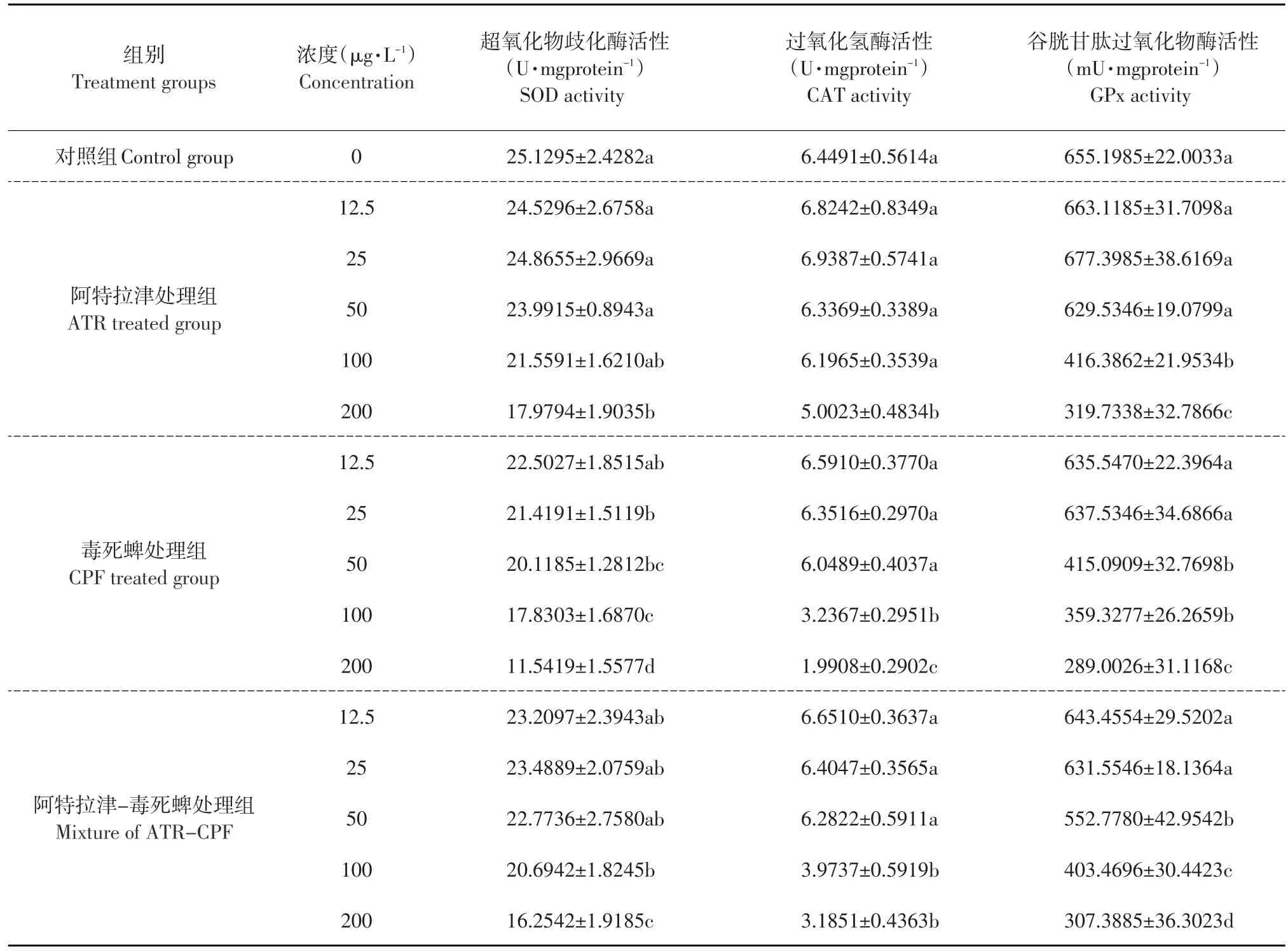
表2 阿特拉津与毒死蜱对鲤初孵仔鱼抗氧化能力的影响Table 2Effect of ATR,CPF and their mixture on oxidation resistance in newly hatched larvae of common carp
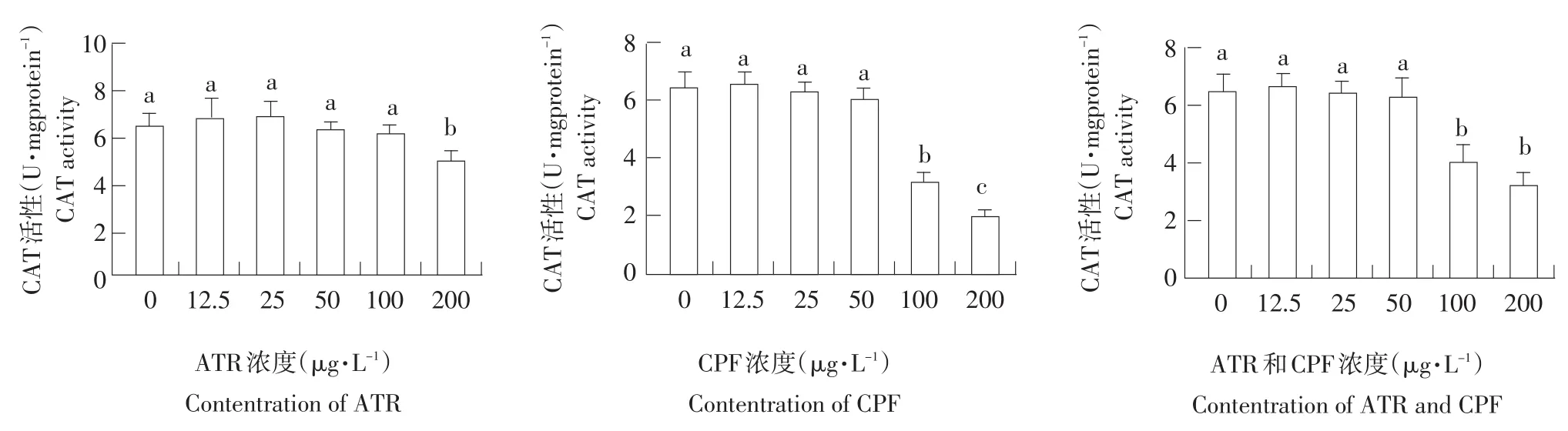
图3 仔鱼体内CAT活性测定结果Fig.3Determination results in CAT activity of carp larvae
2.5 初孵仔鱼体内GPx活性
在暴露末期(96 h)与对照组相比,各组GPx活性随药物浓度增加,总体呈下降趋势(见图4)。与对照组相比,阿特拉津低浓度组(12.5、25、50 μg·L-1)初孵仔鱼GPx活性无显著变化,100、200 μg·L-1初孵仔鱼GPx活性均显著降低(P<0.05);毒死蜱低浓度组(12.5、25 μg·L-1)初孵仔鱼GPx活性无显著变化,其他三组GPx活性均显著降低(P<0.05);阿特拉津和毒死蜱混合组低浓度组(12.5、25 μg·L-1)初孵仔鱼GPx活性无显著变化,50、100、200 μg·L-1组初孵仔鱼GPx活性均显著降低(P<0.05)(见表2、图4)。

图4 仔鱼体内GPx活性测定结果Fig.4Determination results in GPx activity of carp larvae
3 讨论与结论
3.1 ATR和CPF对鲤受精卵发育的影响
ATR和CPF可通过环境进入动物体内,对动物生理过程产生影响,并有一定程度致畸和致死效应。对水生生物毒性作用较明显,其毒性效应表现在诱发畸形、发育迟缓、免疫力低下等方面[13-14]。
试验结果表明,CPF浓度不低于25 μg·L-1,ATR、ATR-CPF混合制剂浓度(质量比1∶1混合)不低于50 μg·L-1,均对鲤胚胎发育产生影响,各处理组均存在不同程度死亡状况和畸形现象;ATR、CPF及ATR-CPF混合处理组组内,初孵仔鱼死亡率和畸形率随药物浓度升高而升高;ATR、CPF及ATR-CPF混合处理组组间,ATR各浓度处理组死亡率和畸形率均低于其他两组,与CPF及ATR-CPF混合处理组差距较大。同浓度CPF和ATR-CPF混合组死亡率和畸形率差异较小,表现出毒性强度较为接近,但ATR-CPF混合处理组使用药剂中只含有同浓度ATR和CPF处理组一半剂量,ATR毒性强度又低于CPF,ATR与CPF在致死致畸效应上具有协同作用。
鲤胚胎发育受ATR和CPF抑制,阿特拉津通过增加克服胁迫的能量代谢减少物质积累,而毒死蜱则主要通过降低代谢率抑制物质积累[15],抑制效果上有一定叠加作用,使ATR、CPF及ATR-CPF混合处理组胚胎均出现破膜时间延迟现象。已有研究证明,胚胎发育特别在囊胚期是细胞高度分裂期,外源性有毒化合物可使斑马鱼胚胎在进入外包前期就停止发育,并随胚胎细胞损毁和卵凝结[16],导致胚胎死亡和畸变。当胚胎发育进入分裂期时,可见肌节形成,染毒试验中部分胚胎会受药物影响,出现严重的发育阻滞和尾部畸变(神经管缺损的表现),从而影响早期器官形成、致尾部畸变和卵黄异常等现象[17]。受ATR和CPF影响,鲤初孵仔鱼代谢过程改变,出现不同程度畸形现象,其中CPF致畸作用更为显著,且游动能力与对照组也存在一定差异。
3.2 ATR和CPF对鲤初孵仔鱼抗氧化功能的影响
活性氧(Reactive oxygen species,ROS)广泛存在于生物体内,是生理活性氧的代谢物。高浓度ROS通过细胞氧化应激反应诱导细胞凋亡甚至导致其坏死。ROS主要在线粒体呼吸链部位由单电子传递给氧而产生主要包括超氧阴离子(O2-)、羟自由基(OH-)、过氧化氢(H2O2)等[18]。
生物体内ROS清除剂包括两大类物质:抗氧化酶和抗氧化剂。抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽转硫酶(GST)等。SOD可催化O2-歧化反应生成H2O2,而H2O2可在CAT或GPx作用下分解为H2O与O2[19]。GSP-Px主要功能是将过氧化物还原成无毒的羟基化合物和水,构成机体防御自由基损伤的第二道防线[20]。CAT则主要清除细胞内过多的过氧化氢,主要存在于组织细胞的过氧化酶体内,专门清除过氧化氢,并且在分解过氧化氢时,常与GPx协同作用[21]。因而SOD、CAT和GPx对O2-和H2O2的及时清除能力显得极为重要。可见,这三种酶对于阻断羟自由基生成有重要意义。
试验结果显示,与对照组比较,ATR、CPF及ATR-CPF混合的3组暴露试验的SOD、CAT和GPx活性均有下降,且随浓度升高各组暴露试验SOD、CAT和GPx活性呈下降趋势,与邢厚娟对鲤幼鱼(体重190±10 g)肝脏、脑、肾脏、鳃的组织抗氧化能力研究结果相同[22]。体内抗氧化系统受到损伤,自由基水平升高的结果相符。在以往鱼类毒理试验中,也有相似结果。Peter等研究表明[23],欧洲沙丁鱼(Sardina pilchardus)受多氯联苯(PCBs)和多环芳香烃(PAHs)影响,体内SOD、CAT活性下降,与在欧洲黄盖鲽肝脏中观察结果一致[24];冯涛等将大弹涂鱼(Boleophthalmus pectinirostris)暴露于高浓度苯并芘(BaP),随暴露时间延长和暴露浓度增加,CAT活性和GPx活性被显著抑制[25]。
过量毒性物质作用于生物有机体时,对有机体胁迫程度增高,可能会导致SOD、CAT酶清除多余活性氧的速度低于活性氧产生速度[26],使SOD、CAT彻底消耗。本试验结果验证这一现象。GPx活性变化是由于细胞膜受到氧化损伤,脏器衰老[27],生物酶活力降低,造成活性氧自由基积累,降低生物适应能力和健康水平,导致中毒反应,由于SOD、CAT、GPx三者之间具有联动效应,从而引起酶产生机制的损害,使SOD、CAT、GPx生成量进一步降低。
试验结果显示,当ATR、CPF及ATR-CPF混合处理组浓度相同时,ATR处理组SOD、CAT、GPx活性均高于CPF和ATR-CPF混合处理组,在抗氧化能力影响上,ATR与CPF存在一定的协同作用,与邢厚娟[22]对鲤幼鱼研究结论相同。
综上所述,阿特拉津和毒死蜱及其混合制剂(CPF浓度不低于25 μg·L-1,ATR、ATR-CPF浓度不低于50 μg·L-1),可通过改变酶与非酶系统抗氧化能力,使鲤初孵仔鱼氧化与抗氧化平衡发生改变,导致组织氧化损伤发生,SOD、CAT和GPx活性下降,表现为畸形率和死亡率升高。由此可见,ATR和CPF对鲤受精卵具有毒性,氧化胁迫是ATR和CPF对鲤发挥毒性作用的重要机制之一,且两者具有一定叠加效应和协同作用,试验结果有助于理解ATR、CPF及ATR-CPF混合处理组急性暴露时,对鲤胚胎期和前期仔鱼影响及其潜在性损伤。
[1]刘剑,赵菁,郑晶莹,等.除草剂阿特拉津体内生物学毒性的研究进展[J].吉林大学学报:医学版,2012,38(6):1236-1240.
[2]Stoker T E,Laws S C,Guidici,et al.The effects of atrazine on pu⁃berty in male wistar rats:an evaluation in the protocol for assess⁃ment of pubertal development and thyroid function[J].Toxicologi⁃cal Sciences,2000,58(1):50-59.
[3]Hayes T,Kelly H,Tsui M,et al.Herbicides:Feminization of male frogs in the wild[J].Nature,2002,419:895-896.
[4]Guo G H,Wu F C,He H P.Distribution characteristics and eco⁃logical risk assessment of PAHs in surface waters of China[J].Sci⁃ence China:Earth Sciences,2012,55:914-925.
[5]夏晓华,张林霞,赵炫超,等.毒死蜱对大鳞副泥鳅的急性毒性和生理毒性研究[J].湖北农业科学,2013,52(9):2116-2119.
[6]赵颖.淡水鱼类对3种农药的敏感性分布(SSDs)初探[D].杭州:浙江大学,2013:20-21.
[7]Achuba F I.Superoxide dismutase and lipid peroxidation levels in fish from the ethiope river in southern Nigeria[J].Bulletin of Envi⁃ronmental Contamination&Toxicology,2002,69(6):892-899.
[8]Xing H J,Li S,Wang Z L,et al.Histopathological changes and an⁃tioxidant response in brain and kidney of common carp exposed to atrazine and chlorpyrifos[J].Chemosphere,2012,88(4):377-383.
[9]陈粉丽,袁张松,李运彩.斑马鱼胚胎毒理学研究进展[J].湖北农业科学,2010,49(6):1484-1487.
[10]Tillitt D E,Papoulias D M,Whyte J J,et al.Atrazine reduces re⁃production in fathead minnow(Pimephales promelas)[J].Aquatic Toxicology,2010,99:149-159.
[11]Jacobson S M,Birkholz D A,McNamara M L,et al.Subacute de⁃velopmental exposure of zebrafish to the organophosphate pesti⁃cide metabolite,chlorpyrifos-ox on,results in defects in Ro⁃hon-Beard sensory neuron development[J].Aquatic Toxicology, 2010,100:101-111.
[12]李术,付瑶,李铭,等.阿特拉津和毒死蜱对鲤鱼鳃组织细胞色素P450酶系影响[J].东北农业大学学报,2013,44(6):107-111.
[13]逯娟.莠去津对斑马鱼生殖发育影响的研究[D].保定:河北大学,2009:16-17.
[14]徐立利.毒死蜱胁迫下斑马鱼胚胎蛋白质组的差异表达[D].北京:中国农业科学院,2010:28-31.
[15]李康.阿特拉津和毒死蜱对中华绒螯蟹(Eriocheirsinensis)的毒性效应研究[D].上海:华东师范大学,2005:68-69.
[16]Oberemm A.The use of a refined zebrafish embryo bioassay for the assessment of aquatic toxicity[J].Lab Animal,2000,29(7): 32-40.
[17]董武,魏强,寺冈宏树,等.二恶英诱发斑马鱼初期胚的循环系统障碍[J].中国实验动物学报,2002,10(2):69-72.
[18]Chauhan D,pandey P,Ogata A,et al.Cytohrome c-dependent and independent induction of apoptosis in multiple myeloma cells [J].J Biol Chem,1997,272:29995-29997.
[19]王重刚,郑微云,余群,等.苯并(a)芘和芘的混合物暴露对梭鱼肝脏抗氧化酶活性的影响[J].环境科学学报,2002,22(4): 529-533.
[20]邢厚娟,王海波,王敏,等.氧化胁迫在硝基苯致小鼠神经毒性中的作用[J].生物技术通讯.2007,18(4):616-618.
[21]Chance B,Sies H,Boveris A.Hydroperoxide metabolism in mam⁃malian organs[J].Physiol Rev,1979,59(3):527-605.
[22]邢厚娟.阿特拉津和毒死蜱单一及联合暴露对鲤鱼毒理作用的研究[D].哈尔滨:东北农业大学,2010:90-91.
[23]Peters L D,Porte C,Albaiges J,et al.7-Ethoxyresorufin O-deeth⁃ylase(EROD)and antioxidant enzyme activities in larvae of Sar⁃dine(Sardina Pilchardus)from the North coast of Spain[J].Ma⁃rine Pollution Bulletin,1994,28(5):299-304.
[24]Stephensen E,Svavarsson J,Sturve J,et al.Biochemical indica⁃tors of pollution exposure in shorthorn sculpin(Myoxocephalus scorpius),caught in four harbours on the southwest coast of Iceland [J].Aquatic Toxicology,2000,48:431-442.
[25]冯涛,郑微云,洪万树,等.苯并(a)芘对大弹涂鱼肝脏抗氧化防御系统的初步研究[J].海洋科学,2000,24(5):27-30.
[26]Wang X F,Xing M L,Shen Y,et al.Oral administration of Cr(Ⅵ) induced oxidative stress,DNA damage and apoptotic cell death in mice[J].Toxicology,2006,228(1):16-23.
[27]戚世媛,熊正英.女贞子提取物对运动训练大鼠不同组织抗氧化酶活性及GSH含量影响[J].东北农业大学学报,2013,44(5): 1-4.
HAN Ying,ZHAO Rongwei,HAO Qirui,JIANG Xuyang,ZHANG Hong(School of Animal Science and Technology,Northeast Agricultural University,Harbin 150030, China)
This study was aimed to explore the influence of different concentrations of atrazine(ATR), chlorpyrifos(CPF)and a mixture of them on embryonic development,hatchability and antioxidant capacity of common carp(Cyprinus carpioL.).The carp fertilized eggs was exposed to the concentrations of 12.5,25, 50,100,200 μg·L-1ATR,CPF and ATR-CPF 1∶1 mixture,respectively.After 96 h exposure,we observed their development of shape,and counted the death rate and aberration rate of the zygotes,detected antioxidant capacity of whole fish.In the exposure test,Mortality and malformation rate of treatment groups grow along with the drug concentration was on the rise;SOD,GPx and CAT activities in the newly hatched larvae of common carp as a whole were on the decline.The results indicated that ATR and CPF had some lethal and teratogenic effect on zygote of common carp,moreover,to a certain degree extent,the biotoxicity of these two toxic substances had additive effect and synergy,oxidative stress was one of the pivotal mechanism which ATR and CPF brought toxic effect to common carp.
atrazine;chlorpyrifos;carp;morphological development;oxidation resistance
S965.116
A
1005-9369(2015)07-0076-07
时间2015-7-9 14:42:39[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150709.1442.008.html
韩英,赵荣伟,郝其睿,等.阿特拉津和毒死蜱对鲤胚胎发育的影响[J].东北农业大学学报,2015,46(7)∶76-82.
Han Ying,Zhao Rongwei,Hao Qirui,et al.Effect of atrazine and chlorpyrifos on embryonic of common carp(Cyprinus carpioL.)[J].Journal of Northeast Agricultural University,2015,46(7)∶76-82.(in Chinese with English abstract)
2014-03-27
黑龙江省自然科学基金面上项目(AC200934);黑龙江博士后资助项目(LRB10-633)
韩英(1963-),女,教授,博士,博士生导师,研究方向为水产动物遗传育种与繁殖、水生生物与环境。E-mail:hanying_ 606@163.com
Effect of atrazine and chlorpyrifos on embryonic of common carp (Cyprinus carpioL.)/

