东北酸菜传统自然发酵过程中的真核微生物多样性
李超,张力群,刘通,吴昊,2,杨洪岩,2*
(1.东北林业大学生命科学学院,哈尔滨150040;2.东北林业大学大庆生物技术研究院,黑龙江大庆163316)
东北酸菜传统自然发酵过程中的真核微生物多样性
李超1,张力群1,刘通1,吴昊1,2,杨洪岩1,2*
(1.东北林业大学生命科学学院,哈尔滨150040;2.东北林业大学大庆生物技术研究院,黑龙江大庆163316)
文章为调查东北酸菜传统自然发酵过程中的真核微生物多样性,监测酸菜发酵体系生理生化动态变化,了解真核微生物在酸菜发酵过程中的作用。分析酸菜体系pH、可溶性糖、亚硝酸盐、乳酸、乙酸、乙醇和26S rDNA片段多样性。结果表明,发酵12 d时,酸菜体系pH从发酵初始值7.3下降到4.3后维持在4.1。可溶性糖发酵18 d时,由初始15.1%DM下降到4.5%DM。亚硝酸盐第6天时达到最大,随后下降。发酵体系中检测到的挥发性产物包括乳酸、乙酸和乙醇。发酵结束时,相应浓度分别达到6.8、0.78和32.2 g·L-1。26S rDNA D1/D2区变性梯度凝胶电泳结果显示发酵过程中真核微生物种类丰富。克隆文库揭示发酵第12天时,真核微生物主要为未培养的Stramenopile和土壤真菌,发酵30 d时,除上述两类微生物外还包括Candida sake,Cystofilobasidium infirmominiatum,未培养Claclosporium和Tilletiopsis washingtonensis。土壤真菌(41%)、Candida sake(29%)、未培养Stramenopile(17%)占所有检测真核微生物的86%。研究表明,Candida sake和Cystofilobasidium infirmominiatum对发酵体系中乙醇产生起一定作用。为研究酸菜发酵机制和控制酸菜发酵质量提供技术参考。
东北酸菜;发酵;真核微生物;多样性
东北酸菜是大白菜经乳酸发酵而制成的盐渍菜。我国东北和华北各地由于冬季时间长,鲜菜不宜贮藏,广泛采用此方法制作酸菜,贮藏时间可达半年[1]。东北酸菜具有口感脆嫩、开胃健脾、提神醒脑、营养丰富、风味独特等特点。目前,酸菜生产已逐渐由家庭自制转为商业化生产。酸菜商业化生产多数采用自然发酵,存在周期长、质量不稳定等缺点[2]。为控制酸菜生产时间及保证生产质量,研究酸菜发酵过程中的微生物多样性及变化尤其必要。
一般用来发酵的新鲜蔬菜表面均附有大量微生物,主要有乳酸菌、酵母菌、霉菌、肠杆菌科细菌及假单胞菌属细菌等[3]。东北酸菜发酵也不例外,传统酸菜自然发酵过程中,细菌和真菌共同参与,形成最终成品酸菜[4-5]。已有报道表明,乳酸菌在酸菜发酵过程中起主导作用[6-7],且参与发酵的乳酸菌种类丰富多样[8-9]。检测出的乳酸菌属包括Lactobacillus,Pediococcus,Leuconostoc和Weissella,检测出的乳酸杆菌包括L.plantarum,L.brevis,L.reuteri,L.sakei,L.curvatus和L.oligofermentans[10-12]。
酸菜自然发酵是开放系统,真核微生物同样参与其中[13],然而至今为止尚无酸菜自然发酵过程中真核微生物动态的系统研究。基于此,本研究开展酸菜自然发酵过程中真核微生物多样性研究,结合发酵体系生理生化指标,探讨酸菜自然发酵过程中真核微生物可能作用,研究结果将为酸菜发酵质量控制提供技术参考。
1 材料与方法
1.1 酸菜发酵
酸菜发酵于黑龙江省绥化市新华乡农户家进行。采用传统自然发酵方法,即秋季白菜收获后,晾晒2 d进行修整,清洗后逐层码入750 L陶缸中。按盐与鲜菜比为1%(W/W)的比例把盐溶解于水中,随后倒入缸中,用石头压实。发酵平均温度为16℃,发酵时间为30 d,设3次重复。
1.2 取样
在发酵时间点提取真菌总DNA样品时,每缸取发酵液表面液体0.5 mL用于真菌菌落计数,每次取30 mL液体,取3次,5 800 g离心10 min,弃上清,底部沉淀用0.5 mL Extraction Buffer(pH 8.0)溶解,将3次重复样品合成1管,-20℃冻存。取液面下第3层白菜,挤出汁液1 mL经5 800 g离心10 min,取0.5 mL,加入0.5 mL乙腈,充分蜗旋后,静置10 min,10 800 g离心10 min后,过0.22 μm滤膜后用于有机酸分析。取白菜从外向内数第2层叶片,榨汁机匀浆后用于亚硝酸盐测定;取从白菜外向内数第3层叶片,105℃烘干后,粉碎过2 mm筛用于可溶性糖(WSC)测定。
1.3 微生物计数与化学分析
菌落计数(CFUs)采用平板稀释法,真菌采用MEA培养基[14]培养,28℃培养4~6 d计数。用注射器取液面下5 cm处0.2 mL发酵液滴于微量pH计中测定发酵液pH;可溶性糖采用蒽酮比色法测定[15];亚硝酸盐测定采用比色法[16];色谱分析有机酸条件为:5 mmol·L-1硫酸作为流动相,总程序进行时间为30 min,流速为0.6 mL·min-1,柱温40℃,进样量为10 μL,紫外检测器波长为205 nm。
统计分析采用SPSS 19.0软件,显著性水平为P<0.05。
1.4PCR与变性梯度凝胶电泳(DGGE)
总DNA提取方法采用氯化苄法[17]。提取的DNA经RNA酶纯化后,用作PCR模板。50 μL PCR扩增体系包括:15 ng模板DNA,1×buffer,0.16 mmol·L-1dNTP,1.5 mmol·L-1MgCl2,每种引物0.45 μmol·L-1,1 U的TaKaRa rTaq DNA聚合酶。用于DGGE的PCR扩增引物为26S rDNA D1区的NL1-GC和LS2[18],用于克隆文库的PCR扩增引物为26S rDNA D1/D2区的NL1 and NL4[19]。扩增程序为:95℃预变性5 min,随后95℃变性1 min,52℃退火45 s,72℃延伸1 min 30 s,扩增30个循环,最后72℃延伸6 min[20]。
DGGE分析采用Bio-Rad公司制造的DcodeTM系统。进样量为13 μL,胶厚度为1 mm,聚丙烯酰胺梯度为6%~12%,变性剂梯度为20%~60%(混合40%甲酰胺的7 mol·L-1尿素定义为变性梯度的100%)。电泳电压为200 V,温度61℃,电泳时间5 h。利用SYBR®Green I[21]对胶染色,于302 nm下拍照,切胶。不同位置条带切胶后回收,再次用NL1-GC和LS2扩增后DGGE纯化,与第1次切胶位置对应的条带切胶回收后送测序公司测
序[22]。
1.5 克隆与测序
用于克隆的PCR产物经天根DNA纯化试剂盒纯化后(Tiangen,China)连入pGEM-T Easy载体中(Promega,USA)。经转化蓝白斑筛选后建立克隆文库。采用菌落PCR方法对真菌26S rRNA D1区基因扩增,经DGGE筛选。将DGGE图谱上具有不同变性位置的克隆子对应的菌液送上海生工生物工程有限公司测序。
1.6 系统发育分析
系统发育树构建参见文献[23]。本研究所获得序列均保存在GenBank数据库中,对应核酸序列号为KF776395-KF776400。
2 结果与分析
2.1 微生物菌落计数与化学分析
微生物菌落计数与化学分析结果见表1。由表1可知,发酵体系pH在前12 d内呈现急速下降趋势,从初始的7.3下降至4.3,随后保持稳定。真菌菌落数一直呈现上升趋势,到发酵30 d时,数量级达106以上。可溶性糖含量下降主要发生在发酵前18 d,从最初的15.1%DM下降至发酵18 d的4.5%DM,最终达到3.3%DM。由于酸菜是腌制食品,在腌制过程中会产生亚硝酸盐。亚硝酸盐最高值(54.6 mg·kg-1FM)出现在发酵的第6天,第12天已经下降到23 mg·kg-1FM,且下降达到显著水平(P<0.05),随后继续下降,到发酵的第30天达到4.2 mg·kg-1FM。
发酵体系中检测到的挥发性产物主要包括乳酸、乙酸和乙醇,所有过程中均未检测到严重影响发酵品质的丁酸类物质。由表1可知,3种物质的累积主要发生在发酵的前18 d,到发酵30 d时,乳酸和乙酸浓度分别为6.8和0.78 g·L-1,乳酸含量是乙酸含量的9倍。18 d发酵后乙醇数量增加到37.5 g·L-1,发酵30 d时稳定在32.2 g·L-1。
2.2 真核微生物动态
按设定发酵时间点提取相应样品DNA,采用NL1-GC和LS2引物对发酵样品26S rDNA D1区序列扩增,PCR产物如图1所示。
采用DGGE检测酸菜发酵过程中真核微生物动态结果如图2所示。扩增片段长度约200 bp。由图2可知,Candida sake、Sinapis alba、Aiabidopsis thaliana、未培养Ascomycota和未培养土壤真菌存在于发酵体系中。发酵6 d时,只检测到未培养土壤真菌。发酵12 d时,检测到Candida sake。随着发酵持续进行,检测到的真核微生物越来越多。发酵30 d时微生物种类最多。

表1 酸菜发酵过程中微生物计数与化学分析Table 1Microbial enumeration and chemical analyses during Northeast pickled cabbage fermentation
图1 真菌26S rDNA D1区扩增后琼脂糖检测结果Fig.1Fungal amplification of 26S rDNA D1

图2 传统酸菜发酵过程中的DGGEFig.2DGGE profile during the traditional Northeast pickled cabbage fermentation
2.3 真核微生物多样性
真菌经扩增26S rDNA D1/D2区片段后,进行克隆文库分析,扩增片段长度为600 bp,PCR扩增结果如图3所示。
图3 真菌26S rDNA D1/D2区扩增后琼脂糖检测结果Fig.3Fungal amplification of 26S rDNA D1/D2

图4DGGE筛选真菌克隆子Fig.4DGGE profile of fungal clones
扩增片段经胶纯化后连入T载体,转入大肠杆菌,经蓝白斑筛选后,建立克隆文库,发酵12和30 d样品获得的克隆子分别为90和116,图4为DGGE筛选克隆子的代表性图谱。
DGGE筛选后的克隆子对应的序列经测序后,构建系统发育树,结果如图5所示。
检测到的微生物包括未培养Cladosporium、Candida sake、Cystofiloba infirmominiatum、Tilletiopsis washingtonensis、未培养Stramenopile和未培养土壤真菌。发酵12和30 d样品中各微生物所占比例如表2所示。
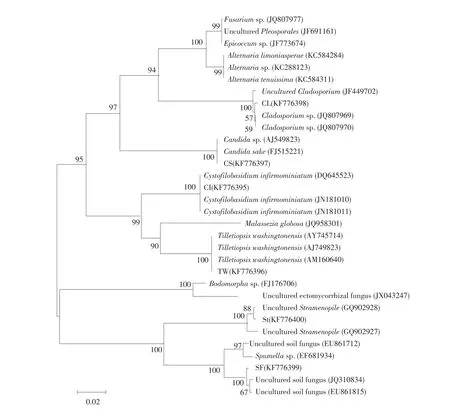
图5 酸菜发酵过程中26S rDNA D1/D2区系统发育分析Fig.5Phylogenetic analysis based on the sequences of the 26S rDNA D1/D2 region during Northeast pickled cabbage fermentation

表2 发酵12和30 d样品中各真核微生物所占比例Table 2Eukaryotic microbial proportion according the cloning libraries at 12 and 30 d fermentation
由表2可知,发酵12 d时,未培养Stramenopile所占比例最高,达到91%,另外检测到的微生物为未培养土壤真菌。发酵30 d时,除检测到上述两种真核微生物外,还检测到Candida sake、Cystofilobasidium infirmominiatum、未培养Cladosporium和Tilletiopsis washingtonensis。未培养土壤真菌、未培养Stramenopile和Candida sake占总检测微生物的86%。
3 讨论
蔬菜发酵过程中会产生各种变化,微生物是引起变化的主因[9,24-25]。本研究中,pH下降主要发生在发酵的前12 d,有机酸积累主要发生在发酵前18 d,而在这个过程中真菌数量均呈上升趋势。由此可见,开放酸菜发酵体系中,有机酸的量不足以达到彻底抑制真菌目的。体系内可溶性糖在发酵过程中急剧下降,糖的消耗主要源于乳酸菌中细菌消耗,随之产生大量有机酸。体系中亚硝酸盐在发酵前6 d增长快速,之后迅速下降,与其他发酵蔬菜相关研究获得结果类似[26-28]。研究表明,乳酸菌可消耗发酵体系的亚硝酸盐[27,29-30]。本研究中亚硝酸盐下降可能与乳酸菌迅速增殖有关。
酸菜发酵是开放式发酵过程,在这个过程中原核微生物和真核微生物均有参与[31]。酸菜发酵后期细菌多样性的报道已有很多,但真核微生物鲜见报道。本研究第一次利用DGGE与克隆文库结合方式对酸菜发酵过程中的真核微生物多样性及动态进行分析。来自DGGE的结果表明,酸菜自然发酵过程中,真核微生物丰富,且随着发酵过程延长,真核微生物结构逐渐多样化。
根据克隆文库分析结果,发酵起始阶段Stramenopile占所有克隆子的91%。发酵后期,该微生物比例下降到10%。该结果表明,Stramenopile增加主要发生在发酵起始阶段。Beloqui等报道Stramenopiles存在于蚯蚓体内,且可能与消耗一些纤维素分解后产物有关[19]。发酵30 d时,土壤真菌数量最多。据报道,该菌近缘种(GenBank登录号为JQ310834和EU861815)曾被发现在纤维素分解过程中,且土壤氮元素循环过程中也曾发现过该菌[32-33]。Candida sake和Cystofilobasidium infirmominiatum则是可以用于生物防治的酵母[34-35]。两种酵母在本研究中的比例分别为29%和3%,即酵母占所有真核微生物的32%。本研究中还检测到Claclosporium和Tilletiopsis washingtonensis,在以往蔬菜发酵研究文献中,尚无报道,其功能有待进一步研究。
4 结论
本研究首次采用分子生态学方法检测东北酸菜传统发酵过程中的真核生物多样性。结果显示,发酵体系中乙醇增加与体系中存在大量酵母有关。本研究中检测到大量Stramenopile和土壤真菌。其功能和机理需深入研究。本试验结果为研究传统酸菜发酵机理具有借鉴意义,对酸菜质量控制具有一定参考作用。
[1]章善生.中国酱腌菜[M].北京:中国商业出版社,1994.
[2]尼海峰,邓冕冯月玲.东北酸菜产业现状与发展对策[J].中国调味品,2011,36(6):10-12.
[3]施安辉,周波.蔬菜传统腌制发酵工艺过程中微生物生态学的意义[J].中国调味品,2002(5):32-35.
[4]Fleming H P,Kyung K H,Breidt F.Vegetable fermentations[M]. New York:VCH Publishers,Inc.1995.
[5]Nguyen,T L D,Van Hoorde K,Cnockaert M,et al.A description of lactic acid bacteria microbiota associated with the production of traditional fermented vegetables in Vietnam[J].International Journal of Food Microbiology,2013,163(1):19-27.
[6]Jung J Y,Lee S H,Kim J M.et al.Metagenomic analysis of kimchi,a traditional Korean fermented food[J].Applied and Environmental Microbiology,2011,77:2264-2274.
[7]Jung J Y,Lee S H,Lee H J,et al.Effects of Leuconostoc mesenteroides starter cultures on microbial communityes and metabolites during kimchi fermentation[J].International Journal of Food Microbiology,2012,153:378-387.
[8]Fleming H P,McFeeters R F,Humphries E G.A fermentor for study of sauerkrau fermentation[J].Biotechnol Bioeng,1988,31:189-197.
[9]Plengvidhya V,Breidt F,Lu Z,et al.DNA fingerprinting of lactic acid bacteria in sauerkrau fermentations[J].Applied and Environmental Microbiology,2007,73(23):7697-7702.
[10]张鲁冀,孟祥晨.自然发酵东北酸菜中乳杆菌的分离与鉴定[J].东北农业大学学报,2010,41(11):125-131.
[11]燕平梅,柴政,薛文通,等.培养和非培养方法分析发酵白菜卤乳酸菌的多样性[J].微生物学报,2009,49(3):383-388.
[12]Yang H,Zou H,Qu C,et al.Dominant microorganisms during the spontaneous fermentation of suan cai,a Chinese fermented vegetable[J].Food Sci Technol Res,2014,20(5):915-926.
[13]钟之绚,郭剑.酸白菜发酵中乳酸菌群的分析[J].微生物学报, 1995,35(1):74-75.
[14]Lin C,Bolsen K K,Brent B E,et al.Epiphytic microflora on alfalfa and whole-plant corn[J].J Dairy Sci,1992,75:2484-2493.
[15]Thomas T A.An automated procedure for the determination of soluble carbohydrates in herbage[J].Journal of the Science of Food and Agriculture,1977,28:639-642.
[16]Ito Y,Yodoshi M,Tanaka J I,et al.Comparison of two methodsand improvements for colorimetric determination of nitrite in cod roe[J].Journal of Food Protection,1979,42:715-718.
[17]Zhu H,Qu F,Zhu L H.Isolation of genomic DNAs from plant, fungi and bacteria using benzyl chloride[J].Nucleic Acids Research,1993,21:5278-5280.
[18]Flórez A B,Mayo B.Microbial diversity and succession during the manufacture and ripening of traditional,Spanish,blue-veined Carbrales cheese,as determined by PCR-DGGE[J].International Journal of Food Microbiology,2006,110:165-171.
[19]Beloqui A,Nechitaylo T Y,Lopez-Cortes N.et al.Diversity of glycosyl hydrolases from cellulose-depleting communities enriched from casts of two earthworm species[J].Applied and Environmental Microbiology,2010,76(17):5934-5946.
[20]Yang H Y,Wu H,Wang X F,et al.Selection and characteristics of a switchgrass-colonizing microbial community to produce extracellular cellulases and xylanases[J].Bioresource Technology, 2011,102:3546-3550.
[21]Pedro M S,Haruta S,Hazaka M.et al.,Denaturing gradient gel electrophoresis analyses of microbial community from field-scale composter[J].Journal of Bioscience and Bioengineering,2001, 91:159-165.
[22]Yang H Y,Gao L J,Wang X F,et al.Effects of cultivation conditions on the diversity of microbes involved in the conversion of rice straw to fodder[J].Journal of Environmental Sciences,2007, 19(1):67-73.
[23]Yang H Y,Xang X F,Liu J B,et al.Effects of water-soluble carbohydrate content on silage fermentation of wheat straw[J].Journal of Bioscience and Bioengineering,2006,101(3):232-237.
[24]Lee J S,Heo G Y,Lee J W.et al.Analysis of kimchi microflora using denaturing gradient gel electrophoresis[J].International Journal of Food Microbiology,2005,102:143-150.
[25]Xiong T,Guan Q,Song S,et al.Dynamic changes of lactic acid bacteria flora during Chinese sauerkrau fermentation[J].Food Control,2012,26:178-181.
[26]Park K Y,Cheigh H S,Kimchi and nitrosamines[J].Korean Journal of Food Nutrition,1992,21:109-116.
[27]Yan P M,Xue W T,Tan S S,et al.Effect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J].Food Control,2008,19:50-55.
[28]Hou J C,Jiang C G,Long Z C.Nitrite level of pickled vegetables in Northeast China[J].Food Control,2013,29:7-10.
[29]Oh C K,Oh M C,Kim S H.The depletion of sodium nitrite by lactic acid bacteria isolated from kimchi[J].J Med Food,2004(7):38-44.
[30]Wang X H,Ren H Y,Liu D Y,et al.Effects of inoculating Lactobacillus sakei starter cultures on the microbiological quality and nitrite depletion of Chinese fermented sausages[J].Food Control, 2013,32:591-596.
[31]Zhong Z X,Guo J.The analyses of lactic acid bacteria during suan cai fermentation(in Chinese)[J].Acta Microbiologica Sinica, 1995,35:74-75.
[32]Eichorst S A,Kuske C R.Identification of cellulose-responsive bacterial and fungal communities in geographically and edaphically different soils by using stable isotope probing[J].Appl and Environmental Microbiology,2012,78(7):2316-2327.
[33]Nemergut D R,Townsend A R,Sattin S R,et al.The effects of chronic nitrogen fertilization on alpine tundra soil microbial communities:implications for carbon and nitrogen cycling[J].Environ Microbiol,2008,10(11):3093-3105.
[34]Liu J,Wisniewski M,Droby S,et al.Glycine betaine improves oxidative stress tolerance and biocontrol efficacy of the antagonistic yeast Cystofilobasidium infirmominiatum[J].International Journal of Food Microbiology,2011,146(1):76-83.
[35]Morales H,Sanchis V,Usall J,et al.Effect of biocontrol agents Candida sake and Pantoea agglomerans on Penicillium expansum growth and patulin accumulation in apples[J].Int J Food Microbiol,2008,122(1-2):61-67.
Eukaryotic microorganism diversity during traditional natural fermented Northeast pickled cabbage/
LI Chao1,ZHANG Liqun1,LIU Tong1,WU Hao1,2,YANG Hongyan1,2
(1.School of Life Sciences,Northeast Forestry University,Harbin 150040,China;2.Daqing Bio-Tech Institute,Northeast Forestry University,Daqing Heilongjiang 163316,China)
In this study,eukaryotic diversity during Northeast pickled cabbage fermentation was investigated,and biochemical indices and microbial succession were measured.The pH decreased to 4.3 after 12 days of Northeast pickled cabbage fermentation from the initial 7.3,and then remained at approximately 4.1. Water-soluble carbohydrate content decreased from 15.1%to 4.5%of dry matter at 18 days of fermentation. At 6 days,nitrite content was the maximum,and then decreased dramatically.Lactic acid,acetic acid and ethanol were the main volatile products identified.At the end of fermentation,the concentrations of lactic acid and acetic acid were 6.8 and 0.78 g·L-1,respectively.The ethanol concentration was 32.2 g·L-1.The results of 26S rDNA D1/D2 region DGGE and clone library analysis showed that eukaryotic diversity was rich during fermentation.The results from the cloning libraries revealed that the eukaryotic microorganisms detected included unculturedStramenopileand uncultured soil fungus at 12 days fermentation.Candida sake,Cystofilo-basidiuminfirmominiatum,unculturedClaclosporiumandTilletiopsis washingtonensiswere also detected until 30 days of fermentation,in addition to the two species mentioned above.Uncultured soil fungus(41%), Candida sake(29%)and unculturedStramenopile(17%)accounted for 86%of the eukaryotic microorganisms detected.The results indicated thatCandida sakeandCystofilobasidium infirmominiatum(yeasts)contributed to ethanol production during the Northeast pickled cabbage fermentation.These results provided a comprehensive understanding of the traditional Northeast pickled cabbage fermentation process and a foundation for controlling Northeast pickled cabbage fermentation and quality.
Northeast pickled cabbage;fermentation;eukaryotic microorganism;diversity
TS205.5
A
1005-9369(2015)09-0052-07
时间2015-9-23 9:38:11[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150923.0938.014.html
李超,张力群,刘通,等.东北酸菜传统自然发酵过程中的真核微生物多样性[J].东北农业大学学报,2015,46(9):52-58.
Li Chao,Zhang Liqun,Liu Tong,et al.Eukaryotic microorganism diversity during traditional natural fermented Northeast pickled cabbage[J].Journal of Northeast Agricultural University,2015,46(9):52-58.(in Chinese with English abstract)
2014-12-29
中央高校基本科研业务费专项基金项目(2572015CA16);国家自然科学基金项目(31301543);大庆市科技计划项目(sjh-2013-30)
李超(1982-),男,讲师,硕士,研究方向为微生物生态学。E-mail:84336185@qq.com
*通讯作者:杨洪岩,副教授,研究方向为微生物生态学。E-mail:cnyanghy@163.com

