温度与光强对高山杜鹃催花期间花芽营养物质积累的影响
鲜小林,陈 睿
(四川省农业科学院园艺研究所;农业部西南地区园艺作物生物学与种质创制重点实验室,成都610066)
高山杜鹃(Rhododendron hybrides)是丰富的杜鹃资源中的一大类,是指杜鹃花中无鳞杜鹃花亚属、有鳞杜鹃花亚属、马银花亚属中的常绿杜鹃以及由上述3个亚属经过上百年杂交培育出来的园艺新品种。高山杜鹃原种70%源于中国,100多年以前流入欧洲,经过上百年的研究,欧洲人用中国杜鹃的原种与欧美品种杂交培育出了众多栽培品种。高山杜鹃有巨大的总状伞型花序、鲜艳的色彩、优美的花姿、漂亮的株型,深受人们的喜爱,已经成为公认的高档盆花,还在园林绿化、美化环境中具有很高的价值[1]。高山杜鹃的自然花期是在3~5月份,最适生长温度是15 ℃~25 ℃,喜半荫环境。因此,四川成都地区必须采取催花措施方能在春节前开放。常用的催花方法有加温和补光等。研究表明,温度和光照强度能影响植物体内可溶性糖、淀粉等营养物质的积累,从而影响植物花芽分化和开花[2-4],杜鹃属植物的生长主要受日长的控制和温度、光照强度的影响[5]。但目前国内对高山杜鹃花期调控,特别是催花方面的生理生化研究报道较少。本研究通过探讨不同温度和光照强度下高山杜鹃花芽内可溶性糖、淀粉、可溶性蛋白和游离氨基酸含量的变化,以期揭示温度和光照强度与高山杜鹃内源营养物质的关系,掌握温度和光强对高山杜鹃始花期的影响,为高山杜鹃冬季催花提供理论依据,并能够根据不同花期要求提高催花效率,使高山杜鹃提前进入年宵花市场。
1 材料和方法
1.1 试验材料
试验材料来源于四川省农业科学院园艺研究所新都试验基地,品种系德国引进,经过2年培育。选用冠幅50~60cm、长势一致且无病虫害的高山杜鹃品种(Rhododendron hybrides‘Germania’)盆栽苗为试验材料。生长期间进行正常肥水管理。
1.2 试验设计
供试植株花芽形成且膨大后于2013年1 月5日移入温室大棚进行催花处理。为使试验与实际生产环境更加接近,采用人工加温(锅炉加温)的方式设置6 ℃/0 ℃(白天温度/晚上温度,下同)(CK)、22 ℃/16 ℃、30 ℃/24 ℃等 低、中、高3 个 温 度 梯度,同时通过调节荧光灯的数量,设置2 000/10lx(白天光强/夜晚光强,下同)(CK)、7 500/5 500lx和10 000/8 000lx等低、中、高3个光照强度梯度,共组成9(3×3)种温度和光照强度处理组合。每个处理2盆,重复3次,不同处理之间用不透明的黑色幕布隔断,避免干扰。
1.3 测定指标及方法
从试验开始前1d(2013年1月4日)计算,每7 d采样1次,共5次。每个处理随机选取植株冠幅顶端发育正常的花蕾5 个,重复3 次,放入封口袋中,迅速用冰壶带回试验室,用液氮冷冻后放入-70℃冰箱低温保存,用于营养物质含量测定。因考虑市场需求和实际催花成本(加温),当第1株高山杜鹃进入盛花期时停止催花(2月1日)。以第1朵花开放起,统计到2月1日为止各处理植株的始花期时间。
可溶性糖和淀粉含量的测定采用[6]蒽酮比色法;可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[7];游离氨基酸含量的测定采用茚三酮显色法[8]。
1.4 数据处理和分析
采用Excel 2007 和SPSS 13.0 对 数 据 进 行 处理和显著性分析。
2 结果与分析
2.1 不同温度光强对高山杜鹃始花期的影响
高山杜鹃进入始花期标志着其商品性状逐渐成熟,可上市销售。高山杜鹃经过不同温度和光强处理后,截至2013年2月1日,9个处理组中有5个相继进入始花期。各处理组始花期如表1所示:高温/高光照处理组率先于2013年1月23日开花,相对于2013年春节提早开花半个多月;其次是高温/中光照,1月25日进入始花期,提前开花16d;接着中温/高光照和高温/低光照先后进入始花期,分别提前开花13d和12d;中温/中光照处理组在2月1日也进入始花期,提前9d开花。由此可初步将9个高山杜鹃催花处理分为3级:Ⅰ级为催花效果非常好的处理,即高温/高光照和高温/中光照;Ⅱ级为催花效果较好的处理,即高温/低光照、中温/高光照和中温/中光照;其余没有在预期日期前开花的处理归为Ⅲ级,催花效果较差。
2.2 不同温度光强对高山杜鹃催花期间可溶性糖含量的影响
由表2可以看出:催花期间,高山杜鹃花芽中可溶性糖含量的变化总体上随着温度和光强的升高而增加;在同一处理水平条件下,随着催花时间的延长,各处理组可溶性糖含量总体都呈逐渐上升趋势。其中,除中温/低光照组外,其他各处理组的可溶性糖含量在1月11日就与处理前(1月4日)相比均差异显著(P<0.05);到2月1日,各处理组可溶性糖含量均达到最大值,并以高温/高光照组可溶性糖含量最大,比低温/低光照组(CK)显著高出46.93%,其次是高温/中光照和中温/高光照处理,分别显著高出CK 46.27%和34.98%。同一时期(2月1日),高山杜鹃花芽中的可溶性糖含量在同一温度条件下与光照强度呈正相关关系,在同一光强条件下与温度呈正相关关系,但在相同光强下可溶性糖含量随温度变化的增幅更加明显。另一个值得注意的现象是:在催花期间,大部分情况下可溶性糖含量在各处理组之间存在低温/高光照>中温/低光照、中温/高光照>高温/低光照的现象。以上结果表明随着催花时间的延长,高山杜鹃花芽表现出明显的可溶性糖积累现象,而且温度和光强越高这种现象越明显,但温度对于累积现象的作用更加明显,昼夜温度越高,花芽发育越快,可溶性糖含量也越高;且一定的温度和光强对于高山杜鹃花芽可溶性糖含量积累存在叠加效应。这些数据与高温组和中温/高光照组处理提前进入始花期的观察结果是吻合的。
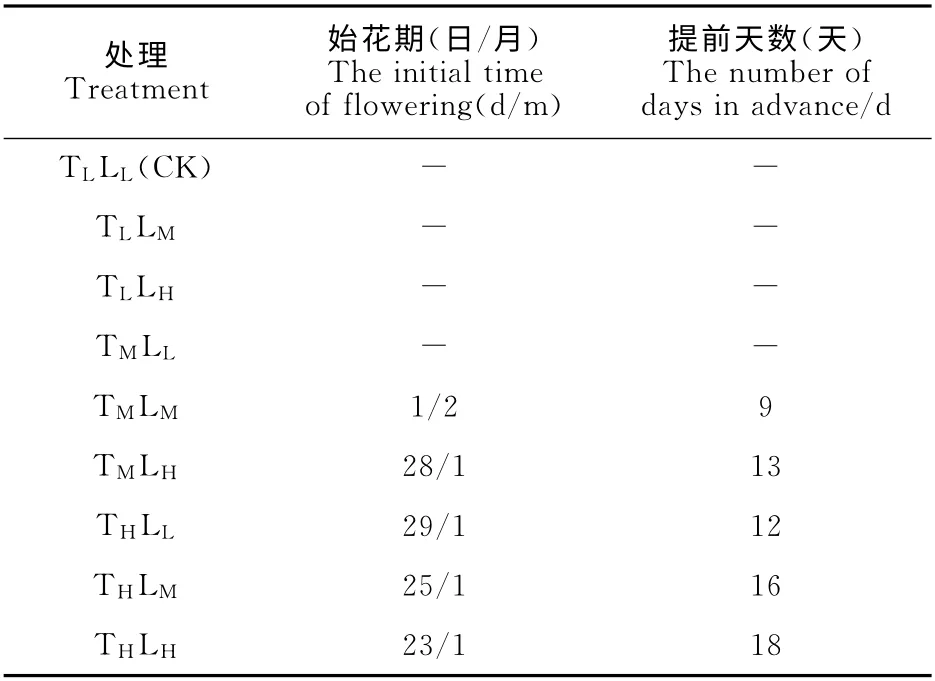
表1 不同温度和光强处理下高山杜鹃始花期的变化Table 1 The initial time of flowering of R.hybrides under different temperatures and light intensities
2.3 不同温度光强对高山杜鹃催花期间淀粉含量的影响
如表3所示,催花期间高山杜鹃花芽淀粉含量随着时间的延长而增加,这一变化与可溶性糖含量大体一致。同一处理条件下,各处理组淀粉含量在1月11 日均与处理前就达到差异显著水平(P<0.05);1月11~18日间,各处理组淀粉含量变化不明显;1月18日后,各处理组淀粉含量迅速增加,到2月1日均达到最大值。在2月1日,高温/高光照处理下的高山杜鹃花芽淀粉含量最大,显著高出CK 约75.37%,其次为高温/中光照和中温/高光照处理组,分别显著高于CK 约65.67%和55.97%。这一时期,高山杜鹃花芽淀粉含量在同一温度处理下与光照强度呈正比,在同一光强处理下与温度也呈正比,且淀粉含量随温度升高的增幅更加明显。同样,一定的温度和光强对淀粉含量的变化存在叠加效应,如低温/高光照>中温/低光照,中温/高光照>高温/低光照。综上,在整个催花期间高山杜鹃花芽的淀粉含量与可溶性糖变化趋势一致,随着催花时间的延长和温度、光强的增加,积累现象也越明显,且高山杜鹃花芽淀粉含量的变化在不同温度条件下更为敏感,而温度和光照强度对于淀粉含量的影响也具有一定的互补作用。
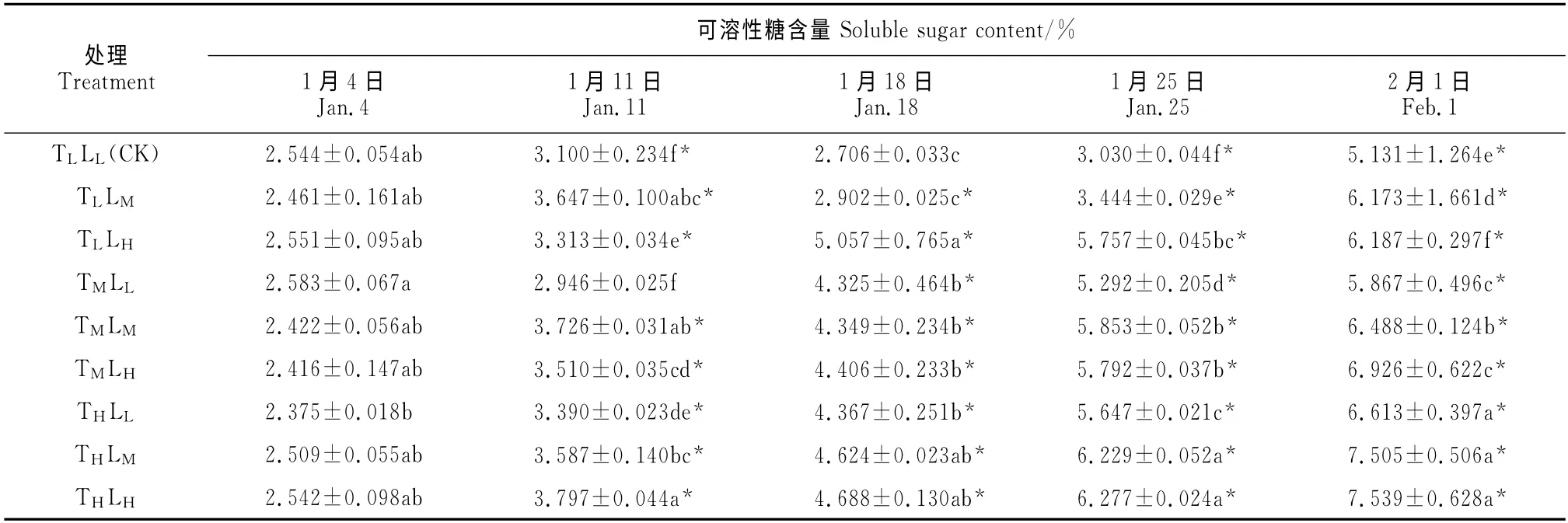
表2 不同温度和光强处理下高山杜鹃花芽可溶性糖含量的变化Table 2 The soluble sugar contents in buds of R.hybrides under different temperatures and light intensities
2.4 不同温度光照对高山杜鹃催花期间可溶性蛋白含量的影响
催花期间高山杜鹃花芽可溶性蛋白的含量也发生了一系列变化,具体如表4所示:在同一处理水平下,低温/低光照(CK)、低温/中光照和低温/高光照处理组的可溶性蛋白含量随催花时间的延长而增加;其他处理组则呈现出先上升后下降的趋势。其中,3个低温组峰值出现在2 月1 日;中温/低光照和中温/中光照两组峰值出现在1月25日;中温/高光照、高温/低光照、高温/中光照和高温/高光照的峰值出现在1 月18 日,分别显著高于同期CK 约35.78%、26.97%、30.32和57.96%。催花前半段时期(1月4日~1月18日),高山杜鹃花芽可溶性蛋白含量与温度、光强分别呈正相关关系;到2月1日,高山杜鹃花芽可溶性蛋白含量在同一温度下(除低温)与光强呈负相关,在同一光强下与温度呈负相关,且随温度降低可溶性蛋白含量下降更剧烈。结果表明,高山杜鹃花芽可溶性蛋白含量的变化随催花阶段的不同而有所差异,前期的光温处理使花芽累积大量可溶性蛋白,随着花芽的成熟,光温处理,特别是温度的增加促进了植株的生长代谢,从而消耗了可溶性蛋白致使其含量下降。
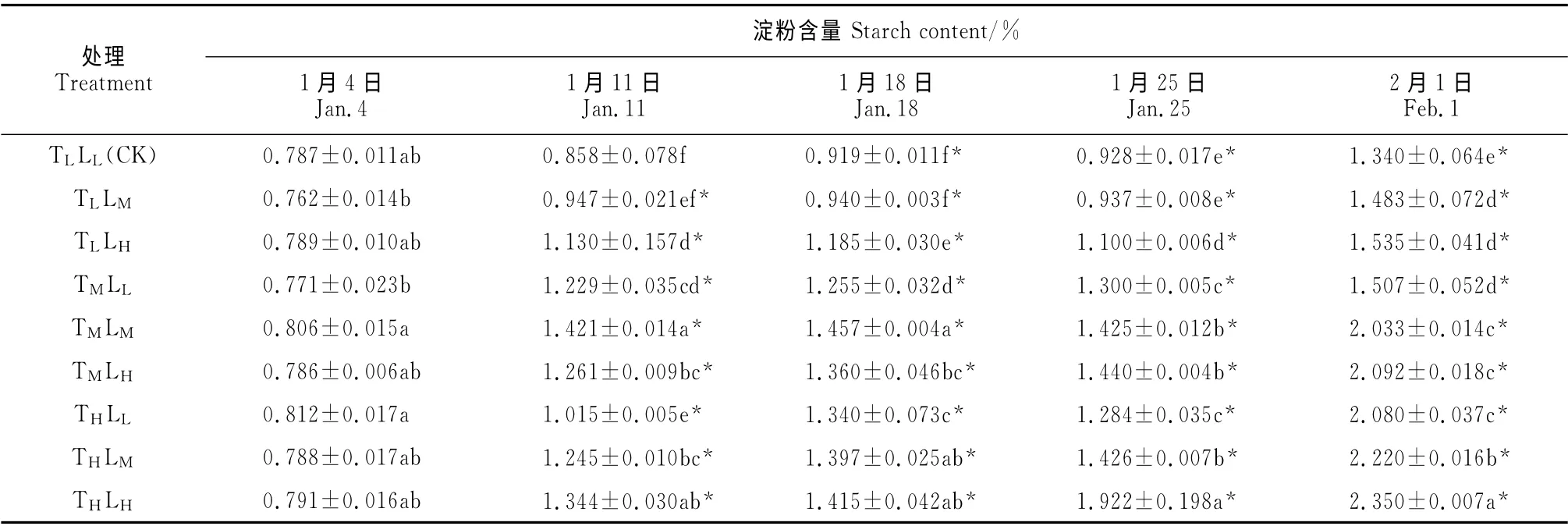
表3 不同温度和光强处理下高山杜鹃花芽淀粉含量的变化Table 3 The starch contents in buds of R.hybrides under different temperatures and light intensities
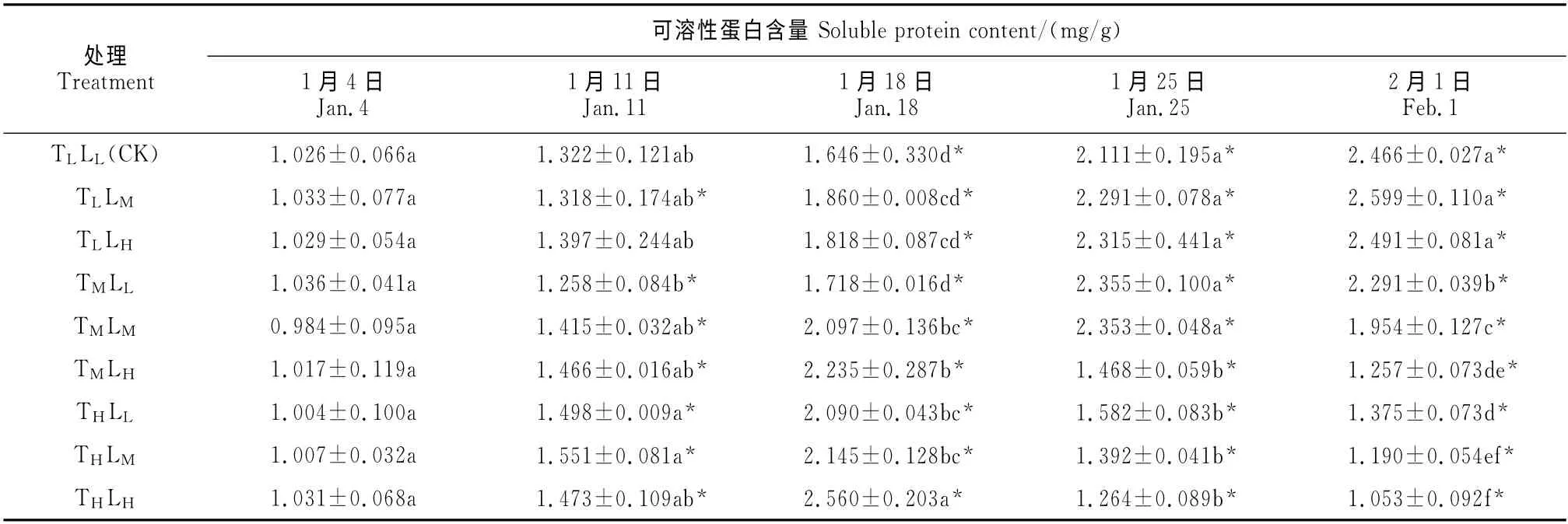
表4 不同温度和光强处理下高山杜鹃花芽可溶性蛋白含量的变化Table 4 The soluble protein contents in buds of R.hybrides under different temperatures and light intensities
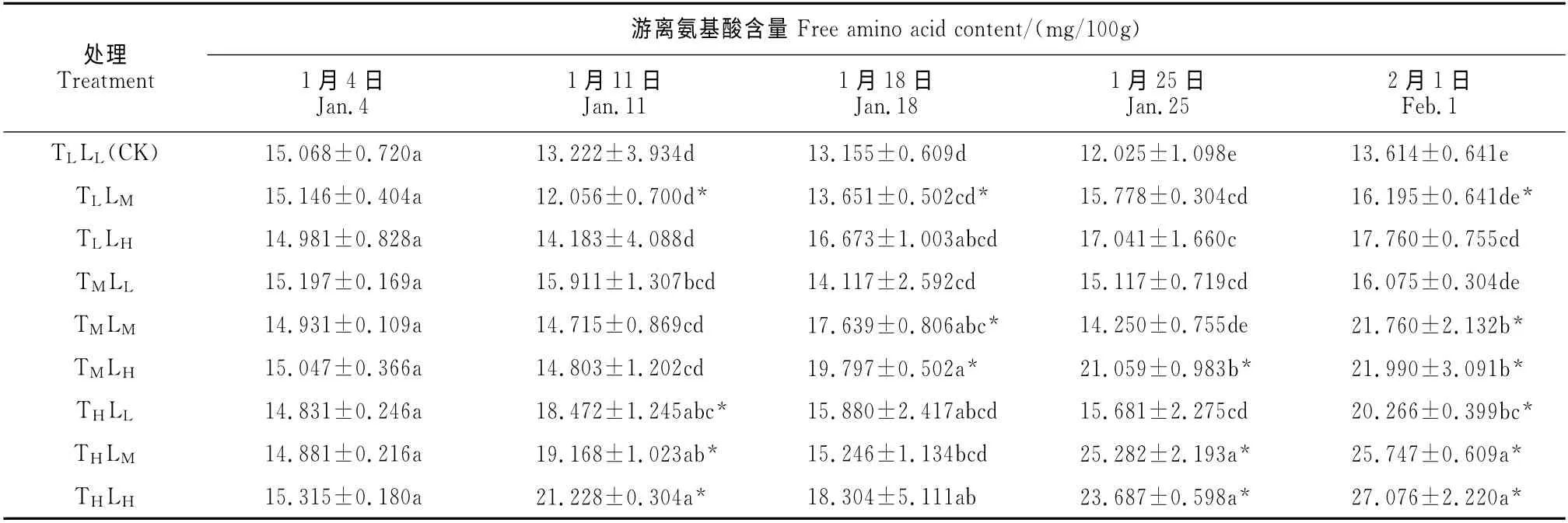
表5 不同温度和光强处理下高山杜鹃花芽游离氨基酸含量的变化Table 5 The free amino acid contents in buds of R.hybrides under different temperatures and light intensities
2.5 不同温度光强对高山杜鹃催花期间游离氨基酸含量的影响
高山杜鹃催花期间游离氨基酸含量的变化如表5所示:同一处理条件下,低温/低光照(CK)处理的游离氨基酸含量随催花过程波动下降,而其他处理组总体增加。低温/中光照和低温/高光照组在1月11日达到最低值后小幅上升;中温和高温组游离氨基酸含量则表现为先升后降再升的波动增加。到2月1日,除CK 外,各处理组游离氨基酸含量均达到峰值,其中的高温/高光照组含量最高,比CK 显著高出98.88%,其次是高温/中光照和中温/高光照,分别较CK 高出89.12%和61.52%。这一时期,高山杜鹃花芽的游离氨基酸含量在同一温度或同一光强条件下,分别与对应的光强或温度呈正相关关系,且在温度的影响下变化更大。结果表明,随着催花时间的延长以及温度和光照强度的增加,高山杜鹃花芽内游离氨基酸含量呈现总体波动增加的趋势;相对于光照强度而言,高山杜鹃花芽的游离氨基酸含量随温度的增加其增幅更大。
3 结论与讨论
3.1 温度光强与高山杜鹃催花期可溶性糖、淀粉含量的关系
可溶性糖既是结构物质,同时也是能源物质,大量的实验研究表明成花植物的花芽分化需要大量的可溶性糖[9-10],其含量的高低反映了植物体内可利用态物质和能量的供应基础[11]。朱高浦[12]在杜鹃红山茶时发现,花芽可溶性糖含量在生理分化末期时达到最高。本实验开始时,高山杜鹃花芽分化处于中后期,结果表明随着温度和光照强度的增加,促进了花芽内可溶性糖含量增加,并且随催花过程持续增加。试验末期,高温/高光照处理组的可溶性糖含量最高,可初步认为适当高温和高光照强度能促进高山杜鹃花芽内可溶性糖的积累,从而为开花提供物质准备。从低温/高光照>中温/低光照,中温/高光照>高温/低光照可以推测,光强对温度具有一定的补充效应,从而使高山杜杜鹃在较低温度和较高光照强度共同处理下的可溶性糖含量更高。
淀粉在植物中一般作为一种储藏性同化物加以利用。张姝媛等[13]的研究证明,紫丁香花芽分化初期花芽淀粉稍有积累,随着花芽形态分化开始,花芽中淀粉含量呈下降趋势。同时也有一些研究表明,在成花诱导时,淀粉可以水解为还原糖和可溶性糖供花芽分化时利用[14]。本试验结果显示,高山杜鹃花芽淀粉含量并没有出现下降趋势,而是随催花时间延长而增加,并与温度和光照强度呈正相关。淀粉的变化趋势虽与可溶性糖大体一致,但其增加的幅度远低于可溶性糖含量,可解释为淀粉部分水解提高了可溶性糖浓度。
3.2 温度光强与高山杜鹃催花期可溶性蛋白、游离氨基酸含量的关系
蛋白质是维系植物生命的重要基础物质,参与各种代谢,其含量高低是了解植物体总代谢的一个重要指标。蛋白质在细胞内的合成和降解处于一种动态平衡,蛋白质水解后产生的游离氨基酸分别以不同途径进入呼吸代谢[15],在花芽分化时需要量很大[16]。本试验中,低温处理组高山杜鹃花芽可溶性蛋白含量在整个催花过程中持续上升,中温和高温处理组在前期上升,后期转而下降。这与郁金香花芽分化期可溶性蛋白含量变化一致[17]。中温/中光照-高温/高光照处理组在催花中期可溶性蛋白的大幅下降可理解为光温处理促进了高山杜鹃的生理代谢和生长,消耗了大量可溶性蛋白的结果,其中,尤以高温/高光照下降最多。
游离氨基酸是植物体内重要的氮代谢中间产物,在植物的碳氮代谢过程中具有重要作用。本试验处理过程后期高温/中光照、高温/高光照等处理组游离氨基酸含量上升,而可溶性蛋白含量下降,说明蛋白质分解为氨基酸为DNA 复制、RNA 产生特别是合成新的蛋白质等生理变化做准备[18]。随着温度和光照强度的增加,高山杜鹃花芽内游离氨基酸含量也越多。说明温度和光照强度的提高促进了花芽的发育和膨大,大量氨基酸合成蛋白质供花芽代谢活动增强的需要。
3.3 温度光强与高山杜鹃始花期的关系
温度是调节植物由营养生长向生殖生长转变的一个主要因子,也是调节植物成花的重要因素。胡惠蓉[19]指出,在不影响春化作用而又不受其他因素(如光周期作用)影响的前提下,已诱导花芽分化的植株在较高的温度下花芽发育显著加快。孔令云[20]采用不同加温组合与栽植方式对黄瓜生产发育进行研究,结果表明白天加温6 ℃的处理始花期比对照提前。唐菖蒲在全生育期每天18:00至翌晨6:00用2盏400W 的高压钠灯(SON-T)补光,灯间距为2m,高度以测得时丛中心接受光强为5 000lx为准,其开花期比对照提前半个月左右 。本试验也得出相似结果,在同一温度或光强条件下,较高光强或加温的处理更有利于高山杜鹃提前开花。而在较高温度和光照强度共同作用下的高温/高光照处理组,因其花芽内可溶性糖、淀粉的最优累积以及可溶性蛋白与游离氨基酸的相互转化,使这一处理组最先进入始花期,相对于目标日期提前18d开花,其次是高温/中光照、中温/高光照、高温/低光照和中温/中光照。
综上所述,适当高温和高光强(温度22 ℃/16℃~30 ℃/24 ℃,光 照 强 度7 500/5 500lx~10 000/8 000lx)能有效缩短高山杜鹃催花时间,使植株提前进入始花期,从而达到提前上市的目的。由此可初步将9个光温处理组分为三级:Ⅰ级为催花效果非常好的处理,包括高温/高光照和高温/中光照;Ⅱ级为催花效果较好的处理,包括高温/低光照、中温/高光照和中温/中光照;其余处理组为Ⅲ级,催花效果较差。关于试验结果的内在机理,可能在于适当的加温和补充光照强度显著提高了花芽内可溶性糖、淀粉、可溶性蛋白和游离氨基酸的含量,促进了高山杜鹃花芽发育;当植株进入花期,代谢活动增强使可溶性蛋白大量消耗转换成游离氨基酸,从而为更多的生理代谢做准备。本试验结果还显示出,同一光照强度下温度的增加更能促进高山杜鹃花芽内营养物质的累积和转化,增强植株代谢,提前始花期,从而表明在高山杜鹃催花调控的环境因子中,温度比光强的作用更为关键。
[1] 余树勋.杜鹃花[M].北京:金盾出版社,1992:23-27.
[2] WANG J(王 静),ZOU G Y(邹国元),WANG Y Q(王益权).Study on factors affecting growth and flowering time of ornamental flowers[J].Chinese Agricultural Science Bulletin(中国农学通报),2004,20(4):225-225(in Chinese).
[3] 郑宝强.卡特兰花期调控机理及其关键栽培技术研究[D].北京:中国林业科学研究院,2009.
[4] LI SH SH(李淑顺),LI Q ZH(李倩中),TANG L(唐 玲),et al.Effects of low temperature on endogenous nutrients and dormancy release in alpine Rhododendron[J].Jiangsu J.of Agr.Sci.(江苏农业学报),2011,27(4):853-857(in Chinese).
[5] ANNELIES C,ELS P,BRUNO G,et al.Flower differentiation of azalea depends on genotype and not on the use of plant growth regulators[J].Plant Growth Regul.,2015,75:245-252.
[6] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000:110-114.
[7] 熊庆娥.植物生理学试验教程[M].成都:四川科学技术出版社,2003:81-83.
[8] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:192-194.
[9] ZHONG X H(钟晓红),LUO X SH(罗先实),CHEN A H(陈爱华).A atudy on Nai Plump’s flower bud differentiation and its major content of metabolic production[J].Journal of Hunan Agricultural University(湖南农业大学学报),1999,25(1):31-35(in Chinese).
[10] SALIH U,SAHRIYE S,MUSTAFA K,et al.Determination of endogenous hormones,sugars and mineral nutrition levelsduring the induction,initiation and differentiation stage and their effects on flower formation in olive[J].Plant Growth Regul.,2004,42:89-95.
[11] LI Q(李 倩),XIAO J ZH(肖建忠),LI ZH B(李志斌),et al.Physiological and biochemical research on critical period of floral initiation in Rhododendron hybridesJ.Journal of Agricultural University of Hebei河北农业大学学报200932147-50in Chinese.
[12] ZHU G P(朱高浦),LI J Y(李纪元),LI X L(李辛雷),et al.Morphology and physiological characteristics of flower development in Camellia changii Ye,an endangered and rare plant[J].Guihaia(广西植物),2011,31(4):507-512(in Chinese).
[13] ZHANG SH Y(张姝媛),GUO J L(郭金丽),QIN Y SH(秦永生),et al.Study on the changes of nutrient and nucleic acid at the floral bud differentiation stage of Syringa oblata[J].Acta Agricultural Boreall-Sinica(华北农学报),2008,23(4):179-183(in Chinese).
[14] ZHANG J M(张建铭),TAN F(谈 锋).The change of endogenous hormones and carbohydrate and nitrogen contents during flower bud differentiation in Gardenia jasminoides var.grandifloral[J].Journal of Southwest China Normal University(Nat.Sci.Edi.)(西南师范大学学报·自然科学版),1999,24(2):219-224(in Chinese).
[15] TIAN L L(田莉莉),FANG J B(方金豹),WANG L R(王力荣),et al.Changes of several physiological indexes during dormancy releasing in nectarine cultivar Huaguang[J].Journal of Fruit Science(果树学报),2006,23(1):121-124(in Chinese).
[16] TU SH P(涂淑萍),MU D(穆 鼎).LIU CH(刘 春).The physiological and biochemical change during flower bud differentiation of different Lily cultivars[J].Chinese Agricultural Science Bulletin(中国农学通报),2005,21(7):207-207(in Chinese).
[17] WANG X Q(汪晓谦),ZHANG Y L(张延龙).NIU L X(牛立新),et al.Changes of carbohydrate and protein contents in bulbs of Tulipa gesneriana L.[J].Plant Physiology Journal(植物生理学通讯),2011,47(4):379-384(in Chinese).
[18] TANG Y M(唐 云 明).Kinetic changes of protein and nucleic acids during dormancy release of mulberry winter buds[J].Journal of Southwest Agricultural University(西南农业大学学报),1997,19(1):75-77(in Chinese).
[19] HU H R(胡惠蓉),WANG C Y(王彩云),BAO M ZH(包满珠)Advances in flowering time regulation of ornamental plants[J].Acta Horticulturae Sinica(园艺学报),2000,27(S):522-526(in Chinese).
[20] 孔令云.不同加温组合与栽植方式对黄瓜生长发育的影响[D].长沙:湖南农业大学,2008.
[21] ZHANG X P(张效平).Effect of light intensities on development of flower-bud of Gladiolu[J].Journal of Nanjing Agricultural University(南京农业大学学报),1990,13(4):35-38(in Chinese).

