干旱胁迫下棉花幼苗转录因子BES1/BZR1对外源油菜素内酯的响应表达特征
安汶铠,常 丹,张富春
(新疆大学 生命科学与技术学院,新疆生物资源基因工程重点实验室,乌鲁木齐830046)
棉花作为新疆的主要经济作物,干旱是制约新疆棉区棉花产量和品质的主要环境因素之一。油菜素内酯(Brassinosteroid,BR)作为一种影响植物生长发育和抗逆的植物内源激素,在提高植物抗盐、抗旱、耐高温以及调节植物衰老等生理功能方面发挥重要作用[1-2]。研究表明BR能够广泛参与植物各种生理过程,调控植物生长发育以及对逆境条件下的生理响应[3-6]。经过BR喷施处理后,植物叶片含水量增加,叶片水势提高,且植物的蒸腾作用明显降低,这样既保持了细胞膨压,又能够缓解干旱胁迫,改善植物细胞中的水分状况,提高植物在干旱胁迫下的生存能力。近年来,随着BR 促进植物抗逆性研究的深入,BR已经被广泛应用于农林业的生产中[7-12]。
BZR1/BES1是BR 信号通路中一种重要的转录因子,与BR 结合后使得BRI1的羧端磷酸化,调控BKI1(BRI1kinase inhibitor1)从质膜上解离下来,使BRI1 与共受体BAK1(BRI1-associated receptor kinase)结 合[13-14],并 形 成 异 源 二 聚 体,进 而通过相互磷酸化完全激活BR 信号通路[15],异二聚体BRI1-BAK1可使得BSK 激活,BSK 又能够活化BSU11(BRI 1suppressor 1),BSU1 可 使 下 游 的BIN2 (Brassinosteroid-insensitive 2)失 活[16],而BIN2则影响BZR1/BES1的磷酸化[17]。Kim 等发现磷酸化后的BZR1/BES1 失去了核输出以及与DNA 结合的能力,并且可被蛋白酶降解,被激活的BSU1可以使BIN2的Tyr磷酸化位点去磷酸化从而抑制其活性,使得BZR1/BES1 被蛋白磷酸2A(PP2A)去磷酸化,最终在细胞核内大量积累[18]。核内聚集的BZR1/BES1能够与下游基因启动子上特定区域结合,激活转录,从而调节BR 靶基因的表达,最终调节植物的生长、发育和抗逆性能[19]。因此研究BR 信号通路中基因BZR1/BES1的表达调控机理显得尤为重要。
本研究以新疆的主栽棉花品种‘新陆早17号’的幼苗为材料,根据亚洲棉‘石系亚1号’的转录组测序中转录因子BES1/BZR1基因的开放阅读框序列[20],通过PCR 克隆获BES1/BZR1转录因子基因,命名为GhBES1/BZR1(GenBank登录号KP272000);在生物信息学分析的基础上,进一步探讨干旱胁迫下用油菜素内酯及油菜素内酯抑制剂(Z)处理棉花后,Gh-BES1/BZR1的表达变化规律,研究外源喷施植物激素BR对干旱胁迫下棉花GhBES1/BZR1表达的影响,揭示BR提高棉花抗旱能力的分子机制,为棉花生产中合理使用BR提供依据。
1 材料和方法
1.1 实验材料
棉花‘新陆早17号’种子由新疆农业科学院经济作物研究所玛纳斯实验站提供。挑选籽粒饱满大小一致的棉花种子,用70%乙醇消毒1min,蒸馏水冲洗3~4次,用15%过氧化氢浸种5h,再用蒸馏水冲洗3~4次,播种到固体MS培养基中,进行无菌培养,10d 后将棉花幼苗转至Hoagland 营养液[21]中继续进行液体培养,每隔5~7d换1次营养液,以5~6片真叶期的棉花幼苗为实验材料。
1.2 方 法
1.2.1 实验材料的处理 待棉花幼苗生长至5~6片真叶期时,用2.5% PEG-6000干旱胁迫处理24 h后,分别用水、BR(0.5mg/L)和Z(1.0mg/L,BR抑制剂)喷施。具体处理组为:(1)Hoagland营养液+蒸馏水为对照组(CK);(2)含2.5%PEG-6000的Hoagland营养液+蒸馏水(PEG);(3)Hoagland营养液+0.5mg/L BR(BR);(4)含2.5%PEG-6000的Hoagland营养液+0.5 mg/L BR(PEG+BR);(5)含2.5% PEG-6000的Hoagland营养液+0.5 mg/L BR+1.0 mg/L Z(PEG+BR+Z);(6)含2.5%PEG-6000的Hoagland营养液+1.0 mg/L Z(PEG+Z)。每隔3h进行1次喷洒处理,在0、3、6、12、24h时采集不同处理的不同棉花幼苗底部倒数第3~4片的10个叶片,分别称取0.1g棉花幼苗叶片,迅速冻于液氮中备用。
1.2.2 棉花幼苗总RNA 的提取和cDNA的合成 取0.1g棉花幼苗叶片在液氮中充分研磨,采用植物总RNA 提取试剂盒(北京百泰克公司)提取棉花总RNA,接着进行定量和电泳检测。采用Revert Aid First Strand cDNA Synthesis Kit(大连TaKa-Ra公司)试剂盒合成cDNA。
1.2.3 GhBES1/BZR1 基因的扩增和鉴定 根据亚洲棉‘石系亚1号’转录因子BES1/BZR1的开放阅读框序列,设计扩增开放阅读框的上游引物(5′-GCGCTGCTTTGAGGAAGGTATTG-3′)和 下 游引 物(5′-CTGACAGTGTTTGCTTGATGTGATGCTC-3′),以棉花幼苗叶片的cDNA 为模板,使用ExTaq酶PCR 扩增目的基因,扩增条件为94 ℃预变性5min;94℃变性30s,58℃退火30s;72℃延伸90s,30个循环;72℃延伸10min,反应产物进行琼脂糖凝胶电泳检测,回收目的基因片段,与pMD18-T 载体连接,并转化E.coli DH5α感受态细胞。挑选菌液进行PCR 及质粒酶切鉴定的阳性克隆,送上海生工生物工程有限公司进行测序。
1.2.4 GhBES1/BZR1 蛋白生物信息学分析 利用ExPASy ProtParam(http://expasy.org/tools/pi_tool.html)分析GhBES1/BZR1蛋白的理化性质及疏水性;用NCBI CDD 数据库分析蛋白质的保守结构域,用SignalP4.0Server(http://www.cbs.dtu.dk/services/SignalP)软件预测蛋白质的信号肽;Cell-PLoc 2.0PSORT(http://psort.ims.u-tokyo.ac.jp/form.html)预测蛋白质的亚细胞定位;GOR4(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl)软件预测蛋白质二级结构;NetPhos(http://www.cbs.dtu.dk/services/NetPhos)分析蛋白质的磷酸化位点;NPS Prosite Scan(http://npsa-pbil.ibcp.fr/cgi-bin/pattern_prosite.pl)分析蛋白活性位点;用MEGA 5.0软件构建系统进化树[22-23]。
1.2.5 不同处理GhBES1/BZR1基因的表达 根据GhBES1/BZR1的cDNA 序列设计上游引物(5′-TGGGATGAAATGAATGCTGGGC-3′)和下游引物(5′-AGTGTAAGTTCGAGATCATCAGCTGC-3′),以18S基因作为内参基因,设计上游引物(5′-CAACTTGCGTTCAAAGACTCGATGGTT-3′)和下游引物(5′-CAAGGAATCGAAACGAAAGAAGG-3′)。以处理组棉花幼苗叶片的cDNA 为模板,取1.0μL cDNA,qRT-PCR 参照带有ROX 的Platinum SYBR Green qPCR SuperMix-UDG(美国Invitrogen公司)试剂盒说明书进行。RT-PCR 反应参数为:94 ℃预变性15s;94 ℃变性30s;59 ℃退火30s;72 ℃延 伸45s;40 个 循 环。采 用ABI PRISM 7500实时定量PCR 仪进行检测,数据采用2-ΔΔCT法进行分析[24]。
2 结果与分析
2.1 GhBES1/BZR1基因的克隆和鉴定
以棉花‘新陆早17号’幼苗叶片的cDNA 为模板,以根据BES1/BZR1基因开放阅读框序列设计的特异性引物,通过PCR 进行GhBES1/BZR1 开放阅读框的扩增。结果表明PCR 扩增出与预测长度一致的条带(图1),测序结果表明开放阅读框为960bp,编码319 个氨基酸,提交NCBI 基因库(GenBank登录号KP272000),所获得的GhBES1/BZR1基因为正确的目的基因。
2.2 GhBES1/BZR1蛋白的理化特性和结构分析
通过在线EXPASY 的ProtParam 软件对BES1/BZR1基因编码蛋白的理化性质进行分析表明,GhBES1/BZR1蛋白的理论分子量为34.3kD,理论等电点为8.95。利用在线NCBI的保守结构域数据库(conserved domain database,CDD)对Gh-BES1/BZR1蛋白的保守结构域进行预测,结果说明GhBES1/BZR1蛋白含有一个DUF822 保守结构域,而DUF822为基因未知功能的植物蛋白,此家族由未知功能的几个植物蛋白的N 末端区域组成。利用SignalP4.0Server软件对GhBES1/BZR1 蛋白进行信号肽的预测。结果说明GhBES1/BZR1蛋白的N 端不存在剪切位点,表明其不包含信号肽,推测GhBES1/BZR1蛋白为非分泌蛋白。利用在线EXPASY 的ProtParam 软 件 对GhBES1/BZR1 蛋白的疏水性/亲水性进行预测。推测GhBES1/BZR1蛋白是一种可溶性蛋白。利用在线软件GOR4对GhBES1/BZR1 蛋白的二级结构进行预测。结果表明,GhBES1/BZR1蛋白主要由α-螺旋、无规则卷曲、延伸链构成(表1)。其中无规则卷曲结构最多,占据整条链的62.07%。α-螺旋占了24.76%,其余的全为延伸链。

图1 GhBES1/BZR1基因的PCR 扩增Fig.1 PCR amplification of GhBES1/BZR1gene M.DL2000;1,2.GhBES1/BZR1
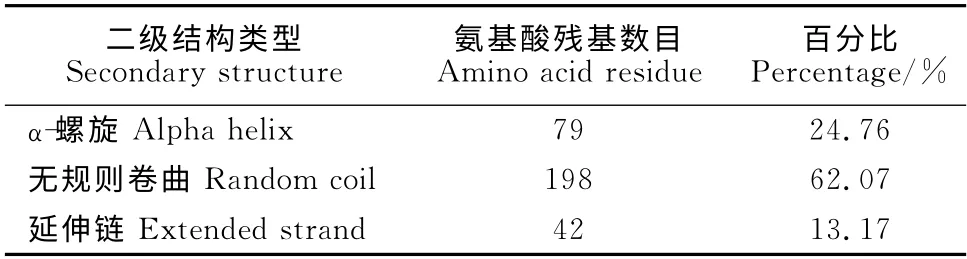
表1 GhBES1/BZR1蛋白的二级结构预测Table 1 GhBES1/BZR1protein of secondary structure prediction
2.3 GhBES1/BZR1 蛋白质磷酸化位点及活性位点的分析
磷酸化是生物体内的一种重要调节方式,主要在细胞信号转导和蛋白调控过程中发挥作用[25]。利用NPS(network protein sequence analysis)的Prosite Scan对GhBES1/BZR1蛋白进行活性位点分 析。如 表2 所 示,GhBES1/BZR1 有3 类 磷 酸 化位点和1类N-糖基化位点、1类酰胺化位点和1类豆蔻酰化位点。
2.4 GhBES1/BZR1蛋白的系统进化树
通过NCBI数据库检索GhBES1/BZR1同源蛋白序列,使用MEGA 5.0软件构建系统进化树。其结果表明GhBES1/BZR1 蛋白和可可聚类在一起(图2),Blast比对编码棉花和可可这两种植物同源蛋白的序列相似度达到99%。
2.5 干旱胁迫下不同处理GhBES1/BZR1基因的表达分析
采用qRT-PCR 方法,以18S作为内参基因,分别检测不同处理和不同时间棉花幼苗叶片Gh-BES1/BZR1的表达变化(图3)。
实验结果表明,处理3h时,PEG-6000处理相对于水处理的GhBES1/BZR1 基因表达量极显著地上调了3.9倍(P<0.01),PEG-6000处理下喷洒BR(PEG+BR)相对于其他处理基因的表达量最高,而PEG+BR 处理下再喷洒BR 抑制剂(PEG+BR+Z)相对于PEG+BR 处理有显著性的降低(P<0.05)。说明PEG 处理下喷施BR 能够显著提高GhBES1/BZR1的表达,而喷施BR 抑制剂后Gh-BES1/BZR1的表达显著降低。处理6h时,PEG+BR 处理的基因表达量相对于其他处理是最高,除PEG 处理和PEG+BR 处理外,其它处理下该基因的表达量都有所上升,PEG+BR 处理的基因表达量有所下降,但相互之间都无显著性差异(P >0.05)。说明在6h直接喷施BR 和在PEG-6000处理下喷施BR 均能够显著提高GhBES1/BZR1,而喷施BR 抑制剂后GhBES1/BZR1的表达也显著降低。处理12h时,各处理的GhBES1/BZR1表达量相对于6h处理都有所下降,而PEG+BR 处理的基因表达量依然最高,并显著性地高于PEG-6000处理和PEG+BR+Z 处理(P<0.05),分别是其1.3和1.6倍。处理24h时,PEG+BR 处理的基因表达量降低,直接喷施BR 处理的基因表达量达到最高。而PEG+Z和PEG+BR+Z处理的基因表达量只有BR 处理组的1/7 左右。说明随着PEG处理时间的延长,在PEG 处理下喷施BRGhBES1/BZR1的表达明显下降,而喷施BR 抑制剂后Gh-BES1/BZR1的表达更加显著降低,已经低于对照组,说明随着处理时间的延长,BR 抑制剂极大地降低了GhBES1/BZR1的表达。

表2 GhBES1/BZR1在NPS中活性位点预测分析Table 2 The prediction analysis of GhBES1/BZR1active site in NPS

图3 干旱胁迫下不同处理‘新陆早17号’棉花幼苗叶片中GhBES1/BZR1的相对表达不同小写字母表示同一时间不同处理下差异显著(P<0.05)Fig.3 Relative expression of GhBES1/BZR1 in the seedling leaves of cotton‘XLZ17’for the different treatments under drought stress Different letters represent significant differences among treatments under the same time(P<0.05)
3 讨 论
BR 作为一种重要的植物内源激素,在植物的生长发育和抵御干旱方面发挥作用。BES1/BZR1作为BR 信号通路中的一种重要的转录因子,其编码的BES1/BZR1蛋白是植物防御的一种内源信号分子,当植物受到各种胁迫时,可以诱导防御基因的表达去抵御外界的胁迫,并直接影响植物的生长发育同时调节植物的生理代谢过程[26-27]。
通过对棉花‘新陆早17号’GhBES1/BZR1 基因序列的生物信息学分析表明,该基因编码蛋白质的氨基酸序列与可可编码的BES1/BZR1氨基酸序列的相似性达99%,且与可可的BES1/BZR1聚在进化树的同一分支上,这表明其进化上与可可具有趋同性。利用NPS的Prosite Scan 对BES1/BZR1蛋白进行活性位点分析结果表明,GhBES1/BZR1有3类磷酸化,这可能是与GhBES1/BZR1蛋白的磷酸化参与调解干旱胁迫的信号通路有关。蛋白质的疏水性通常依据蛋白的GRAVY 值预测,而GRAVY 值通常分布在-2~2之间,正值表明蛋白为疏水蛋白,负值表明为亲水蛋白。预测显示Gh-BES1/BZR1蛋白的GRAVY 值为-4.211,说明GhBES1/BZR1 蛋白是一种可溶性蛋白,结果与BES1/BZR1蛋白不与膜结合在细胞核内与特定启动子发挥作用的结果相一致[13]。表明该蛋白可能是一种能够通过磷酸化和去磷酸化在BR 信号通路中发挥作用的可溶性蛋白。
BR 在作物上的应用主要是浸种或外源喷等,有关BR 信号转导途径中的重要组分如GhBES1/BZR1基因表达变化对作物抗旱性的影响鲜见报道。根据河南棉花所对亚洲棉进行干旱胁迫下的转录组分析发现,BR 信号通路中BES、BKI、BRI 等基因的表达上调,其中PEG 模拟干旱胁迫3h后,亚洲棉‘石系亚1 号’叶中GhBES1/BZR1 表达量上调了2.7 倍[20]。本研究结果中,PEG-6000模拟干旱胁迫,PEG+BR 处理3h 时GhBES1/BZR1基因的表达量分别是PEG 和PEG+BR+Z处理的1.9倍和1.7倍。BR 处理6和12h时,GhBES1/BZR1表达量相对于3h时都有明显下降,但喷施BR 表达量明显高于没有喷施BR 处理组,而BR+Z处理GhBES1/BZR1表达量降低,这说明喷施BR能够诱导GhBES1/BZR1表达上调,而BR 抑制剂Z能够干涉BR 的作用致使GhBES1/BZR1表达下降。喷施BR 处 理 下3h 时,GhBES1/BZR1 表 达量快速升高,表明在干旱胁迫下喷施BR 能够让GhBES1/BZR1表达快速升高以响应干旱胁迫。而喷 施BR 6、12 和24h 相 对 于3h 处 理GhBES1/BZR1表达有所下降,则表明在干旱胁迫下喷施BR对于GhBES1/BZR1表达的影响在时间上没有持久性,伴随着时间的延长诱导作用逐渐减弱,与植物激素作用快的特性相一致。在没有干旱胁迫而单独喷施BR 处理24h时,GhBES1/BZR1表达量远高于干旱胁迫下喷施BR 处理。说明干旱胁迫下喷施BR 可快速诱导GhBES1/BZR1 表达,但在没有干旱胁迫下喷施BR 诱导GhBES1/BZR1表达明显存在一定的滞后性,证明干旱胁迫下喷施BR 是Gh-BES1/BZR1快速表达诱导因素。
总之,从棉花‘新陆早17号’幼苗中克隆获得的转录因子GhBES1/BZR1,在BR 信号通路的基因调控中发挥重要作用,在干旱胁迫下外源喷施BR及BR 抑制剂Z对棉花GhBES1/BZR1基因表达有明显的影响。表明BR 是促进干旱胁迫下Gh-BES1/BZR1表达的主要诱因,干旱胁迫和非干旱胁迫喷施BR 能够直接影响GhBES1/BZR1表达水平升高的速率。进一步探讨外源喷施BR 对棉花GhBES1/BZR1表达的影响,有助于阐明BR 调控棉花抗旱性的分子机理。
[1] GUO H Q(郭慧琴),REN W B(任卫波),LI P(李 平),et al.Effect of epi-brassinosteroid and gibberellin on seed germination and seedling growth of Leymus chinensis[J].Pratacultutal Science(草业科学),2014,31(6):1 097-1 103(in Chinese).
[2] BAJGUZ A,HAYAT S.Effects of brassinosteroids on the plant responses to environmental stresses[J].Plant Physiology and Biochemistry,2009,47(1):1-8.
[3] WANG H H(王 红红),LI K R(李凯荣),HOU H W(侯华伟),et al.Research progress of plant stress-resistance promoting related to brassinolides[J].Agricultural Research in the Arid Areas(干旱地区农业研究),2005,23(3):213-219(in Chinese).
[4] LI K R(李凯荣),FAN J SH(樊金栓).Research progress brassinosteroid lactones-the new plant hormone in forestry[J].Agricultural Research in the Arid Areas(干旱地区农业研究),1998,16(4):104-109(in Chinese).
[5] SAIRAM R K.Effects of homobrassinolide application on plant metabolism and grain yield under irrigated and moisture-stress conditions of two wheat varieties[J].Plant Growth Regulation,1994,14(2):173-181.
[6] LI K R,WANG H H,HAN G,et al.Effects of brassinolide on the survival,growth and drought resistance of Robinia pseudoacacia seedlings under water stress[J].New Forests,2007,35(3):255-266.
[7] ZHANG M C,ZHAI Z X,TIAN X L,et al.Brassinolide alleviated the adverse effect of water deficits on photosynthesis and the antioxidant of soybean(Glycine max L.)[J].Plant Growth Regulation,2008,56(3):257-264.
[8] FAROOQ M,WAHID A,BASRA S M A,et al.Improving water relations and gas exchange with brassinosteroids in rice under drought stress[J].Journal of Agronomy and Crop Science,2009,195(4):262-269.
[9] XU F F(徐芬芬),XU W H(徐卫红).Induction of resistance to downy mildew in Brassica campestis ssp.chinensis L.by brassinolide[J].Journal of Henan Agricultural Sciences(河南农业科学),2013,49(5):658-665(in Chinese).
[10] WU X X(吴雪霞),ZHA D SH(查丁石),et al.Effects of exogenous 24-epibrassinolide on plant growth and antioxidant system in eggplant seedlings under high temperature stress[J].Plant Physiology Journal(植物生理学报),2013,49(9):929-934(in Chinese).
[11] 黄鲤娴.BR 相关基因转化水稻及转基因植株的耐盐性分析[D].福州:福建农林大学,2012.
[12] QIAN W J(钱文静),LIU J(刘 静),SONG D(宋 丹),et al.Research progress on brassinosteroid related genes and their functions in rice[J].Journal of Henan Agricultural Sciences(河南农业科学),2013,42(9):1-5(in Chinese).
[13] XIONG J L(熊俊兰),KONG H Y(孔海燕),SONG D(宋 丹),et al.Effects of brassinosteroids on plant drought adaptability and their regulatory mechanism[J].Journal of Lanzhou University(兰州大学学报),2013,49(5):658-666(in Chinese).
[14] WANG X L,CHORY J.Brassinosteroids regulate dissociation of BKI1,a negative regulator of BRI1signaling,from the plasma membrane[J].Science,2006,313(5 790):1 118-1 122.
[15] NAM K H,LI J.BRI1/BAK1,a receptor kinase pair mediating brassinosteroid signaling[J].Cell,2002,110(2):203-212.
[16] TANG W Q,KIM T W,OSES P J A,et al.BSKs mediate signal transduction from the receptor kinase BRI1in Arabidopsis[J].Science,2008,321(5 888):557-560.
[17] KIM T W,GUAN S H,SUN Y,et al.Brassinosteroid signal transduction from cell-surface receptor kinases to nuclear transcription factors[J].Nature Cell Biology,2009,11(10):1 254-1 260.
[18] TANG W Q,YUAN M,WANG R J,eta l.PP2Aactivates brassinosteroid-responsive gene expression and plant growth by dephospho-rylating BZR1[J].Nature Cell Biology,2011,13(2):124-131.
[19] HE J X,GENDRON J M,SUN Y,et al.BZR1is a t transcriptional repressor with dual roles in brassinosteroid homeostasis and growth responses[J].Science,2005,307(5 715):1 634-1 638.
[20] ZHANG X,YAO D,WANG Q,XU W,WEI Q,et al.mRNA-seq analysis of the Gossypium arboreumtranscriptome reveals tissue selective signaling in response to water stress during seedling stage[J].PLoS ONE,2013,8(1):e54762.
[21] MUHEREPIYA A(木合热皮亚.艾尔肯),ZHANG F CH(张富春).Physiological and biochemical analysis for the salt tolerance of transgenic cotton transformed by the vacuolar H+-Pyrophosphatase gene(VP1)from Halostachys caspicas[J].Xinjiang Agricultural Sciences(新疆农业科学),2013,50(6):1 016-1 023.
[22] MA Y B(马燕斌),WU X(吴 霞),WANG X(王 霞),et al.Specific expression of BnDGAT1gene in Brassica napus[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2013,33(10):1 958-1 963(in Chinese).
[23] CUI B(崔 波),JIANG S H(蒋素华),LIU J(刘 佳),et al.Cloning and expression analysis of AP1-like gene fromSedirea japonica[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2013,33(9):1 739-1 744(in Chinese).
[24] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[25] CHANG D(常 丹),ZHANG X(张 霞),ZHANG F CH(张富春)et al.Cloning and expression analysis of HcPEAMTgene from Halostachys caspica[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2014,34(8):1 522-1 528(in Chinese).
[26] KRISHNA P.Brassinosteroid-mediated stress responses[J].Journal of Plant Growth Regulation,2003,22(4):289-297.
[27] BAJGUZ A.Effect of brassinosteroids on nucleic acid and protein content in cultured cells of Chlorella vulgaris[J].Plant Physiology Biochemistry,2000,38(3):209-215.

