‘马哈利’樱桃雄性不育细胞学观察
李 彬,蔡宇良*,赵晓军,宛 甜,高天翔
(1 西北农林科技大学 园艺学院,陕西杨凌712100;2 铜川市园艺工作站,陕西铜川727031)
‘马哈利’樱桃(Prunusmahaleb‘Mahaleb’)属于蔷薇科(Rosaceae)李属(Prunus),是西北农林科技大学园艺学院从匈牙利引进的樱桃育种资源植物,由于其抗根癌病性强,又具有矮化、耐盐碱等许多优良的生物学特性[1],是世界性的甜樱桃砧木,现己成为西北地区甜樱桃的主要砧木之一。关于‘马哈利’生殖发育的研究较少,张雪等[2]对‘马哈利’樱桃的大孢子发生和雌配子体发育进行了研究,但并没有涉及到雄性不育的情况,‘马哈利’樱桃结实率低可能与雄性不育有关。果树雄性不育的现象非常普遍,前人在果树雄性不育的机理上也做了相关基础研究,刘玲等[3]在枣中发现了雄性不育的现象;沈元月等[4]在白桃的雄性不育研究中发现了小孢子消失的现象;杏的雄性不育品种‘Trevatt Blue’(P.armeniaca)中也观察到了小孢子的退化问题[5],樱桃的雄性不育研究未见报道,本试验就在‘马哈利’樱桃观察到了雄性不育现象。
有效利用‘马哈利’樱桃雄性不育株,能够大幅度提高杂交效率[6],而且在保持苗木一致性,保证栽培苗木整齐度方面也有很大的意义[7]。本研究在对‘马哈利’樱桃雄配子体发育过程进行解剖学研究的基础上,以期在试验站保存的‘马哈利’野生种质资源中寻找到雄性不育株系,通过对不育株和正常可育株花药发育过程的比较,阐明其雄性不育发生的时期、方式和特征,完善对‘马哈利’樱桃生殖生物学的研究,为进一步利用‘马哈利’樱桃雄性不育特性培育樱桃优质苗木提供理论依据。
1 材料和方法
1.1 材料获得与采集
试验材料采自西北农林科技大学眉县樱桃试验园。试验品种为正常开花结实的‘马哈利’实生种,共6株,经过花粉活力测定等试验,确定其中1株为雄性不育株,其余5株为正常发育株(对照)。取样时间为2013年8月到2014年5月,2014年3月1日花芽萌动开始至成熟花粉形成(4月1日)期,每天采集不同发育状态的花芽或花蕾20个,其余时间每2周取样1次,每次采集10个样。
‘马哈利’花芽取样时从整个树体的东西南北四个方向,上中下三层以及内外膛分别取样,以确保试验结果不会因为花芽受到环境因素与生长状态的影响而造成误差。
开花期取少量未经授粉‘马哈利’新鲜花芽,剥取其中花粉,常规石蜡切片方法(如下)和常规干燥处理,分别用作显微镜和电镜扫描材料。
1.2 方 法
1.2.1 石蜡切片 用于细胞学观察的花芽,采用FAA 固定液固定,4 ℃冰箱保存。按照常规石蜡切片法制片,分别经过脱水、透明、浸蜡、包埋步骤后切片,期间采取爱氏苏木精整体染色,对样品进行横切与纵切,切片厚度8μm,中性树胶封片[8],选取具有代表性并且清晰的样本,在Olympus BX-51型光学显微镜下进行观察并照相。
1.2.2 扫描电镜 用于电镜下扫描的材料,用戊二醛固定,经过脱水、临界点干燥、上铜台喷金等步骤,在JSM-6360LV 扫描电镜下对花药和花粉进行观察并照相。
2 结果与分析
2.1 ‘马哈利’樱桃雄性不育系花药的发育过程
‘马哈利’樱桃雄性不育系的花药发育在孢原细胞时期到四分体时期的表现与正常株系植株的表现基本一致,都是在3月初花芽分化结束,3月1日左右开始出现雄蕊原基(图版Ⅰ,1),孢原细胞随后分化形成,具有很明显的细胞核。花药壁由孢原细胞分裂产生的初生壁细胞分裂分化而成,由外向内共有表皮、药室内壁、中层(2层)和绒毡层5层细胞。
初生造孢细胞是由孢原细胞分裂而来,发育形成小孢子母细胞(图版Ⅰ,2)后进入减数分裂时期。小孢子母细胞经过第一次减数分裂形成2个子核,随后进入减数分裂Ⅱ期,再次分裂之后形成四面体形状的四分体,外面由胼胝质壁包围(图版Ⅰ,3)。花药壁细胞则伴随着小孢子发育过程也持续产生着变化,早期的绒毡层细胞呈长方形,细胞较大,细胞质浓厚,排列整齐。发育过程进行到单核小孢子形成时,绒毡层细胞明显退化(图版Ⅰ,4)直至完全消失,花药壁最终分化发育成4室蝶形腔状形。小孢子细胞从四分体中分离出后,细胞质浓,细胞核大且位于细胞中央,经过单核靠边期(图版Ⅰ,5)后,最终经过发育后形成成熟花粉粒(图版Ⅰ,6)。
与对照相比,雄性不育株系花药发育则从四分体时期开始出现异常,在形成正常的四分体之后,绒毡层细胞液泡增大且细胞形状不规则(图版Ⅰ,7),并没有正常退化而是向药室中央收缩,排列开始混乱(图版Ⅰ,8),在此过程当中,四分体形态变异,出现了退化的迹象。绒毡层细胞继续扩增,把败育的小孢子围在药室中央,形成整体团块状,最终,异常的绒毡层和败育的小孢子核、质开始互融,小孢子已经完全无法正常发育并逐渐解体(图版Ⅰ,9),最后全部消失,不育株的花药内花粉囊成为了同为蝶形腔状形的空腔(图版Ⅰ,10)。观察还发现少部分不育株可以形成少量的成熟花粉,着色较深,但是大部分花粉粒在药室破裂时着色浅呈现无活性状态(图版Ⅰ,11),出现败育现象。另外观察到可育的花粉粒总是贴近绒毡层和纤维层(图版Ⅰ,12),一方面可能是为药壁破裂散粉做准备,另一方面花粉为了吸收足够的营养。
本试验统计表明从雄性不育株上采集的样品当中,91.67%实验样中的小孢子在四分体时期之前正常发育,从四分体时期开始绒毡层细胞和小孢子发育出现异常并且最终出现败育的现象;其余8.33%的样品发育情况并没有出现异常,与花粉正常发育的对照组相比在发育过程并无区别,四分体时期之后小孢子发育成为花粉,绒毡层正常退化,但是在药壁开裂时期只有极小部分花粉粒具有活力,绝大部分呈现出无活力的状态,出现败育现象。
2.2 开花期花药和花粉的扫描电镜观察
雄性不育系的植株与正常植株相比,除了在花粉发育过程当中的区别之外,在开花期也有很显著的特征。在同一比例尺下,正常的花药不仅体积大,而且饱满,从外形上可以明显看出4室蝶形的形状(图版Ⅰ,13),而败育的花药外形干瘪,体积远小于正常花药(图版Ⅰ,14)。将花药剥开继续观察,可以观察到正常成熟花药出粉量大(图版Ⅰ,15),且花粉粒饱满呈扁三角形状,外具横纹,且有3 个萌发沟(图版Ⅰ,16)。相反可以看到,败育花药跟上述石蜡切片观察结果相同,绝大部分花药是空的(图版Ⅰ,17),极个别有出粉的花粉粒也呈败育状,干瘪并且看不出形状(图版Ⅰ,18)。
3 讨 论
3.1 ‘马哈利’雄性不育发生的形态与时期
‘马哈利’樱桃的小孢子形态在四分体时期前并没有发现异常,随后在四分体时期的绒毡层细胞排列混乱,部分细胞当中出现液泡,绒毡层膨大并与小孢子粘连在一起,阻碍了小孢子正常的减数分裂,最终一同降解消失,不能形成正常的花粉粒,最终出现败育现象,这与韩爱华等[9]对“新梨7号”花粉败育途径的研究、罗来水等[10]在桃树雄性不育的研究等关于雄性不育株系花粉发育观察的结果相一致。但关于其小孢子发育异常的生化及分子机制还有待进一步深入研究。
根据Laser针对CMS类型花粉败育时期的统计结果和Kaul针对NMS类型败育时期的统计结果来看[11],四分体时期以后败育比例达到70%,减数分裂前、减数分裂和减数分裂后各时期败育的比例大体相同,从孢原细胞分化开始,每个过程都可能出现导致雄性不育发生的异常现象,本试验结果中四分体时期以后出现败育现象,符合前人的研究结果。
3.2 ‘马哈利’雄性不育发生的原因
在本次观察过程中,还出现了一部分花粉未完全成熟时花药壁就提前破裂散粉的情况,这部分花粉着色浅且活力弱,可能是‘马哈利’雄性不育的另一种类型。结合绒毡层液泡化并且膨大的现象,以及对败育花粉粒形态学观察,可以确认‘马哈利’雄性不育跟小孢子发育时期营养物质的供应有着比较密切的联系,而且发育不整齐,内含物不足,形态不饱满的花粉也会造成坐果率和结实率偏低。综合‘马哈利’败育的整个过程,绒毡层细胞的异常分化起到了很大作用。绒毡层细胞是包裹在花粉母细胞之外、药壁最内层的一层细胞[12]。在花粉形成和发育的过程当中,绒毡层一个很重要的作用就是在小孢子发育过程当中转运营养物质[13]。另外一方面,绒毡层在发育过程中也会分泌和提供胼胝质酶、孢粉素和花粉囊液等对发育有重要影响的物质[14]。参考前人研究和本试验结果,‘马哈利’在四分体时期绒毡层液泡化并且异常膨大,一方面,其细胞膨大的过程当中本身消耗了大量的物质,造成了发育物质对外运输的不足,同时挤压了小孢子的发育空间;另一方面,绒毡层细胞异常发育导致分泌物不足或者没有分泌物也严重影响了诸如四分体正常释放小孢子或者小孢子正常减数分裂等发育过程。
另外,耿三省[15]、叶要妹[16]等在对辣椒、百日草等雄性不育系材料进行研究的过程当中,都对花器做了形态学观察,部分植物的不育系会出现花朵张开度、花瓣或者花丝等数据有别于正常发育植株的情况,但是在本试验观察过程中发现,‘马哈利’雄性不育系的花器与正常可育植株的花器是没有区别的,维管束和花丝等组织均正常发育,这为田间寻找雄性不育株系带来了困难,但是从侧面证明其他的药壁组织的发育和‘马哈利’雄性不育并没有很明确的关系。
本试验表明,药壁组织及其他组织均没有直接出现败育或者营养供给异常的现象,表明‘马哈利’雄性不育株系的花粉在发育过程当中破坏了绒毡层的正常发育,致使绒毡层细胞异常膨大和提前的程序性死亡,进而造成了小孢子的异常发育。一般认为绒毡层发育和行为的异常是雄性不育的基因调控所导致的,它们的表达与否涉及到了败育现象是否出现[17],目前关于‘马哈利’雄性不育决定基因的研究还处于空白阶段,雄性不育性状的显隐性、控制基因的作用时期以及发生败育的过程当中水分营养运输、内源激素分泌等问题还需要通过分子标记和生理生化实验来解决[18],但关于其小孢子发育异常的生化及分子机制还有待进一步深入研究,这样才能明确‘马哈利’雄性不育的机理和原因,为进一步利用提供理论基础和技术保障。
在果树的发育过程中,其雄性育性是环境调控一定基因型表达出的结果,在考虑到雄性不育基因等遗传因素带来影响的同时,还发现‘马哈利’的可育花粉总是靠近绒毡层,距离药壁比较近,跟生境敏感型雄性不育的部分特征相似[19],这表明‘马哈利’雄性不育可能在一定程度上也会受到环境的影响,结合败育过程跟营养物质缺失有关,建议在‘马哈利’小孢子分化发育的敏感时期,加强果园的水肥管理,尽量创造好的发育条件,提高受精成活率,达到育种和高产的目的。
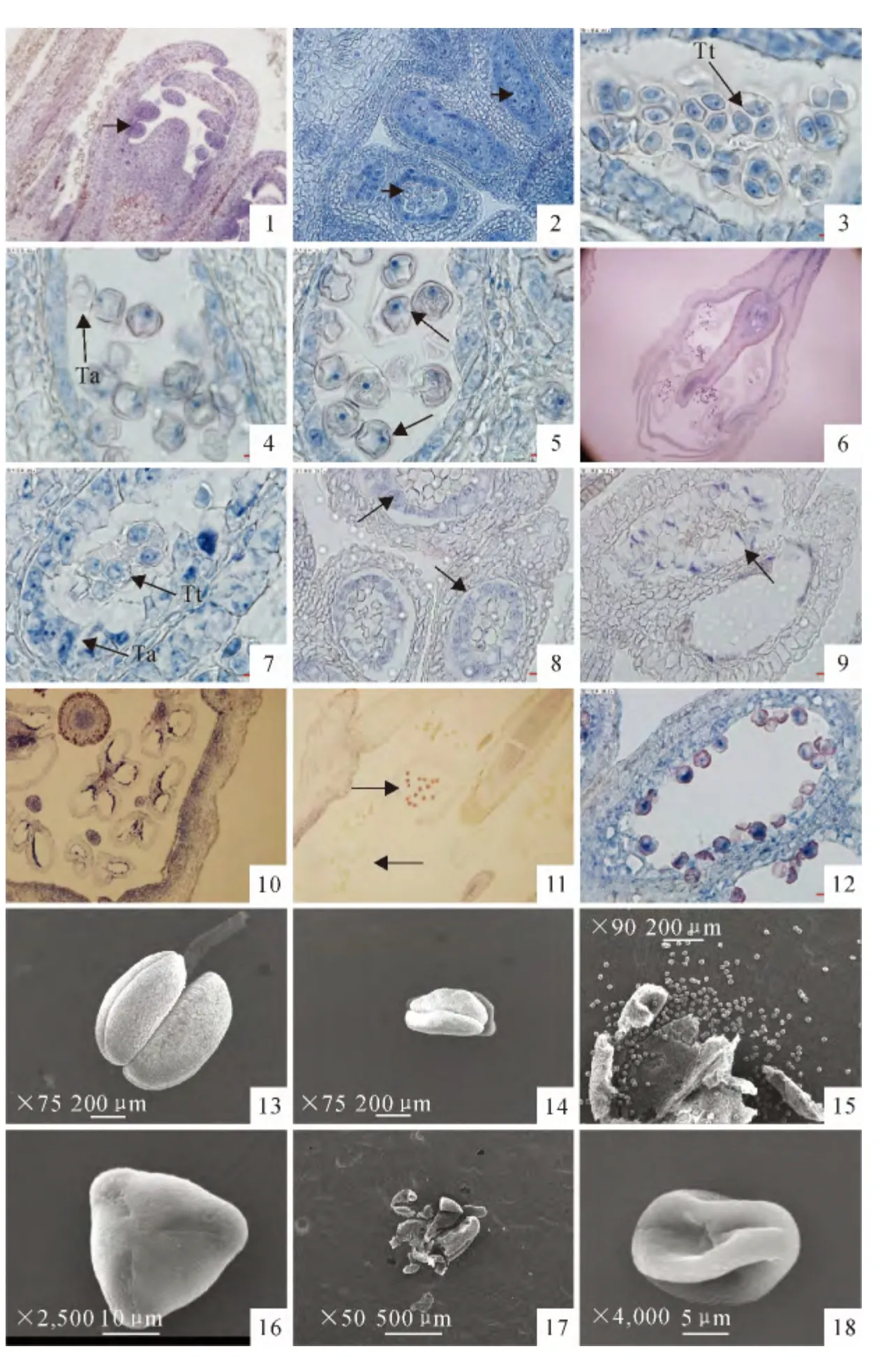
图版Ⅰ Ta.绒毡层;Tt.四面体型四分体PlateⅠ Ta.Tapetum;Tt.Tetrahedral tetrads
[1] 蔡宇良,付润民.樱桃[M].陕西:陕西科学技术出版社,2008:38-39.
[2] ZHANG X(张 雪),CAI Y L(蔡宇良),MU X Q(慕小倩),etal.Macrosporogenesis and female gametophyte development of Prunus mahaleb[J].ActaBotanicaBoreali-OccidentaliaSinica(西北植物学报),2013,33(7):1 348-1 352(in Chinese).
[3] 刘 玲.枣雄性不育种质筛选及其不育机理研究[D].河北保定:河北农业大学,2006.
[4] SHEN Y Y(沈元月),WANG D C(王东昌).Cytomorphology of microsporogenesis in male sterile of“CHUANZHONGDAO”white peach[J].ChineseJournalofAppliedandEnvironmentalBiology(应用与环境生物学报),2002,8(4):435-437(in Chinese).
[5] LILLECRAPP AM,WALLWORK MA,SEDGLEY M.Female and male sterility cause low fruit set in a clone of the‘Trevatt’variety of pricot(Prunusaremeniaca)[J].Sci.Hort,1999,82(3-4):255-263
[6] CAO Q Q(曹庆芹),YI H L(伊华林),DENG X X(邓秀新).Advances in research on male sterility in fruit crops[J].JournalofFruitScience(果树学报),2005,22(6):678-681(in Chinese).
[7] SUN Y G(孙玉刚),QIN ZH H(秦志华),AN M(安 淼).Production status and development countermeasures of sweet cherry[J].ShandongAgriculturalSciences(山东农业科学),2009,7:118-121(in Chinese).
[8] 李和平.植物显微技术[M].北京:科学出版社,1999:33-46.
[9] HAN A H(韩爱华),YIN K L(尹克林),SONG L Q(宋来庆),etal.Cytological study of male sterility and pollen abortion in pear(Pyrusspp.)variety“XINLI 7”[J].JournalofSouthwestAgriculturalUniversity(Nat.Sci.Edi.)(西南农业大学学报·自然科学版),2004,26(1):64-67(in Chinese).
[10] LUO L SH(罗来水),XIAO D X(肖德兴),HUO G H(霍光华),etal.A primary study on male sterility in peach[J].ActaAgriculturae UniversitatisJiangxiensis(江西农业大学学报),1999,21(4):463-468(in Chinese).
[11] 刘忠松,官春云,陈社员.植物雄性不育机理的研究及应用[M].北京:中国农业出版社,2001:19-22.
[12] ZHANG X(张 雪),MU X Q(慕小倩),CAI Y L(蔡宇良),etal.An anatomical study on pistils and stamens inPrunusmahale[J].JournalofFruitScience(Sweet Cherry Special Issue)(果树学报·樱桃专刊),2014,31(增刊):57-63(in Chinese).
[13] BI G S(毕高熵),XU M(许 明),ZHANG X(张 欣),etal.Cytological observation of nucleo-cytoplasmic interaction male sterile inRaphanussativusL.var.radculus pers[J].JiangsuAgriculturalSciences(江苏农业科学),2010,(3):177-179(in Chinese).
[14] LI Y Y(李莹莹),WEI Y Y(魏佑营),ZHANG R H(张瑞华),etal.Cytological investigation on microsporegenesis of male sterility of pepper[J].BulltinOfBotanicalResearch(植物研究),2006,26(4):411-415(in Chinese).
[15] GEN S SH(耿三省),WANG ZH Y(王志源),JIANG J ZH(蒋健箴),etal.Cytological studies on microsporogenesis of the male sterile lines of peppe[J].ActaHorticulturaeSinica(园艺学报),1994,21(2):165-169(in Chinese).
[16] YE Y M(叶要妹),CHEN T H(陈天花),HU Q SH(胡秋实),etal.Production and their cytological observations of the male sterile lines ofZinniaelegans[J].ScienticaAgriculturaSinica(中国农业科学),2008,41(5):1 436-1 443(in Chinese).
[17] Speciality in Plant Genetics and Breeding of Department of Biology,Peking University(北京大学生物系植物遗传育种专业).A cytological observations on anther and pollen developments of male sterile and male fertile lines of wheat[J].ActaBotanicaSinica(植物学报),1976,18(2):141-149(in Chinese).
[18] MIU Y(缪 颖),CHEN M CH(陈睦传).Studies on molecular mechanism of male sterility in plants[J].ChineseBulletinofBotany(植物学通报),2000,17(1):1-10(in Chinese).
[19] 刘忠松,官春云,陈社员.植物雄性不育机理的研究及应用[M].北京:中国农业出版社,2001:29-30.

