非水解溶胶-凝胶过程制备锡硅复合氧化物
程 玉,赵永祥,高春光
(山西大学化学化工学院精细化学品教育部工程研究中心,山西太原 030006)
非水解溶胶-凝胶过程制备锡硅复合氧化物
程 玉,赵永祥,高春光
(山西大学化学化工学院精细化学品教育部工程研究中心,山西太原 030006)
以无水四氯化锡为锡源、正硅酸乙酯(TEOS)为硅源和氧供体、二氯甲烷为溶剂、无水三氯化铁为催化剂,通过非水解溶胶-凝胶过程制备锡硅复合氧化物材料;采用N2物理吸附、X-射线粉末衍射、傅立叶变换红外光谱等手段对锡硅复合氧化物材料进行表征。结果表明:与以环己烷为溶剂制备的锡硅复合氧化物材料相比,以二氯甲烷为溶剂制备的锡硅复合氧化物材料的比表面积和孔容明显增大,平均孔径明显减小,产率从31%提高到60%左右;催化剂无水三氯化铁的引入促进了Sn-O-Si键的形成,有利于产物的过饱和析出,制备的材料具有较大的比表面积(305.7m2·g-1),氧化锡以四方金红石结构分散在无定型态的氧化硅中。
锡硅复合氧化物;非水解;FeCl3
纳米SnO2作为一种宽禁带n-型半导体[1],不仅具有较大的比表面积和优良的化学稳定性,而且具有较多的氧缺陷、高导电率等特性,广泛应用于催化[2]、气体传感[3]及电极材料[4]等领域。
SnO2作为催化剂时与SiO2复合可以增大比表面积、提高SnO2分散度,制备出性能优良的催化材料[5]。常见的SnO2复合氧化物的制备方法有:溶胶-凝胶法[6]、水热合成法[7]、浸渍法[8]、共沉淀法[9]等。与传统的制备方法相比,非水解溶胶-凝胶法工艺简单,合成条件温和,实现了低温合成复合纳米材料的可能。目前,已利用该法成功合成出多种单一氧化物(如二氧化硅、二氧化钛、氧化锆、氧化锌、氧化锡等)及复合氧化物(如钛酸铝、钛酸锆、硅酸锆以及二氧化硅/二氧化锡复合氧化物等)材料。
高春光等[10]以无水四氯化锡和正硅酸乙酯为前驱物、环己烷为溶剂,经非水解溶胶-凝胶过程制备了锡硅复合氧化物,500℃焙烧后目标物的产率为31%,比表面积22.58m2·g-1,表征结果表明,目标物基本为10nm左右的颗粒,孔主要为颗粒堆积孔。其中,正硅酸乙酯活性低是目标物产率低、比表面积偏小的主要原因[11]。
无水四氯化锡和正硅酸乙酯的非水解过程是卤代烷消除路线[式(1)]。在反应初期,最先进行的是底物之间的配体交换反应,生成氯代烷氧基化合物,这一反应将影响非水解反应进行完全[式(2)]。由于正硅酸乙酯活性低,兼作氧供体,影响目标物产率和形貌,因此,一般使用活性较高的叔丁基或苄基氧供体[12]或者加入Lewis酸催化剂(FeCl3、AlCl3等)[11]。
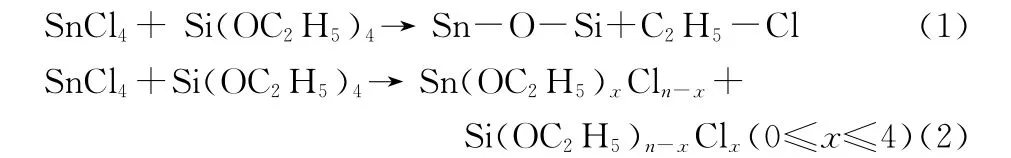
根据有机化学中碱取代反应的相关知识[13]可以推测,加入溶剂后,非水解缩合反应更倾向于按单分子亲核取代(SN1)进行。二氯甲烷的介电常数为9.1,极性强,能加速反应物的解离,生成更多的烷基碳正离子,促进反应进行;而环己烷的介电常数为2,相对较小,极性弱,对反应的促进作用不明显。鉴于此,作者采用极性较强的无水二氯甲烷为溶剂,以无水四氯化锡和正硅酸乙酯为前驱物、无水三氯化铁为催化剂制备锡硅复合氧化物,并采用N2物理吸附、X-射线粉末衍射、傅立叶变换红外光谱等手段对其结构进行表征。
1 实验
1.1 试剂与仪器
无水四氯化锡(分析纯)、无水三氯化铁(化学纯),国药集团化学试剂有限公司;正硅酸乙酯(分析纯)、二氯甲烷(分析纯),北京化工厂。
D8Advance型X-射线粉末衍射仪、Tensor 27型傅立叶变换红外光谱仪,德国Bruker公司;ASAP-2020型N2物理吸附分析仪,美国Micromeritics公司。
1.2 方法
所有操作均在N2氛围下进行,二氯甲烷和正硅酸乙酯(TEOS)需预处理。
室温下,向100mL三口圆底烧瓶中加入15mL无水二氯甲烷,然后搅拌下加入无水三氯化铁形成悬浮液,再加入一定量的无水四氯化锡,最后用恒压滴液漏斗将TEOS(Sn/Si=1)缓慢滴入,速率约为1滴· s-1。滴加完毕后升温至60℃回流24h,为促进反应进行完全,避免TEOS挥发,改为精馏装置去除60℃以下低沸点产物,促使反应向生成复合氧化物的方向进行。将产物于60℃干燥12h后置于马弗炉中500℃焙烧3h,升温速率为2℃·min-1,得到锡硅复合氧化物(SnSi-FeCl3-500)。
未使用催化剂无水三氯化铁的非水解溶胶-凝胶过程的步骤同上,得到锡硅复合氧化物(SnSi-500)。
2 结果与讨论
2.1 N2物理吸脱附等温线和BJH孔径分布
图1为SnSi-FeCl3-500和SnSi-500的N2物理吸脱附等温线。

图1 SnSi-FeCl3-500和SnSi-500的N2物理吸脱附等温线Fig.1 N2Adsorption-desorption isothermal curves of SnSi-FeCl3-500 and SnSi-500
由图1可知,两个样品在P/P0为0.4~0.9之间均出现滞后环,其中SnSi-FeCl3-500的滞后环为H1型,说明样品具有介孔结构;SnSi-500的滞后环为H4型,说明样品中可能存在狭缝孔。
SnSi-FeCl3-500和SnSi-500的BJH孔径分布见图2,织构参数见表1。
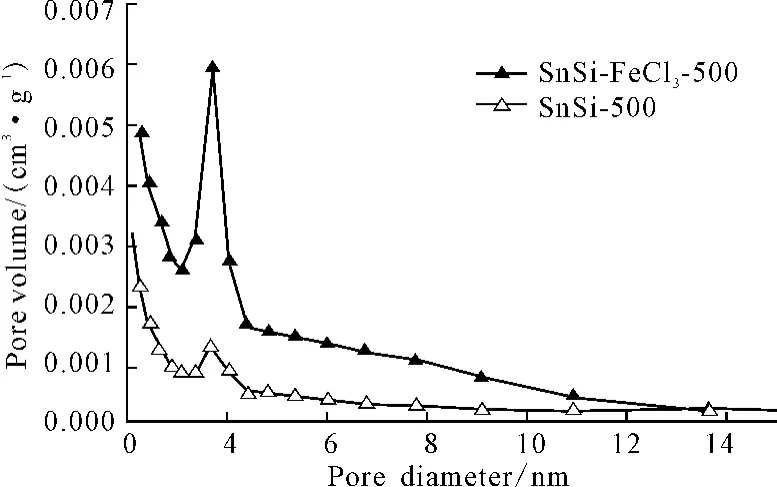
图2 SnSi-FeCl3-500和SnSi-500的BJH孔径分布Fig.2 BJH Pore size distribution of SnSi-FeCl3-500
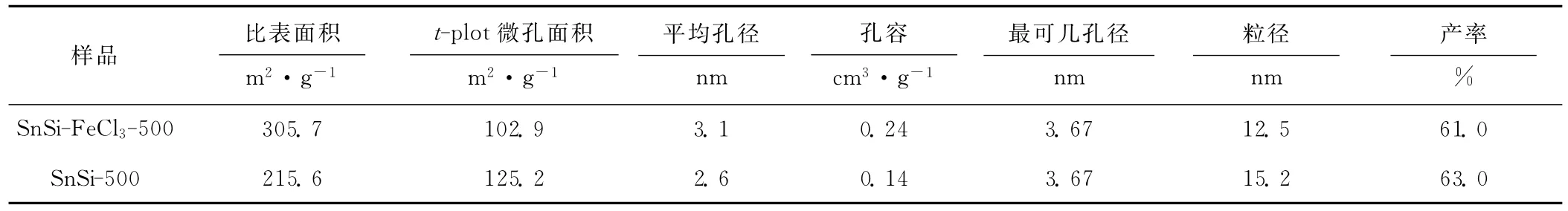
and SnSi-500表1 SnSi-FeCl3-500和SnSi-500的织构参数Tab.1 Texture parameters of SnSi-FeCl3-500 and SnSi-500
由图2和表1可看出:SnSi-FeCl3-500与SnSi-500相比,比表面积明显增大,平均孔径和孔容增大,孔径分布更集中。这可能是由于,催化剂无水三氯化铁的引入,Lewis酸含量增加,促进了反应物间异质缩合反应,生成的凝胶交叉耦合,因而可以抵抗干燥过程中产生的毛细管压。与实验室前期制备的堆积孔颗粒相比,本锡硅复合氧化物材料比表面积和孔容明显增大,平均孔径明显减小,说明以无水二氯甲烷为溶剂更适合非水解溶胶-凝胶过程制备锡硅复合氧化物。
2.2 傅立叶变换红外光谱(图3)
由图3可知:1 630cm-1附近的吸收峰为材料吸附水分子H-OH的振动吸收峰;1 083cm-1和806 cm-1附近的吸收峰分别归属于Si-O-Si的不对称收缩振动和对称收缩振动[14];两种材料在623cm-1处均有吸收峰,对应Sn-O-Si网络结构中Sn-O的伸缩振动,可以推测焙烧后所得纳米材料中SnO2与SiO2之间可能发生了键联作用,形成了相应的复合氧化物;与SnSi-500比较,SnSi-FeCl3-500的红外图谱623cm-1处Sn-O-Si网络结构中Sn-O的伸缩振动峰增强。说明催化剂的加入有利于Sn-O-Si键的过饱和析出,促进了非水解缩合反应的进行。

图3 SnSi-FeCl3-500(a)和SnSi-500(b)的FTIR图谱Fig.3 FTIR Spectra of SnSi-FeCl3-500(a)and SnSi-500(b)
2.3 X-射线粉末衍射图谱(图4)

图4 SnSi-FeCl3-500(a)和SnSi-500(b)的XRD图谱Fig.4 XRD Patterns of SnSi-FeCl3-500(a)and SnSi-500(b)
由图4可看出:(1)两种材料都能检测到金红石结构SnO2的特征衍射峰,在2θ为26.6°、33.9°、38.0°、51.9°、54.8°、66.2°和78.7°处出现的衍射峰分别对应于四方金红石结构SnO2标准衍射峰晶面;(2)图谱中未出现氧化硅的衍射峰,而在FTIR图谱中可以明显看到Si-O-Si的存在,说明氧化硅粒子为无定型态,而氧化锡纳米粒子则分散在无定型态的氧化硅中;(3)SnSi-FeCl3-500氧化锡衍射峰强度较强,晶化程度较好。通过(110)衍射峰的半峰宽计算得到SnSi-FeCl3-500和SnSi-500的平均粒径分别为12.5nm和15.3 nm。说明催化剂的引入使颗粒的平均粒径有所减小。
3 结论
以无水四氯化锡为锡源、正硅酸乙酯(TEOS)为硅源和氧供体、二氯甲烷为溶剂、无水三氯化铁为催化剂,采用非水解溶胶-凝胶过程制备锡硅复合氧化物材料。与以环己烷为溶剂制备的锡硅复合氧化物材料相比,所制备的锡硅复合氧化物材料比表面积和孔容明显增大,比表面积从22.58m2·g-1增大到305.7m2·g-1,孔容从0.047cm3·g-1增大到0.24cm3· g-1,平均孔径明显减小,产率从31%提高到60%左右。催化剂无水三氯化铁的引入促进了非水解反应过程中Sn-O-Si键的形成,有利于Sn-O-Si键的过饱和析出,氧化锡以四方金红石结构分散在无定型态的氧化硅中。
[1]KAMP B,MERKLER R,LAUCK R,et al.Chemical diffusion of oxygen in tin dioxide:Effects of dopants and oxygen partial pressure[J].Journal of Solid State Chemistry,2005,178(10):3027-3039.
[2]GAVAGNIN R,BIASETTO L,PINNA F,et al.Nitrate removal in drinking waters:The effect of tin oxides in the catalytic hydrogenation of nitrate by Pd/SnO2catalysts[J].Applied of Catalysis B:Environmental,2002,38(2):91-99.
[3]PINNA N,NERI G,ANTONIENTTI M,et al.Nonaqueous synthesis of nanocrystalline semiconducting metal oxides for gas sensing[J].Angewandte Chemie,2004,43(33):4345-4349.
[4]HARRELD J H,SAKAMOTO J,DUNN B.Non-hydrolytic solgel synthesis and electrochemical characterization of tin-based oxide aerogels[J].Journal of Power Sources,2003,115(1):19-26.
[5]STORCK S,MAIER W F,MIRANDA S I M,et al.Amorphous Sn/Si mixed oxides,mild solid Lewis acid catalysts for esterification and etherification reactions[J].Journal of Catalysis,1997,172(2):414-426.
[6]WEN J Y,WILIES G L.Organic/inorganic hybrid network materials by the sol-gel approach[J].Chemistry of Materials,1996,8(8):1667-1681.
[7]CORMA A,NEMETH L T,RENZ M,et al.Sn-zeolite beta as a heterogeneous chemoselective catalyst for Baeyer-Villiger oxidations[J].Nature,2001,412(6845):423-425.
[9]GUTIERREZ-BACZ R,TOLEDO-ANTONIO J A,CORTES-JACOME M A,et al.Effects of the SO4groups on the textural properties and local order deformation of SnO2rutile structure[J].Langmuir,2004,20(10):4265-4271.
[10]高春光,高晓星,赵永祥.非水解溶胶-凝胶过程制备锡/硅复合氧化物[J].化学与生物工程,2012,29(4):12-14.
[11]BOURGET L,CORRIU R J P,LECLERCQ D,et al.Non-hydrolytic sol-gel routes to silica[J].Journal of Non-Crystalline Soilds,1998,242(2-3):81-91.
[12]CORRIU R J P,LECLERCQ D,LEFEVRE P,et al.Preparation of monolithic gels from silicon halides by a non-hydrolytic sol-gel process[J].Journal of Non-Crystalline Soilds,1992,146(2-3):301-303.
[13]彭永烽.非水解溶胶-凝胶法合成莫来石粉体及晶须的工艺研究[D].景德镇:景德镇陶瓷学院,2009.
[14]ANDRIANAINARIVELO M,CORRIU R,LECLERCQ D,et al.Mixed oxides SiO2-ZrO2and SiO2-TiO2by a non-hydrolytic sol-gel route[J].Journal of Materials Chemistry,1996,6(10):1665-1671.
CHENG Yu,ZHAO Yong-xiang,GAO Chun-guang
(Engineering Research Center of Ministry of Education for Fine Chemicals,School of Chemistry and Chemical Engineering,Shanxi University,Taiyuan030006,China)
The Sn/Si mixed oxides were prepared by non-hydrolytic sol-gel process with stannic chloride as tin source,tetraethoxysilane as silicon source and oxygen donor,dichloromethane as solvent,ferric chloride as catalyst.The materials were characterized by nitrogen adsorption-desorption,XRD and FTIR.Compared with the material prepared with cyclohexane as solvent,the material prepared with dichloromethaneas solvent had higher surface area,larger pore volume and smaller pore size,and the yield was improved from 33%to about 60%.The introduction of ferric chloride catalyst promoted the formation of Sn-O-Si,which was conducive to the product of over saturated precipitation.The surface area of the materials was about 305.7m2·g-1,and SnO2was dispersed in amorphous silicon oxide in the form of tetrahedral rutile structure.
Sn/Si mixed oxides;non-hydrolysis;FeCl3
O 643.36
A
1672-5425(2015)03-0030-03
10.3969/j.issn.1672-5425.2015.03.007
国家国际科技合作项目(2013DFA40460),煤化工下游C4工业链关键技术山西省科技创新重点团队项目(2012021007)
2014-11-28
程玉(1987-),女,山西左权人,硕士研究生,研究方向:催化新材料,E-mail:chengxiaoyu89757@126.com;通讯作者:高春光,副教授,E-mail:cgao@sxu.edu.cn。

