145份小麦品种(系)的赤霉病抗性评价
苏双飞,许 峰,张从宇,时侠清,张子学
(安徽科技学院 农学院,安徽 凤阳 233100)
145份小麦品种(系)的赤霉病抗性评价
苏双飞,许 峰*,张从宇,时侠清,张子学
(安徽科技学院 农学院,安徽 凤阳 233100)
采用土表接种的方法,对145份适合于淮河流域种植的小麦品种(系)进行了赤霉病的抗性鉴定和评价。以病小穗率为指标,与株高、穗长、旗叶长和旗叶宽等农艺性状做了相关性分析。结果表明,能够直接应用于大田生产的赤霉病抗性品种比较匮乏,145份材料中没有发现达到免疫和抗病水平的品系,2份达到中抗水平,46份材料表现为中感,10份材料介于中感至感病之间,87份材料表现为感病。从材料地理来源上看,仅有来自江苏的种质存在较好的抗病基因资源,而山东、安徽和河南地区的小麦品系普遍缺乏抗病性。相关性分析显示,病小穗率与株高极显著负相关,与旗叶长和旗叶宽极显著正相关,感病性的降低和丰产性的提高存在矛盾。
小麦;赤霉病;抗病性;病小穗率;农艺性状
小麦赤霉病(Fusariumhead blight,FHB)是由禾谷镰刀菌(Fusariumgraminearium)引起的一种毁灭性病害,常发生于长江中下游、淮河流域冬麦区和东北春麦区,对小麦生产威胁极大[1]。近些年随着全球气候变暖加剧,厄尔尼诺和拉尼娜事件交替出现,极端天气频发,淮河流域麦区已经成为受赤霉病为害最严重的地区之一,其中2000~2014年以来,有9个年份赤霉病的发生面积超过3.3×106hm2,给小麦的安全生产带来严峻的挑战[2]。
小麦从苗期至成熟期都能感染赤霉病,以花期最为显著[3]。当病原菌接触到寄主组织后,孢子萌发产生的菌丝体布满于小麦穗的不同部位,尤其当花药残留较多时,菌丝分布更加密集,导致小穗出现明显的侵染症状[4]。随后侵入穗部的菌丝体会沿着维管束蔓延,继续侵染未感病的小穗,引起病害扩展,进而出现枯穗等症状[5-6]。小麦对赤霉病的抗性表现为多基因控制的数量性状,抗性类型可以分为五种:抗侵入性(Type I)、抗扩展性(Type II)、抗毒素积累能力(Type III)、降低籽粒病粒率(Type IV)和耐病性(Type V),其中以抗侵入性和抗扩展性最为重要[7]。应用QTL定位技术在赤霉病抗病遗传定位研究中取得了显著进展。迄今为止,在小麦所有染色体上(1A-7D)都鉴定到了抗赤霉病QTL,其中分布在B基因组中的QTL有100个,而分布于A和D基因组的有64和45个;超过48%的QTL来源于亚洲抗性材料,来自美洲的抗性位点只占到14%;在欧洲抗性材料中的QTL位点在基因组间的分布比较均匀[8-10]。目前,仅有3BS(Fhb1)、6BS(Fhb2)、4BL(Fhb4)和5AS(Fhb5)这四个主效QTL获得了精确定位[11-14],但迄今为止未有这些主效QTL育成生产品种的报道。
淮河流域地处亚热带和温带的过渡区域,气候多变,对小麦品种的抗性条件要求较高,本研究以适合种植于该地区的145份丰产性较好的品种(系)为研究对象,通过人工接种的方法鉴定它们抗赤性,评价并分析不同材料抗病性以及与主要农艺性状之间的相关性,为筛选适宜在皖北地区种植的抗病丰产小麦品种提供参考,同也时为开展小麦抗赤霉病育种、抗性基因定位与克隆研究提供可利用的抗病种质资源。
1 材料与方法
1.1 供试材料
供试材料由安徽科技学院小麦育种室提供的145份品种或育种中间品系,以及轮选22、南大2419、望水白3个抗感对照品种,共148份材料。所用菌种是由南京农业大学应用基因组实验室提供F.graminearium强致病力菌株F4、F15、F17和F34。
1.2 田间实验设计
于2013和2014年在安徽凤阳的安徽科技学院种植场内进行田间抗性鉴定(N32°52′40″,E117°33′05″)。试验设置两个重复,每个重复内小区排列完全随机,每份材料种植一行,行宽1.5 m,行距25 cm,每行播种50粒。记录扬花期,在盛花期后第21d,调查病小穗率(Percentage of Diseased Spikelet,PDS)做为衡量田间抗病性的指标。田间管理高于大田生产。
1.3 病原菌培养和接种
选择颗粒饱满的玉米籽粒用蒸馏水洗净后浸泡过夜,然后放入灭菌锅内121℃ 60 min灭菌。将低温保存的4种菌株活化后,在马铃薯琼脂(PDA)培养基(马铃薯200 g,葡萄糖10~20 g,琼脂17~20 g,水1000 mL)上培养,菌落长出后将其等比例接种于灭菌后的玉米粒上,搅拌均匀,25~28℃下避光恒温培养7~10 d,待菌丝布满后,4℃保存供接种用。小麦扬花前两周,在田间均匀撒播染病玉米粒,一周后重复一次,并给予及时灌溉,保持田间有足够湿度。
1.4 赤霉病抗性评价
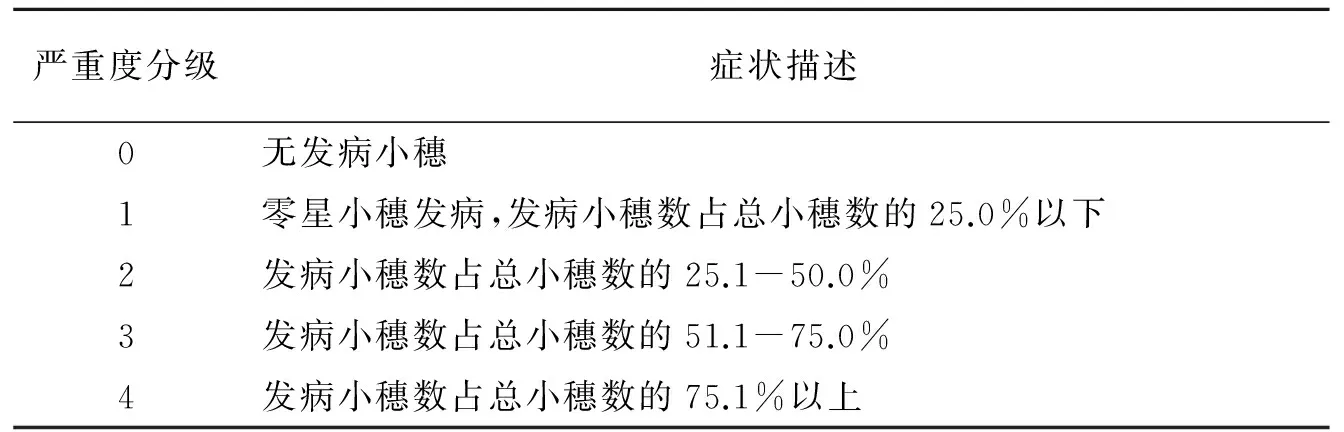
表1 小麦赤霉病严重度分级及其症状描述

表2 小麦对赤霉病抗性评价标准
病情分级标准按照《中华人民共和国农业行业标准NY/T 1443.4-2007-小麦抗赤霉病评价技术规范》的鉴定标准进行(表1,2)。根据发病小穗数占总小穗数的比例,即病小穗率(PDS)来衡量发病严重度。
1.5 性状调查和统计分析
盛花后第7d按单株调查旗叶长和旗叶宽、第18d调查株高和穗长、第21d调查病小穗率。在一个重复中,每份材料的农艺性状调查10片旗叶或10个单穗、病小穗率调查15个单穗。计算各性状指标,评价供试材料的抗性,分析病小穗率与主要农艺性状之间的相关性。以上统计数据由EXCEL2013和SPSS16.0完成。
2 结果与分析
2.1 不同小麦材料对赤霉病的抗性

表3 148份小麦材料的病小穗率、赤霉病严重度分级和病情指数
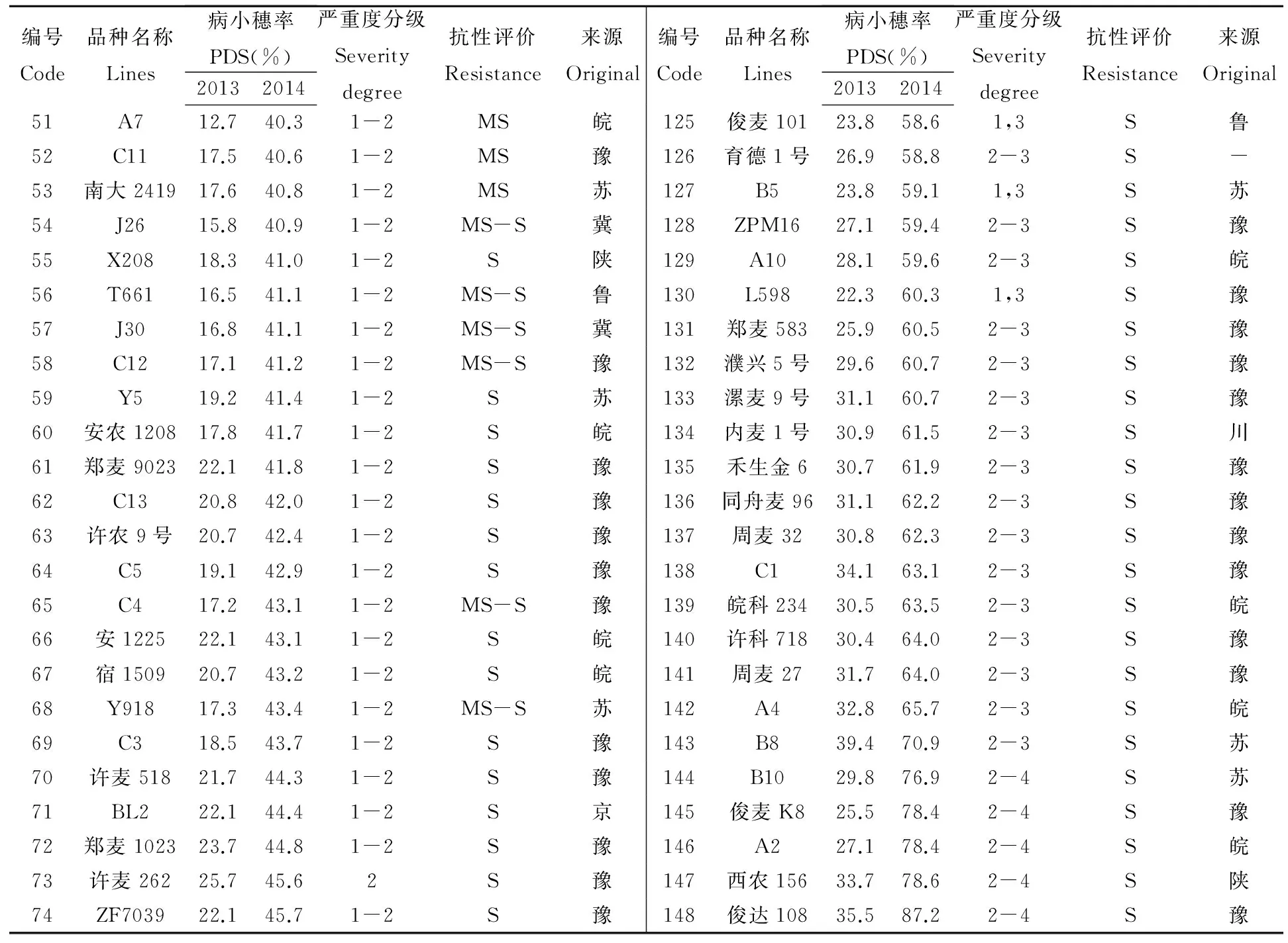
编号Code品种名称Lines病小穗率PDS(%)20132014严重度分级Severitydegree抗性评价Resistance来源Original编号Code品种名称Lines病小穗率PDS(%)20132014严重度分级Severitydegree抗性评价Resistance来源Original51A712.740.31-2MS皖125俊麦10123.858.61,3S鲁52C1117.540.61-2MS豫126育德1号26.958.82-3S-53南大241917.640.81-2MS苏127B523.859.11,3S苏54J2615.840.91-2MS-S冀128ZPM1627.159.42-3S豫55X20818.341.01-2S陕129A1028.159.62-3S皖56T66116.541.11-2MS-S鲁130L59822.360.31,3S豫57J3016.841.11-2MS-S冀131郑麦58325.960.52-3S豫58C1217.141.21-2MS-S豫132濮兴5号29.660.72-3S豫59Y519.241.41-2S苏133漯麦9号31.160.72-3S豫60安农120817.841.71-2S皖134内麦1号30.961.52-3S川61郑麦902322.141.81-2S豫135禾生金630.761.92-3S豫62C1320.842.01-2S豫136同舟麦9631.162.22-3S豫63许农9号20.742.41-2S豫137周麦3230.862.32-3S豫64C519.142.91-2S豫138C134.163.12-3S豫65C417.243.11-2MS-S豫139皖科23430.563.52-3S皖66安122522.143.11-2S皖140许科71830.464.02-3S豫67宿150920.743.21-2S皖141周麦2731.764.02-3S豫68Y91817.343.41-2MS-S苏142A432.865.72-3S皖69C318.543.71-2S豫143B839.470.92-3S苏70许麦51821.744.31-2S豫144B1029.876.92-4S苏71BL222.144.41-2S京145俊麦K825.578.42-4S豫72郑麦102323.744.81-2S豫146A227.178.42-4S皖73许麦26225.745.62S豫147西农15633.778.62-4S陕74ZF703922.145.71-2S豫148俊达10835.587.22-4S豫
2013年为赤霉病轻度发生年份,田间气候条件不适合该病的流行;2014年为赤霉病重度流行年份,扬花期遇到连阴雨,极利于病害发生,至盛花期后第21天,有近1/2的材料出现枯穗、粉色霉层等发病严重症状。对148份小麦材料的调查结果如表3所示,以高抗品种望水白为抗病对照(CK-R),轮选22为中抗对照(CK-MR),南大2419为感病对照(CK-S),以它们的病小穗率为指标进行抗性评价。结果表明,没有一个品种的病小穗率低于抗病对照望水白,因而供试材料中没有免疫(I)和抗病(R)品种;只有扬麦20和扬麦18的病小穗率低于轮选22,达到了中抗水平(MR);有46份材料表现为中感(MS);10份材料处于中感至中抗之间;剩下的87份材料感病较为严重(S)。在比较了这些小麦材料的来源后发现,仅有来自江苏地区的少量材料具较好的抗病性,其它省份如安徽、山东、河南和陕西等省份的品系普遍缺少抗性基因。这一结果表明能用于淮河流域大田生产的抗病材料比较匮乏。
2.2 病小穗率与主要农艺性状的相关性分析
对148份小麦材料的病小穗率、旗叶长、旗叶宽、株高和穗长这5个性状指标进行了相关性分析(表4)。结果表明,病小穗率与株高极显著负相关,即株高越高感病性越低;病小穗率与旗叶宽和旗叶长极显著正相关,即旗叶越长/宽,感病性越高。因此,植株株高偏高、旗叶窄而短有利于抗病性的提高。

表4 病小穗率与主要农艺性状的相关性分析
注:*,**表示在0.05和0.01水平上差异显著
Note:*,**indicate significant difference at 0.05 and 0.01probability levels
3 讨论
抗病种质资源筛选是抗病育种的基础。国内外的育种工作者曾经对来源各异的小麦材料进行了大规模的赤霉病抗性鉴定,至今未发现免疫材料,仅有少数几个高抗品种,如苏麦3号、望水白和Frontana等,抗性材料的缺乏直接导致抗赤霉病育种工作进展缓慢[15-17]。本试验使用的145份小麦材料中,仅有2份表现为中抗水平,没有超过抗病对照望水白的品种,而且表现为中抗的材料均为春性小麦,抗低温冻害能力不强,只适合种植于淮河以南地区,在淮北地区不具备大面积推广价值。
病小穗率是一个理想的抗病田间鉴定指标,在发病早期可以反映抗侵入性,病程后期则可以衡量供试材料对病原菌侵染和扩展的综合抗性,如果仅采用病穗率(土表或喷雾接种)、病小穗数以及病轴长度(单花滴注接种)往往只能反映单一抗性类型,不能全面评价品种的实际抗性[18]。小麦赤霉病的发生受天气条件影响极大,在抽穗扬花期遇到持续降雨且保持25℃左右的田间温度,将十分有利于病害的流行,如2014年表现为赤霉病的重度流行。而在2013年,虽然对这些供试材料采用相同的人工接种方法,但由于抽穗扬花期没有有效降雨,赤霉病轻度发生,超过3/4的供试材料的病小穗率不到30%,且在田间主要表现为侵染,扩展发生很少,与2014年的田间鉴定结果相差较大。因此,积极利用病害重度流行年份开展田间抗性鉴定或采用多年的重复鉴定,可以判断供试材料是否真正具备抗病性。
一些农艺性状,如株高、开花期、穗密度、颖壳张角、花药外露程度等,都可能是小麦赤霉病发病的影响因素。在本研究中,通过对病小穗率和主要农艺性状的相关性分析也说明抗病性与株高正相关,而与旗叶长和旗叶宽负相关。一般来说,高秆、小穗稀疏品种较矮秆、小穗紧实品种更抗赤霉病,可能原因之一是它们生长在不同的田间微环境中,受独特的田间小气候影响[8]。基于这一现象,一些QTL的定位分析进一步揭示了赤霉病抗性位点与穗密度、株高和开花期等QTL存在一定联系。Buerstmayr M等[19]和Chu C等[20]分别在来源不同的抗性种质中定位到一个位在5AL染色体、与Q基因紧密连锁的QTL,表现为小穗稀疏更抗病。另一份针对一些欧洲冬小麦组合研究结果表明,定位到的抗赤霉病QTL与开花期区间存在重叠的现象,抗赤性与开花期存在显著的相关性[21-24];而旗叶性状与抗病性之间可能没有必然联系[25]。因此,在品种选育过程中如果能降低小穗密度有利于抗性提高,培育早熟品种则可以使扬花期避开病菌侵染期,达到避病的效果。
小麦赤霉病的感病性与矮秆基因Rht-D1b(Rht2)存在相关性,研究结果表明Rht-D1b在抗侵入中可以增强感病性[25],而其等位基因Rht-B1b在抗侵入中也会削弱抗病性,但是在抗扩展中却可以增强抗病性[26-27]。另一项研究报道还发现携带Rht-B1c、Rht4、Rht8+9和Rht13的近等基因系均出现抗扩展能力削弱的现象,Rht8+9表现出抗侵入能力显著下降[28]。到目前为止,研究者还无法判断这种感病性的提高是由于Rht基因自身造成的,还是由于这些基因附近紧密连锁了感病基因,但由于目前推广的半矮秆小麦品种中大都含有Rht基因,因此在降低株高的同时往往不可避免的带来抗病性的下降。
目前,在淮河流域以北麦区,育种工作者为了提高单位面积产量,采用的育种策略是增加单位面积的有效穗数,培育株型紧凑、穗小、千粒重中等,同时降低株高等,而这些措施大多与赤霉病抗性提高相悖逆,因而在育种实践中很难育出丰产性好且抗赤性高的品种。综合以上特点,抗赤霉病育种中至少存在两大难题需要克服,一是抗性资源匮乏,需要进一步拓宽抗性资源谱,从更多的品种(系)中筛选有潜在抗性的材料;二是与丰产性之间有明显冲突,解决这一问题的关键还是在于克隆到苏麦3号和望水白等抗病品种中的主效QTL,如Fhb1- Fhb5等,明晰它们在抗病反应中的遗传规律和分子机制,应用到育种工程中,最终化解这一矛盾。
[1]陆维忠,程顺和,王裕中. 北京: 小麦赤霉病研究 [M].北京:科学出版社, 2002:58-59.
[2]程顺和,张勇,别同德,等. 中国小麦赤霉病的危害及抗性遗传改良 [J].江苏农业学报, 2012, 28(5): 938-942.
[3]马鸿翔,陆维忠. 中国小麦抗赤霉病育种研究进展[J]. 江苏农业学报, 2010, 26(1):197-203.
[4]Kang Z S,Buchenauer H. Immunocytochemical localization of Fusarium toxins in infected wheat [J]. Physol Mol Plant P, 1999,55:275-288.
[5]Kang Z S,Buchenauer H. Immunocytochemical localization of β-1,3-glucanase and chitinase in Fusarium culmorum-infected wheat spikes [J]. Physiol Mol Plant P, 2002,60: 141-153.
[6]Kang Z S,Buchenauer H. Studies on the infection process of Fusarium culmorum in wheat spikes: Degradation of host cell wall components and localization of trichothecene toxins in infected tissue [J]. Eur J Plant Pathol, 2002, 108(7): 653-660.
[7]程顺和,杨士敏,张伯桥,等.小麦对赤霉病的抗扩展性鉴定方法的研究[J].中国农业科学, 1994, 27 (2) : 45-49.
[8]Buerstmayr H, Ban T, Anderson J. QTL mapping and marker-assisted selection for Fusarium head blight resistance in wheat: a review [J]. Plant Breeding, 2009, 128(1): 1-26.
[9]Liu S, Hall M, Griffey C, et al. Meta-analysis of QTL associated with Fusarium head blight resistance in wheat [J]. Crop Sci, 2009, 49(2): 1955-1968.
[10]Li T, Bai G, Wu S, et al. Quantitative trait loci for resistance to Fusarium head blight in a Chinese wheat landrace Haiyanzhong [J]. Theor Appl Genet, 2011, 122(8): 1497-1502.
[11]Liu S, Pumphrey M, Gill B, et al Toward position cloning of Fhb1, a major QTL for Fusarium head blight resistance in wheat [J]. Cereal Res Commun, 2008,36: 195-201.
[12]Cuthbert P A, Somers D J, Brulé-Babel A. Mapping of Fhb2 on chromosome 6BS: a gene controlling Fusarium head blight field resistance in bread wheat (Triticum aestivum L.)[J]. Theor Appl Genet, 2007, 114(3): 429-437.
[13] Xue SL, Xu F, Tang MZ, et al. Precise mapping Fhb5, a major QTL conditioning resistance to Fusarium infection in bread wheat (Triticum aestivum L.)[J]. Theor Appl Genet, 2011, 123(6): 1055-1063.
[14] Xue S L, Li G Q, Jia H Y, et al. Fine mapping Fhb4, a major QTL conditioning resistance to Fusarium infection in bread wheat (Triticum aestivum L.)[J]. Theor Appl Genet, 2010, 121(1): 147-156.
[15]姚金保,陆维忠. 中国小麦抗赤霉病育种研究进展 [J]. 江苏农业学报, 2000, 16(4): 242-248.
[16]刘思衡,黄梅兰,杨伟健,等. 小麦抗赤霉病性与产量性状的相关分析 [J]. 福建农学院学报, 1988, 17(2): 127-132.
[17]Steiner B, Lemmens M, Griesser M, et al. Molecular mapping of resistance to Fusarium head blight in the spring wheat cultivar Frontana [J]. Theor Appl Genet, 2004, 109(1): 215-224.
[18]Xue SL, Li GQ, Jia HY, et al. Marker-assisted development and evaluation of near-isogenic lines for scab resistance QTLs of wheat [J]. Mol Breeding, 2010, 25(3):397-405.
[19]Buerstmayr M, Lemmens M, Steiner B, et al. Advanced backcross QTL mapping of resistance to Fusarium head blight and plant morphological traits in a Triticum macha × T. aestivum population [J]. Theor Appl Genet, 2011, 123(2): 293-306.
[20]Chu CG, Niu ZX, Zhong SB, et al. Identification and molecular mapping of two QTLs with major effects for resistance to Fusarium head blight in wheat [J]. Theor Appl Genet, 2011, 123(7):1107-1119.
[21]Gervais L, Dedryver F, Morlais JY, et al. Mapping of quantitative trait loci for field resistance to Fusarium head blight in an European winter wheat [J]. Theor Appl Genet, 2003, 106(6): 961-970.
[22]Draeger R, Gosman N, Steed A, et al. Identification of QTL for resistance to Fusarium head blight, DON accumulation and associated traits in the winter wheat variety Arina [J]. Theor Appl Genet, 2007(5), 115: 617-625.
[23] Klahr A, Zimmermann G, Wenzel G, et al. Effects of environment, disease progress, plant height and heading date on the detection of QTLs for resistance to Fusarium head blight in an European winter wheat cross [J]. Euphytica, 2007, 154(1-2): 17-28.
[24]Holzapfel J, Voss H H, Miedaner T, et al. Inheritance of resistance to Fusarium head blight in three European winter wheat populations [J]. Theor Appl Genet, 2008, 117(7): 1119-1128.
[25]Xue SL, Xu F, Li GQ, et al. Fine mapping TaFLW1, a major QTL controlling flag leaf width in bread wheat (Triticum aestivum L.) [J]. Theor Appl Genet, 2013, 126(8): 1941-1949.
[26]Srinivasachary, Gosman N, Steed A, et al. Susceptibility to Fusarium head blight is associated with the Rht-D1b semi-dwarfing allele in wheat [J]. Theor Appl Genet, 2008, 116(8): 1145-1153.
[27]Srinivasachary, Gosman N, Steed A, et al. Semi-dwarfing Rht-B1 and Rht-D1 loci of wheat differ significantly in their influence on resistance to Fusarium head blight [J]. Theor Appl Genet, 2009, 118(4): 695-702.
[28]Yan W, Li HB, Cai SB, et al. Effects of plant height on type I and type II resistance to Fusarium head blight in wheat [J]. Plant Pathol, 2011, 60(3): 506-512.
( 责任编辑:李孟良)
Identification and Evaluation of 145 Wheat Lines for Resistant toFusariumHead Blight
SU Shuang-fei, XU Feng*, ZHANG Cong-yu, SHI Xia-qing, ZHANG Zi-xue
(Agricultural college, Anhui Science and Technology University, Fengyang 233100)
One hundred and forty-five lines had been identified and evaluated for the resistance toFusariumhead blight (FHB) under the conditions of surface soil inoculation. Meanwhile, the correlation between the resistance to FHB and plant height, spike length, flag leaf width and flag leaf length had also been analyzed. The results showed that there were neither immune nor resistant lines, two lines with moderately resistant to FHB, and 143 lines were sensitive to wheat scab, among which 87 lines were highly sensitive to FHB. Furthermore, there were just a little of wheat lines which showed better resistance to wheat scab originated from Jiangsu province. However, no one resistant line could be identified in artificial inoculation derived from Shandong, Henan and Anhui Provinces. Additionally, the results of correlation analysis showed that two traits, namely flag leaf length and flag leaf width, were significantly positive correlaties with the percentage of diseased spikelet. However, there were significantly negative correlation between percentage of diseased spikelet and plant height. These results indicated that there was contradiction among disease resistance and fertility.
Wheat;Fusariumhead blight; Disease resistance; Percentage of diseased spikelet; Agronomical traits
2015-01-10
安徽科技学院预研项目(ZRC2014325);安徽省大学生创新创业计划项目(AH201310879059)。
苏双飞(1992-),男,安徽省无为县人,在读本科生,主要从事作物栽培技术研究。通讯作者:许峰,讲师,E-mail:xuf@ahstu.edu.cn。
S435.121
A
1673-8772(2015)02-0013-07

