eIF4E和Ki67在子宫内膜癌组织中的表达及意义
夏伟兰,沈丹婷,麦慧芬,孙静,张广亮
(1深圳市宝安妇幼保健院,广东深圳518100;2南方医科大学附属南方医院)
·基础研究·
eIF4E和Ki67在子宫内膜癌组织中的表达及意义
夏伟兰1,沈丹婷1,麦慧芬1,孙静1,张广亮2
(1深圳市宝安妇幼保健院,广东深圳518100;2南方医科大学附属南方医院)
目的 探讨eIF4E和Ki67在子宫内膜癌组织中的表达及意义。方法 采用免疫组化SP法检测eIF4E和Ki67在36例Ⅰ型子宫内膜癌、9例Ⅱ型子宫内膜癌及30例正常子宫内膜组织中表达情况,分析两者与子宫内膜癌临床病理特征的关系以及两者表达的相关性。结果 eIF4E、Ki67在Ⅰ型及Ⅱ型子宫内膜癌中的表达均高于正常子宫内膜(P均<0.01)。eIF4E和Ki67的表达均与子宫内膜癌组织病理分级、手术临床分期、肌层浸润程度及有无淋巴结转移相关(P均<0.05),二者在子宫内膜癌中的表达呈显著正相关(r=0.763,P<0.01)。结论 eIF4E和Ki67与子宫内膜癌的发生发展有关,联合检测eIF4E和Ki67可能有助于判断子宫内膜癌患者的预后。
子宫肿瘤;eIF4E;Ki67
子宫内膜癌(EC)的发生、发展是一个多因素、多步骤的复杂过程,大量原癌基因、抑癌基因、凋亡基因、转录调节因子等基因表达发生改变,对EC的发生发展具有重要作用[1]。本研究采用SP免疫组化法检测子宫内膜癌组织中eIF4E和Ki67的表达情况,探讨二者在子宫内膜癌的发生、发展、浸润和转移中的作用。
1 资料与方法
1.1 临床资料 45例子宫内膜癌石蜡包埋标本取自2009~2012年南方医院病理科手术切除标本,均经病理学检查确诊。患者年龄32~70岁、平均53岁。依照FIGO1988年标准,组织学病理分级G1级13例、G2级24例、G3级8例,手术分期Ⅰ期21例、Ⅱ期17例、Ⅲ期7例。无肌层浸润8例、浅肌层浸润27例、深肌层浸润10例;无淋巴结转移37例、有淋巴结转移8例。选择同期因子宫肌瘤行子宫全切患者的子宫内膜标本30例作为对照组。所有患者月经规律,无合并症及并发症,无妇科内分泌疾,术前半年未使用激素类药物治疗。两组临床资料具有可比性。
1.2 方法
1.2.1 检测方法 采用SP染色法,eIF4E一抗工作浓度按1∶300稀释,Ki67一抗工作浓度按1∶150稀释,DAB显色。以PBS代替一抗作为空白对照,以乳腺癌为阳性对照。采用OLYMPUS-BX51正置荧光显微镜观察染色结果,eIF4E阳性为腺上皮细胞胞质内出现棕黄色或棕褐色颗粒,Ki67阳性为细胞核内出现棕黄色或棕褐色颗粒。每张切片先在低倍镜(10×10)下筛选出阳性表达较强的区域,然后在高倍镜(10×40)下随机选择5个不连续视野进行拍照,经全自动图像分析系统进行彩色图像的采集与存储。用Imagepro-plus6.0专业图像分析软件对蛋白表达情况进行半定量分析,计算光密度值(MOD)。
1.2.2 统计学方法 采用SPSS13.0统计软件,数据分布的正态性检验采用Shapiro-wilk正态性分析;正态分布的数据,进一步检验样本总体方差是否齐性。方差齐者MOD值的比较采用t检验或One-way ANOVA方差分析;偏态分布及方差不齐数据,MOD值的比较采用样本的非参数检验。相关性分析采用Pearson相关分析法。P≤0.05为差异有统计学意义。
2 结果
2.1 eIF4E及Ki67在子宫内膜癌中的表达 eIF4E和Ki67阳性均呈棕黄色或棕褐色,eIF4E主要定位于细胞质中,少部分低分化的癌组织细胞核中亦可见棕黄色颗粒,间质未见表达;Ki67主要定位于细胞核。eIF4E及Ki67在Ⅰ和Ⅱ型子宫内膜癌中表达的MOD值均显著高于正常子宫内膜(P=0.000),eIF4E和Ki67表达与子宫内膜癌分型无明显相关(P1=0.244,P2=0.267)。见表1。
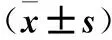
表1 eIF4E与Ki67在正常内膜及子宫内膜癌组织中 的表达比较
注:与正常子宫内膜比较,*P<0.01。
2.2 eIF4E及Ki67与子宫内膜癌临床病理特征的相关性 见表2。
2.3 eIF4E和Ki67在子宫内膜癌中表达的相关性 Pearson积差相关分析显示,eIF4E与Ki67在子宫内膜癌中的表达呈显著正相关(r=0.763,P<0.01)。
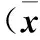
表2 eIF4E及Ki67表达与子宫内膜癌临床病理参数的关系±s)
3 讨论
eIF4E是一种新的原癌基因,是帽依赖性mRNA翻译过程中的限速因子,在蛋白质翻译合成过程中起重要调控作用[2],其过度表达选择性地增加一些基因产物的表达,如原癌蛋白、肿瘤浸润相关基因产物等[3]。已有研究表明,正常组织中eIF4E水平较低,而在多种肿瘤组织中过表达,其过表达促进细胞增殖和诱导细胞转化,而且这种过表达与肿瘤的形成、浸润、转移密切相关[4]。近年研究发现,在多种恶性肿瘤中发现eIF4E过度表达并与肿瘤的侵袭、转移能力呈正相关,抑制eIF4E的表达可以减少肿瘤相关基因的表达[5~8]。本研究显示,Ⅰ、Ⅱ型子宫内膜癌中eIF4E的表达均显著高于正常子宫内膜组,而Ⅰ型与Ⅱ型子宫内膜癌中eIF4E表达差异无统计学意义,提示eIF4E过度表达可能导致子宫内膜癌的改变,然而不能作为鉴别两型的标志物。进一步分析表明,eIF4E表达与子宫内膜腺癌FIGO分期、组织学分级、肌层浸润深度及淋巴转移显著相关,提示eIF4E表达上调可能与子宫内膜腺癌的发生、发展密切相关,并随着其恶化程度的增加而持续增加,其表达水平对判断子宫内膜癌的恶性程度有一定价值,且其可作为预后评估的指标。
Ki67是一种与细胞增殖有关在核抗原,它的合成、表达与增殖细胞的增殖周期有关,其在G0期和G1早期不表达,G1期中期后开始表达,在S期及G2期表达逐渐增加,至M期达高峰[9]。Ki67能客观反映细胞的增殖活性,是临床上应用比较广泛的增殖细胞标记物[10],并与多种肿瘤的发生发展、转移和预后有关。其表达与肿瘤的临床病理学分级呈正相关[11],因此可以用作判断肿瘤侵袭力和预后的标志。本研究显示, Ki67表达与组织学病理分级、手术临床分期、肌层浸润深度和有无淋巴结转移有关,并随组织学病理分级的增加、手术临床分期进展、肌层浸润越深及有淋巴结转移,其表达增强,说明Ki67在子宫内膜癌的发生、发展中起重要作用,提示Ki67过表达与子宫内膜癌的不良预后有关。
本研究对eIF4E和Ki67的表达进行相关性分析后发现,在子宫内膜癌组织中,二者表达呈显著正性相关,其具体机制可能与mTOR信号通路有关。mTOR信号通路为细胞启动翻译信号及细胞由G0/G1期进入S期所必需,并与蛋白合成、细胞周期的调控相关[12]。正常情况下,eIF4E和其抑制物4E-BPs的结合形成复合物,一般不能触发翻译,然而当外界刺激激活了mTOR信号通路,激活的mTOR使其下游引物4E-BP1磷酸化,导致eIF4E与其解离并活化,解离出来的eIF4E可以激活位于5′2UTR区的特殊的调控元件,促使翻译起始复合物形成,从而促使翻译的进行,引起肿瘤形成,然后肿瘤细胞由G1期进入S、G2、M期,Ki67的表达亦随之增强。
综上所述,eIF4E、Ki67表达与子宫内膜癌的发展、分化和侵袭有密切关系。联合检测两者的表达对评价子宫内膜癌生物学行为、指导选择治疗方案及肿瘤侵袭转移机制的研究具有重要意义,可作为子宫内膜癌早期诊断、判断预后及随访的生物学指标,也有可能成为子宫内膜癌患者基因治疗的选择。
[1] 王连邦,张丽英,单春华.子宫内膜癌发生分子机制研究进展[J].现代生物医学进展,2009,19(14):2791-2793.
[2] Joshi B, Cameron A, Jagus R. Characterization of mammalian eIF4E family members[J]. Eur J Biochem, 2004,271(11):2189-2203.
[3] Culjkovic B, Topisirovic I, Skrabanek L, et al. eIF4E is a central node of an RNA regulon that governs cellular proliferation[J]. J Cell Biol, 2006,175(3):415-426.
[4] Wendel HG, Silva RL, Malina A, et al. Dissecting eIF4E action in tumorigenesis[J]. Genes Dev, 2007,21(24):3232-3237.
[5] De Benedetti A, Graff JR. EIF4E expression and its role in malignancies and metastases[J]. Oncogene, 2004,23(18):3189-3199.
[6] Furic L, Rong L, Larsson O, et al. eIF4E phosphorylation promotes tumorigenesis and is associated with prostate cancer progression[J]. Proc Natl Acad Sci USA, 2010,107(32):14134-14139.
[7] Choi CH, Lee JS, Kim SR, et al. Direct inhibition of eIF4E reduced cell growth in endometrial adenocarcinoma[J]. J Cancer Res Clin Oncol, 2011,137(3):463-469.
[8] Kleiner HE, Krishnan P, Tubbs J, et al. Tissue microarray analysis of eIF4E and its downstream effector proteins in human breast cancer[J]. J Exp Clin Cancer Res, 2009,28(1):5.
[9] Shin SJ, Lesser M, Rosen PP, et al. Hemangiomas and an2 giosarcomas of the breast: diagnostic utility of cell cycle markerswith emphasis on Ki267[J]. Arch Pathol Lab Med, 2007,131(4):538.
[10] 史飞涛,秦守杰,孔武明.中期因子与Ki67在大肠癌中的表达及其临床意义[J].中国实用医刊,2012,39(15):12-14.
[11] Gurgel CA, Ramos EA, Azevedo RA, et al. Expression of Ki67, p53 and p63 proteins in keyatocyst odontogenic tumors:art immunohistochemical study[J]. J Mol Histol, 2008,39(3):311-316.
[12] Edinger AL, Thompson CB. Akt maintains cell size and survival by increasing mTOR-dependent nutrient uptake[J]. Mol Biol Cell, 2002,13(7):2276-2288.
10.3969/j.issn.1002-266X.2015.01.008
R737.33
A
1002-266X(2015)01-0023-03
2014-07-20)

