肝移植术后胆道非吻合口狭窄的再手术策略
汪邵平,郑于剑,陈建雄,蒲淼水,霍枫
肝移植术后胆道非吻合口狭窄的再手术策略
汪邵平,郑于剑,陈建雄,蒲淼水,霍枫
目的探讨肝移植术后胆道非吻合口狭窄(NABS)的再手术时机及术式选择。方法回顾性分析2003年8月-2014年4月10年间我中心14例NABS患者的临床资料。根据胆道造影结果,将NABS分为围肝门部狭窄(Ⅰ型)、肝门部+肝内胆管狭窄(Ⅱ型)和肝内胆管多发狭窄(Ⅲ型)3型,分别制定不同的再手术方案,随访了解再手术疗效。结果NABS总体发生率为3.3%(14/421),与非NABS患者比较,其胆红素和胆道酶谱明显升高(P<0.01)。14例NABS患者中Ⅰ型4例,Ⅱ型8例,Ⅲ型2例。NABS首选介入微创治疗,有效率为57.1%(8/14)。6例(1例Ⅰ型、4例Ⅱ型、1例Ⅲ型)无效者转再手术治疗。1例Ⅰ型患者行肝门部胆管整形-胆肠吻合术,余5例Ⅱ型及Ⅲ型患者接受再次移植。5例再移植患者术中出血2570±851ml,手术时间492±173min,与首次移植相比差异无统计学意义(P>0.05),术后真菌感染死亡1例。4例伴肝动脉狭窄闭塞的NABS患者中3例接受了再次移植,再移植率达75%(3/4)。5例患者术后随访胆管炎症状消失,总胆红素均值从123.4µmol/L降至31.6µmol/L,达临床治愈标准。结论对内镜介入治疗无效的NABS患者,尤其是合并肝动脉狭窄者,应及时转再手术治疗。术式的选择应参考胆道狭窄范围的分型,肝门部胆管整形-胆肠吻合术及再次移植均是疗效确切的术式。
肝移植;胆道非吻合口狭窄;消化系统外科手术
近年来肝脏移植技术在我国日益成熟,移植数量已位居世界前列,随之而来的移植术后并发症也逐渐增多[1-2]。胆道非吻合口狭窄(NABS)是一类肝移植特有的胆道并发症,病因不明,表现多样,处理棘手,预后不佳。广州军区广州总医院肝脏移植中心在随访的肝移植患者中发现14例NABS患者,其中手术处理6例,疗效满意,现结合文献报告如下。
1 资料与方法
1.1 一般资料 2003年8月-2014年4月,广州军区广州总医院肝脏移植中心共完成肝移植421例,包括二次移植8例,多器官移植5例,活体移植1例。肝移植患者发生NABS者14例,发生率3.3%(14/421),其中男12例,女2例,平均年龄46.7岁。本组NABS患者供体热缺血时间1~13min,平均5.6min,冷缺血时间3~18h,平均8.4h。供体获取采取原位腹主动脉及门静脉双插管,灌注肾保存液各2000ml后改UW液灌注和保存。在体剪开胆囊,用100ml冰盐水冲洗,胆总管插管至肝门部灌注200ml冰盐水充分冲洗肝内胆道。其中3例为无心跳器官捐献供肝(donation after cardiac death,DCD),判定脑死亡后,建立基于体外膜肺技术(ECMO)的灌注循环,撤除生命支持,过渡到无心跳死亡后开始获取器官。首次移植的手术方式包括经典肝移植12例,改良背驮式肝移植2例,胆道吻合方式均为胆管-胆管端端吻合,未放置T管。
1.2 NABS诊断及手术方案 根据NABS的临床特点和影像学表现可以明确诊断,值得注意的是NABS容易与慢性排斥反应混淆,我中心常规采用肝脏穿刺活检进行鉴别诊断。治疗以消炎利胆、活血化瘀等药物治疗为基础,以内镜下逆行胆管支架植入术(ERCP)或经皮肝穿刺胆道球囊扩张术(PTCD)等微创治疗为首选方案,以手术治疗为终极方案。术式包括肝门部狭窄整形及胆肠Roux-Y吻合术、半肝切除术、再次移植等。依据胆道造影显示的肝内外胆道狭窄范围,将NABS进行分型,并据此选择不同术式。以同期我中心肝移植术后无NABS患者20例作为对照,与NABS患者进行肝功能比较。其中NABS组肝功能以诊断明确后胆红素最高一次为取样点,对照组以出院记录中的肝功能为取样点。
1.3 手术疗效评价 手术疗效评价参照国外学者Verdonk等[3]提出的NABS治愈标准:①胆红素及丙氨酸转氨酶基本正常;②胆管炎症状及体征消失维持3个月以上。我中心以满足下列情况视为治疗好转/有效:①胆红素及丙氨酸转氨酶较治疗前降低,在正常和轻度升高之间(允许在正常值的2~3倍内波动);②胆管炎发作频率<3次/年,发作频率和严重程度较治疗前明显减轻,炎症易于控制,生活质量明显改善。
1.4 统计学处理 采用SPSS 13.0软件进行统计分析,计量资料以表示,两组间的比较采用配对t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 NABS的临床特点及影像学表现 本组14例患者均在术后1年内起病,平均发病时间为术后4.7个月,表现为反复畏寒、发热,黄疸、皮肤瘙痒等胆管炎症状;病理穿刺结果明确排除急慢性排斥反应。4例伴肝动脉狭窄,发生率28.6%。与无NABS的肝移植术后患者比较,发生NABS者主要表现为胆红素及胆道酶谱明显升高(P<0.01),转氨酶仅轻度升高(表1)。CT、MRI检查显示NABS患者肝门及肝内胆管多发僵硬、狭窄伴节段扩张,胆汁瘤、肝脓肿形成,合并胆管内胆泥、结石,胆总管及肝内胆管壁增厚等(图1)。胆道造影直观显示了肝内外胆道系统的狭窄梗阻部位、范围及程度,部分见胆管稀少、胆管毁损、胆管上皮坏死栓形成等现象(图2)。
表1 两组肝移植后肝功能比较(±s)Tab.1 Comparison of liver function after liver grafts with and without NABS (±s)

表1 两组肝移植后肝功能比较(±s)Tab.1 Comparison of liver function after liver grafts with and without NABS (±s)
(1)P<0.05, (2)P<0.01 compared with control group; TBIL. Total bilirubin; ALT. Alanine aminotransferase; ALP. Alkaline phosphatase; GGT. γ-glutamyltransferase
Group TBIL(µmol/L) ALT(U/L) ALP(U/L) GGT(U/L) Control (n=20) 32.3±13.6 41.9±28.8 74.2±31.6 64.7±19.2 NABS (n=14) 105.7±44.5(2) 81.3±45.9(1) 633.3±384.7(1) 571.8±371.4(2)

图1 NABS患者的MRI(A、B)及CT(C、D)表现Fig. 1 MRI(A, B) and CT (C, D) image of NABS patients Central bile duct stenosis with diffuse intrahepatic strictures and dilatations on both sides of the liver
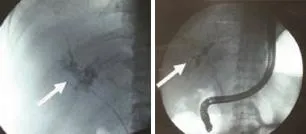
图2 NABS患者胆道造影(箭头示狭窄或毁损的肝门及肝内胆管)Fig.2 Cholangiogram of NABS patients (arrows point out the destructive hilar and diffuse intrahepatic biliary strictures)
2.2 手术效果 根据胆道造影显示的胆系狭窄部位不同,将14例NABS患者分为3种类型:围肝门部狭窄(Ⅰ型,4例);肝门部+肝内胆管狭窄(Ⅱ型,8例);肝内胆管节段狭窄(Ⅲ型,2例)。而根据胆道狭窄的范围则分为局限型和弥漫型2种类型。全部病例均接受了微创治疗,其中8例有效,总有效率57.1%(8/14)。Ⅰ型患者微创有效率最高,为75.0%(3/4)。6例(1例Ⅰ型、4例Ⅱ型、1例Ⅲ型)无效者转再手术治疗,对其中1例无效的Ⅰ型患者实施肝门部胆管切开整形,胆道结石、坏死物取出,胆肠Roux-Y吻合术,余5例患者则实施再次移植。有3例(均为Ⅱ型)合并肝动脉狭窄,此类患者再手术率达75%(3/4)。5例再移植患者术中出血2570±851ml,手术时间492±173min,与首次移植相比差异无统计学意义(P>0.05)。术后因真菌感染、脓毒血症死亡1例。本组患者未采用半肝切除术。5例存活患者随访发现术后胆管炎症状消失,肝功能明显好转,总胆红素均值从123.4µmol/L降至31.6µmol/L,手术死亡1例,占16.6%。
3 讨 论
3.1 NABS的临床特点 胆道非吻合口狭窄是肝移植术后的一种严重并发症,我中心数据显示其发生率为3.3%(14/421),其临床特点包括:①反复发作的胆管炎;②肝功能异常,以胆红素及胆道酶谱升高为主,转氨酶升高不明显;③多在肝移植术后1年内发生,本组平均发生在术后4.7个月;④与肝动脉狭窄或堵塞密切相关,本组即有4例合并肝动脉栓塞狭窄。关于NABS的原因及启动机制尚不明确,目前认为与缺血再灌注损伤、冷缺血时间过长、排斥反应、巨细胞病毒感染及跨血型移植等因素有关[4-5]。我中心在获取DCD供体时,通过ECMO技术来保障供肝质量,有研究数据显示这类供体不增加NABS的发生率[6]。胆道造影是NABS诊断的金标准,其他辅助检查手段包括B超、CT、MRI及肝穿刺活检。我中心把介入内镜治疗作为NABS的首选治疗方案,57.1%的患者症状得到控制,国外文献也有类似报道[7]。但这些微创方法也有很多不足之处,包括:①对近半数NABS患者无效;②在治疗有效的患者中,大部分需要多次反复的ERCP或PTCD操作,定期更换胆道支架加重了胆道感染风险和患者的医疗费用;③不能从病因上消除NABS,更多的只是延缓NABS的进展,部分患者最终面临再手术[8-9]。
3.2 NABS的再手术时机 对NABS患者过早实施再手术,因患者尚未从首次移植的手术创伤中完全恢复,会增加手术风险。同时部分患者还可以通过多次的微创治疗获得治愈或好转机会,过早手术得不偿失。相反,部分患者尽管微创治疗效果差,胆管炎反复发作,仍迟迟下不了再次手术的决心,导致全身情况衰竭,反复感染,导致再次手术风险极高甚至失去手术机会。因此,选择合适的手术时机十分重要[10]。我们认为一旦NABS诊断成立,首选ERCP、PTCD等微创方法,可以使半数以上的患者受益,但微创治疗2~3次后仍然无效的患者应该及时转再次手术。需要特别强调的是,由于NABS患者肝内外胆管病变复杂广泛,可能同时存在胆泥、结石、胆道黏膜坏死、广泛狭窄、感染、肝脓肿形成等各种病理现象,往往左右肝管需要同时置放多根胆道支架,介入、内镜医生必须有非常丰富的处理肝移植胆道并发症的经验,才能给出最恰当的微创治疗方案,达到治疗目的,让尽量多的患者避免再次手术。
3.3 NABS患者的手术指征 当NABS的诊断成立后,是否需要再次手术是摆在移植医师面前的一个棘手问题。Heidenhain等[11]认为:NABS患者胆道往往存在广泛的缺血性甚至坏死性改变,微创治疗不能改善胆道供血,一旦确诊,就需要及早再次肝移植。而本研究结果显示,大部分Ⅰ型患者能通过内镜治疗好转,需要再移植的5例患者均集中在Ⅱ型和Ⅲ型,尤其是合并肝动脉狭窄的患者大部分需再次移植(75.0%,3/4)。因此,原则上微创治疗无效的NABS患者都具备再手术指征,尤其对弥漫狭窄的Ⅱ型、Ⅲ型患者以及合并肝动脉狭窄的患者,应及早转再次手术。
3.4 NABS患者的手术方式选择 NABS患者主要有3种术式:①肝门部切开狭窄整形、胆肠Roux-Y吻合术;②半肝切除术;③再次移植。Ⅰ型患者由于不涉及肝内胆管狭窄,采用肝门部整形、胆道重建术就可能有效,而不必再次移植,本组1例患者即采用这种术式治愈。Khalaf等[12]报道10例因肝移植后胆道狭窄而再手术的患者,9例采用“肝门-空肠吻合术”治疗,有效率77.8%(7/9)。Ⅱ型、Ⅲ型患者由于涉及肝内胆管的狭窄,不宜使用上述术式,以免导致肝内胆管逆行性感染加重。
Ⅲ型患者中有一类少见的亚型,即局限型NABS,胆管狭窄仅局限于肝内的左叶或右叶,此时半肝切除就能达到根治效果。Honoré等[13]报道了4例此类患者,对其实施右半肝切除获得了良好疗效。应用该术式的前提是必须有精确可靠的胆道影像学资料,能明确判断出胆道的狭窄仅局限于半肝,否则无法达到治疗目的。目前国内未见有应用该术式处理NABS患者的案例报道。
事实上,在NABS的术式选择中,再次移植是一种稳妥的根治性方法,可以应对任何一种微创治疗失败的NABS。与国外再移植原因主要是慢性排斥反应、原发移植肝无功能等不同的是,国内多家移植中心报道均显示胆道并发症是当前我国再移植的主要原因[14-15]。本研究对NABS患者的主要再手术方式也是再次移植。5例再移植患者中,仅1例因术后脓毒血症死亡,手术时间和出血量与首次移植比较无明显差异,提示NABS患者在无严重感染、多器官衰竭发生的情况下,再移植仍然是相对安全可靠的术式。
总之,肝门部整形-胆肠吻合和半肝切除两种术式相对而言创伤小,费用低,但一定要谨慎使用,其适应证仅限于Ⅰ型狭窄和Ⅲ型中局限型狭窄的患者。若盲目应用于其他类型的NABS患者,可能不仅治疗无效,反而会加重病情。通过精准的影像学资料判断胆道狭窄类型显得尤为重要,否则宁可选择再次移植,以避免再次手术仍无法达到治疗目的的局面出现。
[1]Yang JH, Gao XG, Fu ZR. Role of autophagy in the mechanism of liver immune tolerance[J]. Med J Chin PLA, 2014, 39(6): 503-506. [杨璟辉, 高晓刚, 傅志仁. 自噬在肝脏免疫耐受中的作用机制研究进展[J]. 解放军医学杂志, 2014, 39(6): 503-506.]
[2]Yang CY, Sun YJ, Wang Y,et al. 1 case of liver transplantation postoperative nursing experience in children with bone marrow suppression caused by chemotherapy[J]. J Logist Univ PAPF (Med Sci), 2014, 23(11): 962-963. [杨春艳, 孙雅静, 王颖, 等.肝移植术后化疗引起骨髓抑制患儿1例护理体会[J]. 武警后勤学院学报(医学版), 2014, 23(11): 962-963.]
[3]Verdonk RC, Buis CI, Porte RJ,et al. Anastomotic biliary strictures after liver transplantation: causes and consequences[J]. Liver Transpl, 2006, 12(5): 726-735.
[4]Seehofer D, Eurich D, Veltzke-Schlieker W,et al. Biliary complications after liver transplantation: old problems and new challenges[J]. Am J Transplant, 2013,13(2): 253-265.
[5]Fusai G, Dhaliwal P, Rolando N,et al. Incidence and risk factors for the development of prolonged and severe intrahepatic cholestasis after liver transplantation[J]. Liver Transpl, 2006, 12(11): 1626-1633.
[6]Zheng YJ, Li P, Huo F,et al. The application of salvage liver transplantation with donation after citizens death: analysis of 12 cases[J]. Chin J Organ Transplant, 2014, 35(7): 401-404. [郑于剑, 李鹏, 霍枫, 等. 公民逝世后器官捐献供肝在肝癌患者抢救性肝移植中的应用12例[J]. 中华器官移植杂志, 2014, 35(7): 401-404.]
[7]Thuluvath PJ, Pfau PR, Kimmey MB. Biliary complications after liver transplantation: the role of endoscopy[J]. Endoscopy, 2005, 37(9): 857-863.
[8]Graziadei IW, Schwaighofer H, Koch R. Long-term outcome of endoscopic treatment of biliary strictures after liver transplantation[J]. Liver Transpl, 2006, 12(5): 718-725.
[9]Hintze RE, Adler A, Veltzke W,et al. Endoscopic management of biliary complications after orthotopic liver transplantation[J]. Hepatogastroenterology, 1997, 44(13): 258-262.
[10] Darius T, Jairo R, Fabio F,et al. Risk factors and surgical management of anastomotic biliary complications after pediatric liver transplantation[J]. Liver Transpl, 2014, 20(8): 893-903.
[11] Heidenhain C, Pratschke J, Publ C,et al. Incidence of and risk factors for ischemic-type biliary lesions following orthotopic liver transplantation[J]. Transpl Int, 2010, 23(1): 14-22.
[12] Khalaf H, Alawi K, Alsuhaibani H,et al. Surgical management of biliary complications following living donor liver transplantation[J]. Clin Transplant, 2011, 25(3): 504-510.
[13] Honoré P, Detry O, Hamoir E,et al. Right hepatic lobectomy as liver graft-saving procedure[J]. Liver Transpl, 2001, 7(3): 269-272.
[14] Fu BS, Zhang T, Li H,et al. Analysis of indications and causes of death in liver retransplantation[J]. Organ Transpl, 2011, 2(6): 320-323. [傅斌生, 张彤, 李华, 等. 再次肝移植的适应症与死亡原因分析[J]. 器官移植, 2011, 2(6): 320-323.]
[15] Song JY, Shi BY, Du GS,et al. The pathogenesid and prevention of postoperative nonanasmotic biliary stricture in liver transplatation[J]. Med J Chin PLA, 2003, 28(10): 861-863. [宋继勇, 石炳毅, 杜国盛, 等. 肝脏移植术后非吻合口胆管狭窄的病因与防治[J]. 解放军医学杂志, 2003, 28(10): 861-863.]
Surgical strategies of re-operation for non-anastomotic biliary duct stricture after liver transplantation
WANG Shao-ping, ZHENG Yu-jian, CHEN Jian-xiong, PU Miao-shui, HUO Feng
Liver Transplantation Center, Guangzhou General Hospital of Guangzhou Command, Guangzhou 510010, China
This work was supported by the Scientific and Technology Project of Guangdong Province (2012A030400023)
ObjectiveTo investigate the re-operation timing and surgical modality for non-anastomotic biliary stricture (NABS) after orthotopic liver transplantation (OLT).MethodsThe clinical data of 14 NABS patients hospitalized in our center from August 2003 to April 2014 were analyzed retrospectively. The patients were treated with different modalities of re-operation according to cholangiographic results, and the outcomes of re-operation were noted by postoperative follow-up.ResultsAmong 421 OLT patients, NABS was seen in 14 (3.3%, 14/421), and it was accompanied by stenosis of hepatic artery in 4. Their total bilirubin, ALP and r-GGT levels were significantly higher in NABS patients than in non-NABS patients (P<0.01). According to cholangiographic findings, NABS was divided into 3 types: hepatic bile duct strictures (4 patients, type Ⅰ), multiple extrahepatic and intrahepatic biliary strictures (8 patients, type Ⅱ), intrahepatic biliary stricture (2 patients, type Ⅲ). The cure rate of interventional treatment in this study was 57.1% (8/14), and 6 patients eventually required surgical treatment again. The type Ⅰpatient was treated with Roux-en-Y anastomosis, and re-transplantation for other 5 patients (type Ⅱ in 4 and type Ⅲ in 1). Among these 5 patients receiving liver re-transplantation, 1 patient died of perioperative fungal infection. The blood loss (2570±851ml) and operation time (492±173min) in those re-transplantation patients were almost the same as their previous-transplantation (P>0.05). More than half of type Ⅱ and Ⅲ patients needed re-transplantation, but the probability of re-transplantation was especially higher for those with hepatic artery stenosis (75%, 3/4). Cholangitis disappeared and the total bilirubin significantly reduced from 123.4µmol/L to 31.6µmol/L after resurgery.ConclusionsFor those NABS patients who may fail to be improved after a minimally invasive treatment, especially when it was combined with hepatic arterial stenosis, resurgical treatment should be carried out timely to avoid the loss of a chance for re-operation. Based on the different types of stricture as shown by cholangiographic images, different modalities for re-operation should be adapted, and both Roux-en-Y anastomosis and re-transplantation are optional for the treatment of NABS.
liver transplantation; non-anastomotic biliary structure; digestive system surgical procedures
R657.3
A
0577-7402(2015)08-0643-04
10.11855/j.issn.0577-7402.2015.08.08
2014-12-27;
2015-06-10)
(责任编辑:熊晓然)
广东省科技计划项目(2012A030400023)
汪邵平,医学硕士,副主任医师。主要从事肝脏移植的临床研究
510010 广州 广州军区广州总医院肝脏移植中心(汪邵平、郑于剑、陈建雄、蒲淼水、霍枫)

