体表电刺激对新西兰大白兔心电活动的影响
张望,张辉,吴莎,王小旭,张晓刚
体表电刺激对新西兰大白兔心电活动的影响
张望,张辉,吴莎,王小旭,张晓刚
目的研究体表电刺激对新西兰大白兔心电活动的影响,寻找临床电刺激疗法的安全阈值,为体外起搏器的设计提供理论依据。方法将新西兰大白兔随机分为17组,每组6只。设脉冲电刺激实验组16组,电刺激部位均在大白兔中上腹区,根据电压不同分为5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80V组。用BL-420F型生物机能实验系统提供刺激电源并采集心电图,系统输出脉冲电刺激频率均为270次/min,刺激波为方波。设一组部位对照组,刺激电压35V,刺激正极位于胸部心前区,刺激负极位于背部心脏对应部位皮肤表面,余同实验组。结果电压≤35V实验组大白兔未出现刺激心律,部位对照组为全刺激心律。电压≤30V实验组大白兔未出现心律失常。电压≥45V实验组大白兔刺激结束后心率减慢。电压≤35V实验组大白兔无行为异常或仅有轻度行为异常。电压≤40V实验组大白兔电刺激局部组织肉眼观察无损伤。结论电压≤35V脉冲电刺激中上腹区不影响大白兔心电活动。35V脉冲电刺激兔心脏前后极可导致心脏全起搏心律,但不会影响新西兰大白兔自身心电活动,且不会造成局部组织损伤。
经皮神经电刺激;心电描记术;心律失常,心性
目前,电刺激广泛应用于临床,改进了疾病原有的治疗方法,为患者和医生提供了更多的治疗选择,从而提高疾病的治疗效果[1-2]。Hofmann等[3]探索了将电刺激用于治疗临床较难切除的肿瘤。吴莎等[4]用电刺激黑色素瘤小鼠荷瘤局部,结果显示肿瘤体积减小,生存率较对照组明显延长,证实低频脉冲电刺激对小鼠的黑色素瘤具有抑制作用。但是脉冲电流刺激机体时的心肌电活动及病理变化目前鲜见报道。本实验利用BL-420F型生物机能实验系统提供脉冲电流刺激并记录心电图,以正常大白兔为研究对象,探讨在不同电压、不同频率及不同刺激时间作用下,电刺激引发的大白兔心电活动的变化。
1 材料与方法
1.1 实验动物及仪器 健康新西兰大白兔102只(重庆医科大学实验动物中心),4~8周龄,雌雄各半,体重2200~2800g。饲养环境:单笼喂养,室温25±2℃,湿度71%±8%,自由进食及饮水。实验器材:BL-420F生物机能实验系统(成都泰盟科技有限公司),自制大白兔固定台,钛金属夹。
1.2 方法
1.2.1 分组 新西兰大白兔随机分为17组,每组6只。首先将兔分为实验组和部位对照组。①实验组:电刺激部位均在大白兔中上腹区。按BL-420F生物机能实验系统输出的刺激电压不同再分为5、10、15、20、25、30V、35、40、45、50、55、60、65、70、75、80V组。②部位对照组:电刺激部位均在大白兔心前区,共6只,刺激电压35V,刺激正极位于胸部心前区,刺激负极位于背部心脏对应部位皮肤表面。
1.2.2 BL-420F生物机能实验系统参数选择 电压:系统输出电刺激信号电压因不同实验组选择有变化,其他参数各实验组均相同。电刺激时间:实验电刺激1h为1次实验,每天1次实验,连续5d整个实验结束。频率:系统输出脉冲电刺激频率为270 次/min。刺激波为方波。心电图检测:采用心电图持续观察,即从脉冲电刺激开始至刺激结束后1h。系统可自行保存心电图。心电图监护仪电极红线接在大白兔左上肢,黄线接在右上肢,黑线接右下肢(电极需避开肌肉组织)。
1.2.3 实验操作 大白兔俯卧于自制的大白兔固定台,用绷带束缚四肢及头部,使其处于舒服而固定的体位。电极附着处皮肤脱毛,清洁皮肤后将电极片与皮肤紧密接触。实验组大白兔中上腹区与系统输出电刺激的正极相连,对应的背部区皮肤与负极相连;部位对照组刺激正极位于胸部心前区,刺激负极位于背部心脏对应部位皮肤表面。BL-420F生物机能系统接计算机,同时连接心电图检测电极,心电图无干扰,开始电刺激,计算时间。电刺激1h,心电图继续监护1h。解除束缚,实验兔放入笼中,自由饮食,观察生活行为改变。实验每天重复1次,共5d。
1.3 观察内容
1.3.1 心电图 ①刺激心律:即脉冲电刺激诱发的qRs波。无刺激心律:刺激心律的次数/总心率×100%≤1%;有刺激心律:刺激心律的次数/总心率×100%为1%~90%;全刺激心律:刺激心律的次数/总心率×100%>90%。②轻度心律失常:包含室上性早搏、窦性心律不齐、室性早搏、窦性心动过速。③恶性心律失常:包含室性心动过速、室颤、室性逸搏、窦停。④心率。电刺激前心率:每5min取监护仪记录的心率1次,连续12次,每组共记录心率6×12次。电刺激时心率:每5min取监护仪记录的心率1次,连续12次,每组共记录心率6×12次。不取室速和室颤时监护仪记录的心率。
1.3.2 生活行为改变 ①无行为异常:与未刺激兔比较,电刺激时及刺激后兔行为无差异;②轻度行为异常:刺激时局部出现阵发性抽动,以及刺激后活动减少,或者烦躁易激惹;③重度行为异常:刺激时出现痉挛(例如牙口紧闭、全身持续肌肉紧张,弓背,全身毛发直立等),刺激时口唇及四肢末端明显发绀,刺激后活动较刺激前明显减少、进食量减少;④死亡。
1.3.3 组织学变化 观察电刺激后局部皮肤是否出现红肿或烧焦。
1.4 统计学处理 采用SPSS 17.0进行统计分析。计量资料以表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 刺激心律的发生情况 电压≤35V实验组大白兔未出现刺激心律(表1)。电刺激开始前,大白兔呈现正常的心电图(图1A)。电刺激部位在大白兔中上腹区时,5、10、15、20、25、30、35V组实验结束后为无刺激心律,40、45、50、55、60、65、70、75、80V组实验结束后为有刺激心律,但刺激心律产生的数量规律因每组样本量小难以说明。部位对照组为全刺激心律,即刺激电极置于胸部心前区电压为35V时,心电图全部是刺激心律(图1B)。
2.2 心律失常发生情况 电压≤30V实验组大白兔未出现心律失常。电刺激部位在大白兔中上腹区时,5、10、15、20、25、30V组均为窦性心律,未出现心律失常。35V组3只兔为窦性心律,3只兔出现轻度心律失常(图2)。40V组1只兔为窦性心律,5只兔出现轻度心律失常。45V组2只兔为窦性心律,4只兔出现轻度心律失常。50V组3只兔为窦性心律,3只兔出现轻度心律失常。55、60、65V组6只兔均出现轻度心律失常。70V组5只兔出现轻度心律失常,1只兔出现重度心律失常(室颤,图3),停止刺激后死亡。75V组1只兔为轻度心律失常,5只兔出现重度心律失常(1只兔出现频发室早,停止刺激后恢复窦性心律,2只兔出现室性早搏,停止刺激后出现窦性停搏死亡,3只兔出现室颤,停止刺激后死亡)。80V组6只兔均出现重度心律失常,其中2只兔出现全身抽搐未完成实验死亡,4只兔出现室颤停止刺激后死亡。部位对照组为全刺激心律,即刺激电极置于胸部心前区电压为35V时,心电图全部是刺激心律,至实验结束无死亡。
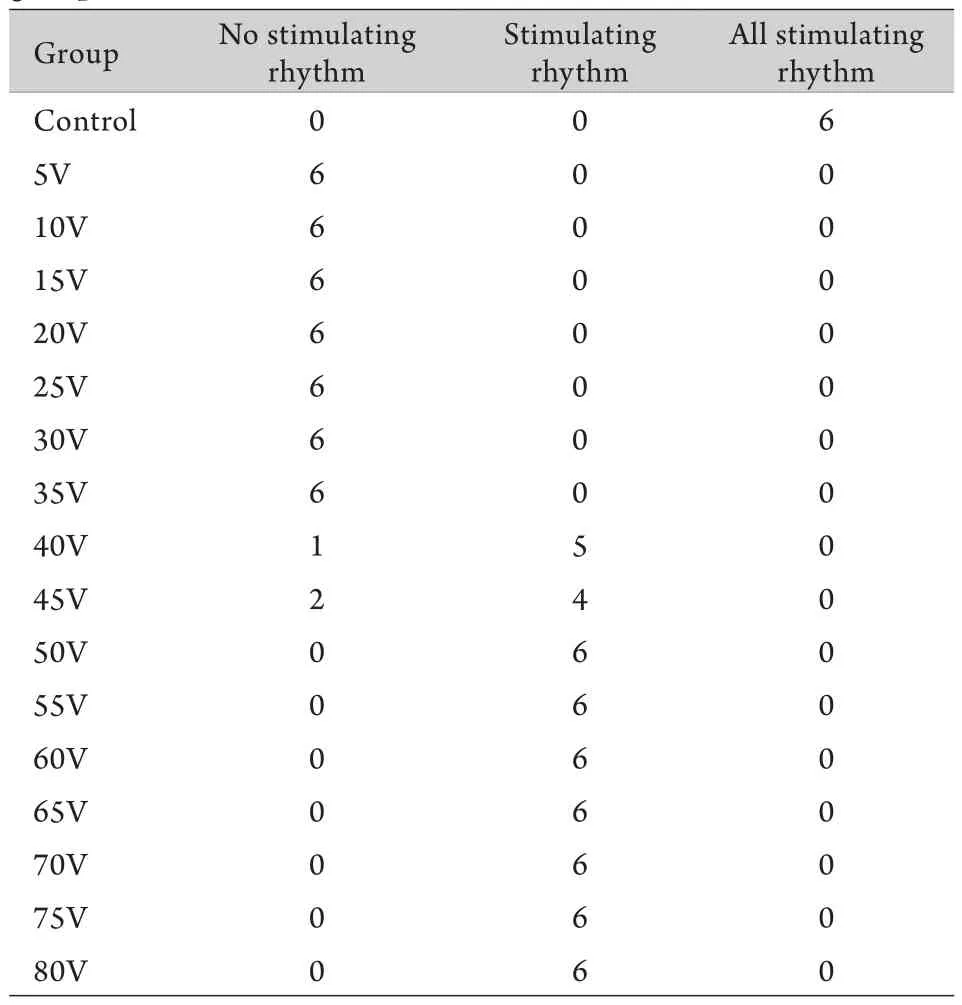
表1 实验大白兔各组刺激心律发生情况(只,n=6)Tab.1 Incidence of stimulation rhythm in the rabbits of each group (n=6)

图1 大白兔正常及刺激心律心电图Fig.1 Normal ECG (A) and ECG of stimulation rhythm (B) in rabbits
2.3 刺激时心率变化 电压≥45V实验组大白兔刺激结束后心率减慢(表2)。各电压组在实验前平均心率差异无统计学意义(P>0.05)。电刺激部位在大白兔中上腹区时,5、10、15、20、25、30、35、40V组电刺激时心率与电刺激前差异无统计学意义(P>0.05),45、50、55、60、65、70、75、80V组电刺激时心率明显低于电刺激前,差异有统计学意义(P<0.05)。部位对照组为全刺激心律,心率固定于270次/min。
图2 大白兔室性早搏心电图Fig.2 ECG of ventricular premature beat

图3 大白兔室颤心电图Fig.3 ECG of ventricular fibrillation
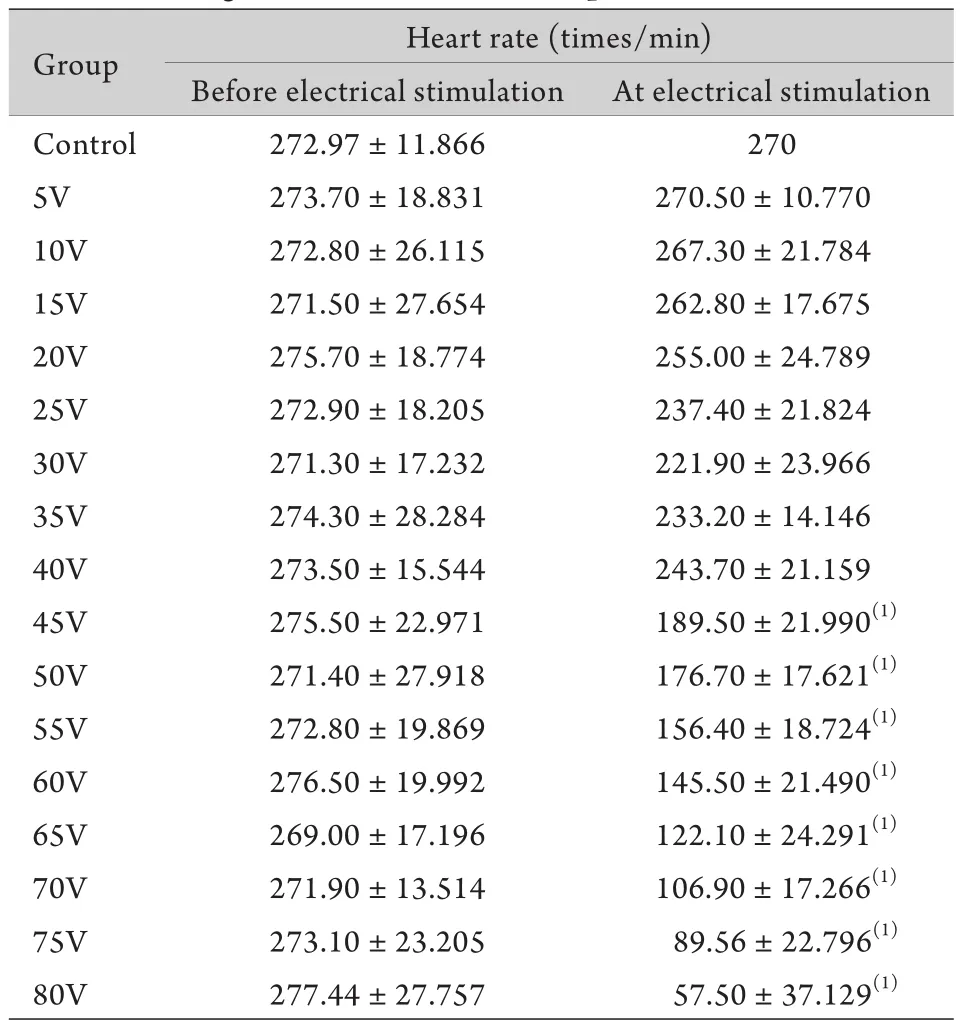
表2 实验大白兔各组心率的变化(n=6)Tab. 2 Changes in heart rate of the experimental rabbits (n=6)
2.4 行为异常发生情况 电压≤35V实验组大白兔有轻度行为异常或无行为异常。5、10、15、20V组电刺激时及电刺激结束后均无行为异常。25V组电刺激时4只兔出现轻度行为异常,电刺激结束后均无行为异常。30、35V组电刺激时各有5只兔出现轻度行为异常,电刺激结束后均无行为异常。40V组电刺激时2只兔出现轻度行为异常,4只兔出现重度行为异常,电刺激结束后均无行为异常。45V组电刺激时1只兔出现轻度行为异常,5只兔出现重度行为异常,电刺激结束后均无行为异常。50、55、60、65V组电刺激时均出现重度行为异常,电刺激结束后仍有轻度行为异常。70V组电刺激时5只兔出现重度行为异常,电刺激结束后仍有轻度行为异常,1只兔电刺激结束后死亡。75V组电刺激时6只兔出现重度行为异常,1只兔电刺激结束后仍有轻度行为异常;5只兔未到电刺激结束时间死亡。80V 组6只兔未到电刺激结束时间均死亡。部位对照组电刺激时6只兔均出现轻度行为异常,电刺激结束后均无行为异常。
2.5 局部组织损伤情况 电压≤40V实验组大白兔电刺激局部组织肉眼观察无损伤。5、10、15、20、25、30、35、40V组电刺激结束后,肉眼观察局部未见明显损伤。45、50、55V组电刺激结束后各组均为5只兔局部组织肉眼观察无明显损伤,1只兔局部皮肤发红。60V组电刺激结束后2只兔局部组织肉眼观察无明显损伤,4只兔局部皮肤发红。65V组电刺激结束后1只兔局部组织肉眼观察无损伤,5只兔局部皮肤发红。70V组电刺激结束后2只兔局部组织肉眼观察无损伤,4只兔局部皮肤发红。75V组电刺激实验结束后6只兔局部皮肤发红。80V组电刺激实验结束后5只兔局部皮肤发红,1只兔局部组织水肿。各组均无皮肤烧焦。部位对照组电刺激结束后局部组织肉眼观察均无损伤。
3 讨 论
本研究结果显示,电压≤35V脉冲电刺激中上腹区不影响大白兔的心电活动。国内有研究证实,≤35V脉冲电刺激中上腹区未影响小鼠的心电活动,在≥40V时部分小鼠出现窦性过缓、停搏等心律失常的现象[4]。考虑到小鼠体积较小,因而充当电阻作用的局部组织较薄弱[4-7],也与本实验一致,因此可以认为35V是一个相对安全的电压,可以运用到人体进行治疗。目前利用电刺激治疗肿瘤[8-13]、诱导细胞凋亡的报道较多[14-19],但是电刺激疗法存在的问题是会导致肌肉震颤、呼吸抑制以及一定程度的行为异常[10],这些反应与局部组织的电阻、电荷通路等有关。各种组织的电阻不均一,电流总是流经电阻较小的组织,而内环境在高压电流条件下能够起电容作用,组织的电容作用将会使组织原有的电生理系统被打乱并重建,每个细胞内的离子均可获得电荷,离子的原有性质改变,特别是一些信号转导系统的关键离子获得了电荷,这必将改变组织细胞原有的信号传导,改变细胞最后的转归[20-25]。由于组织存在电阻,较低电压经组织传到心脏的电流较弱,对心率和心律无明显影响,但高压通过中枢神经和心脏时,所产生的电流就较大,可引起呼吸抑制、心室颤动或心跳骤停,造成昏迷或死亡,这可能与电流传递到大脑后引起心脏自主神经功能失调,或者与电压增强后电流传导至心脏,引起心肌组织损伤有关,此外,也可能与电流改变了大脑原本的生理电节律也就是脑电活动有关。临床上在癫痫患者中可观察到明显的脑电图改变,而无抽搐电痉挛治疗(MECT)中大脑的除极化可明显改善患者的精神症状,提示脑电活动与躯体及精神活动联系紧密。高压电流还可引起呼吸肌等肌肉痉挛,肌肉的强制收缩导致肌肉疲劳,呼吸功能相对减弱,血氧饱和度下降,导致组织缺氧,加重心肌损伤。此外,电刺激的损伤与机体的健康和疾病状况相关。脉冲电流刺激机体时心肌电活动及病理变化需引起关注。在未来的研究中应当尽量避免刺激神经丰富或者肌肉组织等电阻较小组织,以减少不良反应,并增加标的物的电刺激分压。
本研究结果显示,35V脉冲电刺激兔心脏前后极可导致心脏全起搏心律,同时还发现随着电刺激电压增加,起搏心律越来越明显,但大白兔的抽搐和生活行为的改变也越来越明显。在开始获得起搏心律的同时,大白兔10d后的生活行为变化不明显,但在电刺激时也有明显的局部抽搐,所以具体治疗中也可能会引起患者不适,在以后的实验中可以考虑大幅缩短刺激波宽,并相应适度提高电压,减少电刺激对周围组织的影响。根据目前的实验数据以及参考文献[4-7],刺激新西兰大白兔心脏前后极对应皮肤表面,在35V电压时,既可以引起新西兰大白兔心脏全起搏,同时又不会影响新西兰大白兔自身的心电活动,且不会造成局部组织损伤,是一个可以用于临床体外起搏器的参考阈值。
[1]Xiong YQ, Pan J, Wu XM,et al. Evaluation on clinical curative effect of myoelectricity triggering biofeedback in treatment of early hemiplegia of cerebral infarction patients[J]. J Jilin Univ (Med Ed), 2015, 41(1): 156-159. [熊英琼, 潘婕, 吴晓牧, 等.肌电触发生物反馈治疗脑梗死患者早期偏瘫的临床疗效评价[J]. 吉林大学学报(医学版), 2015, 41(1): 156-159.]
[2]Li N, Wu S, Lu GY. The Effect of different frequency and time of transcutaneous electrical nerve stimulation to current perception threshold[J]. Tianjin Med J, 2014, 42(6): 578-580. [李娜, 吴双,吕国义. 不同刺激频率与时间经穴经皮神经电刺激对电流感觉阈值的影响[J]. 天津医药, 2014, 42(6): 578-580.]
[3]Hofmann GA, Dev SB, Dimmer S,et al. Electroporation therapy: a new approach for the treatment of head and neck cancer[J]. IEEE Trans on Biomed Eng, 1999, 46(6): 752-759.
[4]Wu S, Zhang XG, Wang XX,et al. Therapeutic effect of lowfrequency pulsed electrical stimulation on melanoma in mice and its myocardial injury[J]. Med J Chin PLA, 2014, 39(12): 950-955. [吴莎, 张晓刚, 王晓旭, 等. 低频脉冲电刺激对小鼠黑色素瘤的抑瘤效应及心肌损伤作用观察[J]. 解放军医学杂志, 2014, 39(12): 950-955.]
[5]Dong XJ, Luo XD, Xiong L,et al. Effects of energy controllable steep pulses on intracellular calcium concentration and cell membrane potential[J]. Eur Rev Med Pharmacol Sci, 2014, 18(5): 680-688.
[6]Weaver JC, Smith KC, Esser AT,et al. A brief overview of electroporation pulse strength duration space: a region where additional intracellular effects are expected[J]. Bioelectrochemistry, 2012, (87): 236-243.
[7]Saulis G, Saulé R. Size of the pores created by an electric pulse: microsecondvsmillisecond pulses[J]. Biochim Biophys Acta, 2012, 1818(12): 3032-3039.
[8]Tang L, Yao C, Sun C. Apoptosis induction with electric pulses--a new approach to cancer therapy with drug free[J]. Biochem Biophys Res Commun, 2009, 390(4): 1098-1101.
[9]Beebe SJ, Sain NM, Ren W. Induction of cell death mechanisms and apoptosis by nanosecond pulsed electric fields (nsPEFs)[J]. Cells, 2013, 2(1): 136-162.
[10] Yao CG, Zhao DY, Wang JF,et al. Multi-parameter adjustable high-voltage nanosecond pulse generator for inducing apoptosis of tumor cells[J]. Chin J Sci Instrum, 2010, 31(5): 1108-1113.[姚陈果, 赵东阳, 王见飞, 等. 一种诱导肿瘤细胞凋亡的多参数可调高压纳秒脉冲发生器[J]. 仪器仪表学报, 2010, 31(5): 1108-1113.]
[11] Matsuki N, Takeda M, Ishikawa T,et al. Activation of caspases and apoptosis in response to low-voltage electric pulses[J]. Oncol Rep, 2010, 23(5): 1425-1433.
[12] Jiang C, Qin Z, Bischof J,et al. Membrane-targeting approaches for enhanced cancer cell destruction with irreversible electroporation[J]. Ann Biomed Eng, 2014, 42(1): 193-204.
[13] Linghu L, Tan Y, Lou Y,et al. Nanosecond electric pulses induce DNA breaks in cisplatin-sensitive and -resistant human ovarian cancer cells[J]. Biochem Biophys Res Commun, 2013, 430(2): 695-699.
[14] Guo F, Yao C, Li C,et al.In vivoevidences of nanosecond pulsed electric fields for melanoma malignancy treatment on tumorbearing BALB/c nude mice[J]. Technol Cancer Res Treat, 2014, 13(4): 337-344.
[15] Dai PY, Huang CL. Influence of percutaneous stimulation of hepatic region with mid-frequency pulse current on the activity of serum GSH-PX, SOD, T-AOC and the content of malondialdehyde in exercise-induced fatigued soldiers[J]. Med J Chin PLA, 2014, 39(3): 245-248. [代朋乙, 黄昌林. 中频脉冲电流经皮刺激运动性疲劳士兵肝区对血清GSH-PX、SOD、T-AOC活性及MDA含量的影响[J]. 解放军医学杂志, 2014, 39(3): 245-248.]
[16] Shawki MM, Farid A. Low electric field parameters required to induce death of cancer cells[J]. Electromagn Biol Med, 2014, 33(2): 159-163.
[17] Vermeulen K, Dirk R, Van Bockstaele DR,et al. Apoptosis: mechanisms and relevance in cancer[J]. Ann Hematol, 2005, 84(10): 627-639.
[18] Song ZQ, Xu XH, Pan ZH,et al. Mechanisms for steep pulse irreversible electroporation technology to kill human large cell lung cancer cells L9981[J]. Int J Clin Exp Med, 2014, 7(8): 2386-2394.
[19] Tang ZY, Liu Y, Liu LX,et al. RNAi-mediated MMP-9 silencing inhibits mouse melanoma cell invasion and migrationin vitroandin vivo[J]. Cell Biol Int, 2013, 37(8): 849-854.
[20] Jung JY, Kim HS, Roh MR,et al. The effect of imiquimod on matrix metalloproteinases and tissue inhibitors of metalloproteinases in malignant melanoma cell invasion[J]. Ann Dermatol, 2014, 26(3): 363-373.
[21] Hawinkels LJ, Zuidwijk K, Verspaget HW,et al. VEGF release by MMP-9 mediated heparan sulphate cleavage induces colorectal cancer angiogenesis[J]. Eur J Cancer, 2008, 44(13): 1904-1913.
[22] Gupta A, Zhou CQ, Chellaiah MA. Osteopontin and MMP9: associations with VEGF expression/secretion and angiogenesis in PC3 prostate cancer cells[J]. Cancers (Basel), 2013, 5(2): 617-638.
[23] Wu S, Wang Y, Guo J,et al. Nanosecond pulsed electric fields as a novel drug free therapy for breast cancer: anin vivostudy[J]. Cancer Lett, 2014, 343(2): 268-274.
[24] Nuccitelli R, Chen X, Pakhomov AG,et al. A new pulsed electric field therapy for melanoma disrupts the tumor's blood supply and causes complete remission without recurrence[J]. Int J Cancer, 2009, 125(2): 438-445.
[25] Chen X, Chen X, Schoenbach KH,et al. Comparative study of long- and short-pulsed electric fields for treating melanoma in anin vivomouse model[J].In vivo, 2011, 25(1): 23-27.
Effect of transcutaneous electric stimulation on the cardiac electrical activity in New Zealand white rabbits
ZHANG Wang, ZHANG Hui, WU Sha, WANG Xiao-xu, ZHANG Xiao-gang*
Department of Cardiology, First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
*< class="emphasis_italic">Corresponding author, E-mail: zxg0233@sina.com
, E-mail: zxg0233@sina.com
This work was supported by the Medicine Science and Technology Research Project of Chongqing Health Bureau (2013-1-010)
ObjectiveTo study the effect of transcutaneous electric stimulation on the cardiac electrical activity in New Zealand white rabbits, in order to search a safety threshold for clinical electrical stimulation therapy, as to provide the theoretical basis for the design of in vitro pacemaker.MethodsNew Zealand white rabbits were randomly assigned into 17 groups (6 each). Rabbits in 16 experimental groups were given 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75 and 80V electrical stimulation, respectively, with the stimulating site designated at epigastric region. BL-420F biological function experimental system was employed to supply the power and acquire the ECG, with the output pulse electrical stimulation frequency set at 270 times/minute, and the stimulating wave as square wave. A control group was set, in which the stimulating voltage was set to 35V, the stimulant anode was located in the anterior chest area, and the cathode was on the skin surface of back corresponding to the site of the heart, and the rest was the same as in experimental groups.ResultsNo stimulation rhythm was observed in rabbits of those experimental groups with voltage ≤35V, but all stimulation rhythm was observed in rabbits of control group. No arrhythmia occurred in rabbits of those experimental groups with voltage ≤30V, while the heart rate was slowed down after stimulation in rabbits of the experimental groups with voltage ≥45V stimulation. In rabbits receiving stimulation with voltage ≤35V there was no dystropy or light dystropy, but with no visible injury to the local tissues. No visible injury was observed in the rabbits undergoing stimulation with voltage ≤40V.ConclusionPulse electric stimulation with voltage ≤35V in the epigastric region would not affect the cardiac electrical activity in rabbits, while stimulation with 35V will lead to all pacing rhythm of the heart without affecting the cardiac electrical activity in rabbits, and it does not produce local tissue injury.
transcutaneous electric nerve stimulation; electrocardiography; arrhythmias, cardiac
R521
A
0577-7402(2015)08-0627-05
10.11855/j.issn.0577-7402.2015.08.05
2015-04-15;
2015-06-02)
(责任编辑:张小利)
重庆市卫生局医学科学技术研究项目(2013-0-010)
张望,硕士研究生。主要从事电刺激对心电活动影响方面的研究
400016 重庆 重庆医科大学附属第一医院心内科(张望、张辉、吴莎、王小旭、张晓刚)
张晓刚,E-mail:zxg0233@sina.com

