小鼠诱导性多能干细胞向牙源性细胞分化的体内研究*
刘 丽 宋元利 王丽英 宁 芳 刘继延
牙齿发育是一个复杂的过程,是牙源性上皮和牙源性间充质相互作用发育而成[1]。牙齿是再生医学研究领域的重要模型,运用干细胞及组织工程原理构建有生物活性的组织工程牙齿是目前国内外广为关注的热点课题。牙齿再生研究包括体外培养和体内移植实验两部分。体内移植实验是体外培养的延续,体外培养缺乏血液供应及体内的微环境,构建组织或器官必须在体内形成。因此本研究选取具有全能性的诱导性多能干细胞,在体外成功定向诱导的基础上,将细胞团植入小鼠体内,进一步观察在体内微环境下,小鼠诱导性多能干细胞向牙齿样结构分化及组织形成的潜能,以及寻找适宜的成牙微环境,为牙齿再生研究提供可行性依据。
1. 材料与方法
1.1 材料 8 周龄C57 小鼠,iPS-C5 细胞株购买于中国科学院广州生物医药与健康研究院。高糖DMEM(Gibco 公司,美国);灭活胎牛血清(Gibco 公司,美国);非必须氨基酸(Gibco 公司,美国);丙醇酸钠(Gibco 公司,美国);2-巯基乙醇(Gibco 公司,美国);白血病抑制因子(LIF,Gibco 公司,美国);抗小鼠一抗:成釉蛋白(AMBN,Santa Cruz Biotechnology 公司,美国),釉原蛋白(AMGN,Santa Cruz Biotechnology 公司,美国,成釉细胞特异性标记物),牙本质基质蛋 白-1(DMP-1,Santa Cruz Biotechnology 公司,美国),牙本质涎磷蛋白(DSP,Santa Cruz Biotechnology 公司,美国);Hoechst 33342(Sigma 公司,美国),BMP4(R&D System, 美国)。
1.2 iPS 细胞体外培养 iPS 细胞以1×105/ ml 的密度均匀接种在预先铺有滋养层细胞的培养皿内,加入高糖DMEM 培养液,37℃、5%CO2、饱和湿度培养箱中培养2d[2],待细胞贴壁后开始体外诱导。iPS 细胞常规培养液为实验A 组,成釉细胞无血清条件培养液(ASF-CM)为实验B组, ASF-CM 中加入50ng/ ml BMP4 (ASFBMP4)为实验C 组。不同条件诱导液培养iPS 细胞1 周后可在培养皿底部观察到白色膜状物质形成。将白色膜状物质剥脱到离心管内,继续培养1周,iPS 细胞逐渐聚缩成团,具备一定的厚度和强度。参照Handa 的实验方法[3],将大约2.0×106细胞与40mg 陶瓷化骨(CBB, ceramic bovine bone)粉末混合,形成iPS 细胞聚合体/CBB 复合物,用纤维蛋白胶包裹,培养液中继续培养24h,留做备用。
1.3 小鼠肾被膜移植 肾被膜下移植的操作方法可参照Colnot 的手术进路[4]。C57 小鼠采用2%戊巴比妥钠,按50mg/ kg 体重腹腔注射进行麻醉,常规备皮,小鼠采用右侧卧位以充分暴露左侧腰部,扪及左肾,消毒后在此处作1cm 切口逐层切开皮肤、肌肉,进入腹腔,轻压左肾使其从腹腔膨出,生理盐水沾湿肾表面并始终保持肾表面湿润,显微外科器械游离肾被膜形成囊性空间,将细胞团植入到肾被膜下,将左肾送回腹腔,逐层缝合。实验B 组共植入10 个细胞团,实验C 组共植入10 个。实验A 组作为对照组,共植入5 个。
1.4 组织学观察移植 6 周后取出移植物,4%多聚甲醛固定液中固定24h,低温脱钙,常规石蜡包埋,切片厚度为5μm,采用HE 染色进行组织学检测。
1.5 免疫组织荧光染色 6 周后取材,石蜡包埋切片,在二甲苯i、二甲苯ii 中依次浸泡切片15min,随后在无水乙醇、95%乙醇、75%乙醇中依次浸泡切片5min;随后在沸水中加入0.01ml枸橼酸钠缓冲溶液(pH6.0)进行抗原修复。端锅于水下冲至锅温凉;用蜡块画蜡圈;用3%双氧水于恒温箱中放置15min,蜡圈用PBS 冲洗3 次;加入吐温浸泡片刻,不冲洗,甩干后直接加入山羊血清封闭液,恒温箱内孵育半小时;滴加抗小鼠一抗AMBN(1∶100)、DSP(1∶100),4℃冰箱内过夜;次日复温1h,滴加Rhodamine 标记的羊抗兔或兔抗羊二抗(1∶200),37℃恒温箱孵育40min。封片、镜检。
2. 结果
2.1 移植物组织学观察 ASF-CM 组植入10 个细胞团,3 个移植物可观察到角化上皮样结构生成。ASF-BMP4 组植入10 个细胞团:3 个移植物可以观察到上皮样结构;5 个移植物可以观察到牙本质样结构生成,有类似于成牙本质样细胞生成,DMEM 组5 个移植物均未观察到类似于成釉细胞样或成牙本质细胞样结构形成(图1)。
2.2 免疫组织荧光检测结果 为了进一步验证HE 染色结果,利用成釉细胞特异性抗体AMBN 以及成牙本质细胞特异性抗体DSP 进行免疫组织荧光检测,荧光显微镜结果显示ASF-CM组形成的上皮样结构 AMBN 染色阳性。ASF-BMP4 组形成的上皮样结构阳性表达AMBN;形成的牙本质样结构阳性表达DSP。未诱导的DMEM 组作为对照组,AMBN、DSP 染色阴性(图2)。
3. 讨论

图1 体内移植8 周后组织学观察
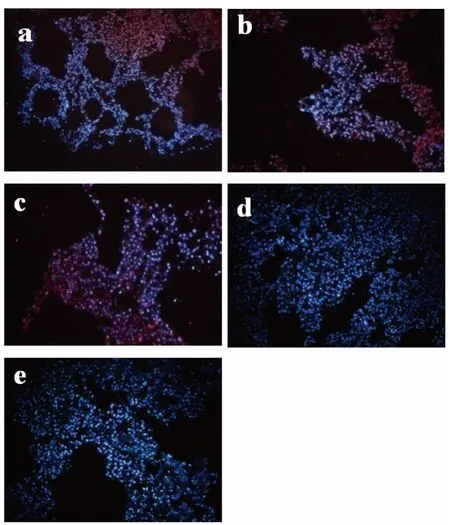
图2 体内移植8 周后免疫组织荧光染色
牙齿是一种复杂的器官,由釉质、牙本质、牙骨质、牙周膜共同构成。牙齿的发育过程是牙源性上皮细胞与牙源性间充质细胞相互作用的结果。牙源性上皮细胞可以诱导牙源性间充质细胞分化成牙本质和牙髓,而牙源性上皮又在牙源性间充质细胞诱导下分化成釉质[5]。然而牙源性上皮细胞终末分化的成釉细胞在成体中缺失,使得釉质的生物性再生成为世界性难题。本实验从出生7d 的C57 仔鼠的下颌切牙分离成釉细胞,使用成釉细胞的无血清条件培养液(ASF-CM)以及ASF-CM 联合生长因子BMP4 两种方式诱导iPS 细胞,对照组为未诱导的iPS 细胞。小鼠肾被膜下移植8 周后取材结果显示:ASF-CM 组形成角化上皮样结构,免疫组织荧光检测显示形成的上皮样结构属于牙源性上皮,AMBN 表达阳性。ASF-BMP4 组可观察到上皮样结构和牙本质样结构生成,进一步免疫组织荧光检测AMBN、DSP 阳性,提示ASF-BMP4 组向成釉细胞谱系和成牙本质细胞谱系转化。对照组形成畸胎瘤样结构,没有观察到明显的成釉细胞样和成牙本质细胞样结构生成,AMBN、DSP 表达均阴性。本实验验证了我们前期体外研究的结果[6],在适宜的微环境下,iPS 细胞可以向牙上皮样结构和牙本质样结构转化。
微环境是组织工程再生研究的一个重要因素,是细胞在体内赖以生存的环境,由细胞、生长因子、细胞外基质构成,三者之间通过相互作用构成一个三维的动态空间,控制着细胞的增殖、迁移和分化[7]。近年来有许多研究利用牙胚细胞条件培养液模拟牙齿早期发育的微环境,诱导牙源性干细胞或非牙源性干细胞向牙本质方向转化。发育早期的牙胚细胞中含有牙齿发育所需的全部信息,牙胚细胞之间通过传递这些信息,实现牙齿的形态发生[8-10]。于金华博士利用大鼠切牙牙胚细胞条件培养液,将牙髓干细胞分化为成牙本质细胞,肾被膜移植后形成牙本质牙髓复合体样结构。并且,于金华博士认为牙胚细胞条件培养液微环境下,牙髓干细胞牙向分化的过程是牙源性上皮信号起决定性作用的结果[11]。宁芳博士利用成釉细胞无血清条件培养液将胚胎干细胞分化为牙源性上皮细胞,推测成釉细胞分泌的BMPs、Notch-1、TGF-βs 和FGFs 等一些信号分子通过相互协同或拮抗作用,使胚胎干细胞产生了特殊的感受性,从而向牙上皮方向转化[12]。
BMPs 是口腔上皮中最早表达的信号分子之一,在上皮-间充质的相互诱导中起关键的调节作用[13]。BMPs 信号首先在胚胎11d 的小鼠牙上皮中表达,BMPs 与其他生长因子相互协同诱导下方间充质中转录因子的表达。随后转移到下方的间充质中,BMPs 又反馈调节上皮信号因子的表达。国内外研究表明BMP2 能促进牙髓干细胞分化为成牙本质细胞[14-15]。Col-Ⅰ联合BMP4 可以诱导小鼠ES/ iPS 细胞向成牙本质细胞分化[16-17]。我们前期体外研究通过加入BMP4 的拮抗剂noggin,亦证明了BMP4 在iPS 牙向分化中发挥着重要作用[6]。
虽然在本实验中我们取得的结果并不典型,但仍有一定的探索性,而如何提高iPS 细胞的诱导效率以及避免iPS 细胞致畸性也存在很大困难。另外,单一的因子不能模拟复杂的牙胚发育环境,如何建立一个适宜的微环境高效率的诱导iPS 细胞牙向分化,仍需要我们不断的努力。
[1] Dogan A,Demirci S,Sahin F. In vitro differentiation of human tooth germ stem cells into endothelial-and epithelial-like cells[J]. Cell Biol Int,2015,39(1): 94-103
[2] 刘 丽,李亚静,赵文峰. 小鼠诱导性多能干细胞向牙源性细胞分化的实验研究[J]. 中华老年口腔医学杂志,2014,12(1):48-52
[3] Handa K,Saito M,Tsunoda A,et al. Progenitor cells from dental follicle are able to form cementum matrix in vivo[J].Connect Tissue Res,2002,43(2-3):406-408
[4] Colnot C,Lu C,Hu D,et al. Distinguishing the contributions of the perichondrium, cartilage, and vascular endothelium to skeletal development[J]. Developmental Biology,2004,269(1):55-69
[5] 包柳郁,金 岩,牛忠英,等.人牙源性上皮细胞的体外培养研究[J]. 临床口腔医学杂志,2003,19(17):643-645
[6] 刘 丽,王红雷,陈增力,等.骨形成蛋白-4 对小鼠诱导性多能干细胞牙向分化能力的影响[J]. 中华老年口腔医学杂志,2014,12(5):257-261
[7] Morrison SJ,Spradling AC. Stem cells and niches: mechanisms that promote stem cell maintenance throughout life[J].Cell,2008,132(4):598-611
[8] 李瑞奇,黄晓峰,张方明.Shh 诱导牙齿发育分子机制的研究进展[J].口腔颌面修复学杂志,2012,13(4):250-253
[9] Kheralla Y,Gotz W,Kawarizadeh A. IGF-I,IGF-IR and IRS1 expression as an early reaction of PDL cells to experimental tooth movement in the rat [J]. Arch Oral Biol,2010,55(3): 215-222
[10] Farea M,Husein A,Halim AS,et al. Synergistic effects of chitosan scaffold and TGFβ1 on the proliferation and osteogenic differentiation of dental pulp stem cells derived from human exfoliated deciduous teeth[J]. Arch Biol,2014,59(12):1400-1411
[11] Yu JH,Deng ZH,Shi JN,et al. Differentiation of dental pulp stem cells into regular-shaped dentin-pulp complex induced by tooth germ cell conditioned medium [J]. Tissue Eng,2006,12(11):3097-3105
[12] Ning F,Guo Y,Tang J,et al. Differentiation of mouse embryonic stem cells into dental epithelial-like cells induced by ameloblasts serum-free conditioned medium[J]. Biochem Biophys Res Commun,2010,394(2): 342-347
[13] Hosoya A,Kim JY,Cho SW,et al. BMP4 signaling regulates formation of Hertwig' s epithelial root sheath during tooth root development[J]. Cell Tissue Res,2008,333(3):503-509
[14] Iohara K,Nakashima M,Ito M,et al. Dentin regeneration by dental pulp stem cell therapy with recombinant human bone morphogenetic protein 2 [J]. J Dent Res,2004,83(8):590-595
[15] Saito T,Ogawa M,Hata Y,et al. Acceleration effect of human recombinant bone morphogenetic protein-2 on differentiation of human pulp cells into odontoblasts[J]. J Endod,2004,30(4):205-208
[16] Kawai R,Ozeki N,Yamaguchi H,et al. Mouse ES cells have a potential to differentiate into odontoblast-like cells using hanging drop method [J]. Oral Dis, 2013, doi:10.1111/ odi.12134. [Epub ahead of print]
[17] Ozeki N,Mogi M,Kawai R,et al. Mouse induced pluripotent stem cells differentiate into odontoblast-like cells with induction of altered adhesive and migratory phenotype of integrin[J]. PLoS One,2013,8(11):e80026

