MTAD 等根管冲洗剂对根管内粪肠球菌的消毒作用*
何薇薇 安 峰 林媛媛 王晓明 商炜娜
有学者研究证实,即便在没有其他微生物存活的情况下,粪肠球菌也能够耐受根管内营养缺乏的恶劣环境,并且能够侵入牙本质小管,在导致根管系统感染的细菌当中,粪肠球菌是最难以清除的微生物之一[1]。本实验研究旨在离体牙上建立粪肠球菌感染根管的模型,来检测不同冲洗剂对根管内粪肠球菌的抗菌效果。
1. 材料与方法
1.1 实验标本 挑选河北北方学院附属第一医院口腔门诊新鲜拔除的40 颗单根管牙,去除根周软组织、牙石等,清洗干净后放在生理盐水中4℃冰箱保存备用。纳入标准:要求单根管,根尖孔闭合,无近髓龋坏或充填体,根裂等缺陷。
1.2 离体牙预备 用无菌金钢砂片切除牙冠,保留牙根长度为15mm。常规消毒拔髓,首先用机用Protaper 器械中的SX 敞开根管口,然后用S1、S2、F1、F2 逐序进行预备,根管预备过程中每换一次器械用0.9%NaCl 溶液冲洗,时间为1min。预备完毕后,用树脂在根尖部做封闭。然后将所有离体牙放入含有5ml 脑心浸润液(BHI 肉汤)的试管中,121℃高温高压下灭菌20min,静置于5%CO2培养箱(37℃)内培养,如BHI 肉汤在24h 后无混浊,即认定灭菌完全。
1.3 感染模型的建立 在超净工作台上,常温下将粪肠球菌冰冻液复苏,将其接种于BHI 肉汤中, 用比浊仪调整浑度为0.5M 的标准菌液备用.将所有牙根分别浸泡在包含粪肠球菌混浊度为1.5×108CFU/ L 的BHI 中,孵育箱孵育,隔日更换一次新鲜培养菌液至21d,并随机抽取任一标本菌液进行微生物检测,根据菌落形态及革兰染色,确定无杂菌污染。
1.4 实验分组 将已感染粪肠球菌的离体牙模型,随机分为五组,每组各8 例样本,分别用0.2%浓替硝唑含漱液(A 组),MTAD 冲洗液(B组),3%双氧水(C 组),2.5%NaClO(D 组),0.9%NaCl(E 组)冲洗。
1.5 感染模型的取样及细菌培养计数 所有样本用蜡包埋在无盖塑料容器中,均按下颌牙位操作。
1.5.1 第一次取样(N1) 根管冲洗前戴无菌手套用无菌镊子夹持30 号无菌吸潮纸尖按照记录的工作长度插入根管内停留1min,吸取根管内液后,立即放入装有100μm 生理盐水的Eppendorf管中混匀,10 倍系列稀释,分别接种于BHI 血琼脂平皿上,37℃下CO2孵育箱中培养,48h 后计数菌落数(CFU/ml),记为N1(图1、图3、图5、图7、图9)。
1.5.2 第二次取样(N2) 在无菌条件下用手动不锈钢K 锉继续预备离体牙的根管中下段,预备至40 号,每更换一次器械时分别按照上述的五组冲洗液进行根管冲洗。最后为避免冲洗液的过度作用,用2ml 蒸馏水冲洗根管。然后用无菌镊子夹持30 号无菌吸潮纸尖按照记录的工作长度插入根管内停留1min,吸取根管内液,放入装有100μm 生理盐水的Eppendorf 管中,10 倍系列稀释,送培养计数,记为N2(图2、图4、图6、图8、图10)。
冲洗方法:冲洗时,使用23G 直径0.6mm 侧向开口针头插入工作长度后退1mm 并上下提拉、左右移动针头。每次冲洗使用5ml 冲洗液用时1min。
1.6 统计方法 用SPSS19.0 统计软件进行数据分析。
对冲洗前后的CFU 数据做lgCFU 转换,利用方差分析做统计学处理。
附表 几种冲洗液冲洗前后根管内细菌量的变化(±s)

附表 几种冲洗液冲洗前后根管内细菌量的变化(±s)
冲洗液组 样本数 冲洗前N1 冲洗后N2 差值A 组 8 例 8.6915±0.1527 3.1894±0.2338 5.5020±0.3001 B 组 8 例 8.7135±0.1506 1.9943±0.4835 6.7192±0.4458 C 组 8 例 8.6701±0.1724 6.1193±0.2733 2.5508±0.3526 D 组 8 例 8.6758±0.1133 3.1815±0.0723 5.4944±0.1058 E 组 8 例 8.6758±0.1133 7.6701±0.1724 1.0057±0.2420
2. 结果
根据细菌培养计数结果附表显示:冲洗前五组根管内细菌数量的差异无统计学意义(P>0.05)。经过冲洗后除0.9%NaCl(E 组)和3%双氧水(C 组)外,其他三组均有效地降低了根管内的细菌数量,较冲洗前细菌CFU 下降量差异有统计学意义(P<0.05)。冲洗前后细菌差值的两两比较:B 组与A 组、D 组间差异有显著性(P<0.05),A 组和D组间差异无显著性(P>0.05)。图1-图10 为各组在使用冲洗剂冲洗前、后根管内粪肠球菌的培养图片。

图1 冲洗前(A 组)

图2 冲洗后(A 组)

图3 冲洗前(B 组)
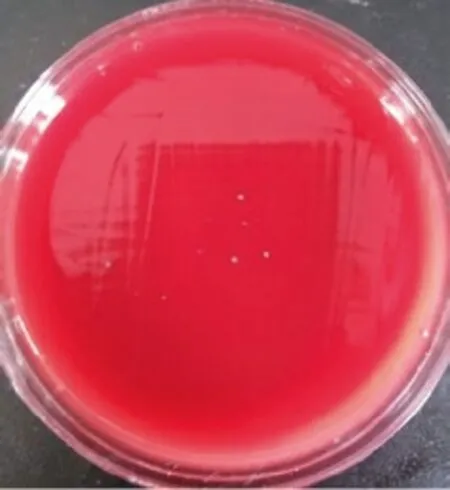
图4 冲洗后(B 组)

图5 冲洗前(C 组)

图6 冲洗后(C 组)

图7 冲洗前(D 组)

图8 冲洗后(D 组)

图9 冲洗前(E 组)

图10 冲洗后(E 组)
3. 讨论
细菌一直被公认是根管及根尖周病损发展的主要致病因素[2,3]。成功的根管治疗取决于彻底地化学机械清理牙髓组织,牙本质碎片和感染的微生物。根管冲洗剂可以通过冲掉碎屑增加机械清理的效果,溶解组织并消毒根管系统。化学清理尤其适用于复杂的牙齿内部解剖结构(如根管峡部)和易被机械清理遗漏的其他不规则区域[4]。
近年来,粪肠球菌的作用越来越受到口腔学者的关注。George 等[5]观察到当粪肠球菌在营养充足且有氧的条件下生长时, 可形成结构庞大、不规则的生物膜结构, 而当营养缺乏时在生物膜中存在的钙的水平会增加,这时细菌主要依靠周围这种钙化的基质保护而在生物膜中长期存活。因粪肠球菌的直径仅为0.5-1μm,而牙本质小管的直径平均为1-4μm ,所以粪肠球菌相对大多数细菌更易进入牙本质小管[6]。所以本实验建立粪肠球菌体外根管感染模型,并用传统根管冲洗剂与MTAD 做对照。
根管冲洗剂是具有杀菌、溶解坏死组织作用的无刺激性水溶液,在根管机械预备时使用可增进根管内细菌及碎屑的清除。几十年来,多种不同浓度的次氯酸钠被用作根管冲洗剂。次氯酸钠的主要优势是它对坏死组织的溶解能力及对大多数微生物的抗菌性能[7]较强大。它的弊端是难闻的气味、高毒性、不能去除玷污层[8]。次氯酸钠的组织溶解能力及抗菌性能与其浓度有关,并受pH 值及温度等影响在临床上使用高浓度次氯酸钠进行根管内冲洗时需配合橡皮障[9]。0.2%浓替硝唑含漱液为抗厌氧菌药,它可抑制细菌DNA 的合成,导致细菌死亡。3%H2O2是临床上常用的根管冲洗剂,当其遇到有机物如:组织液、血液、脓液、细菌时,可释放出新生态氧,使细菌体内活性基团氧化,干扰细菌的酶系统,对厌氧菌的作用尤其明显。因双氧水与有机物接触会很快释放出氧而发生发泡现象,这种发泡作用有助于在器械扩挫根管时将血液、残髓带出,漂浮至表面便于清除。但其为酸性溶液,它对根尖周组织及黏膜有一定刺激作用,在临床根管冲洗时如操作不当可引起皮下气肿。MTAD 是一种以多西霉素、柠檬酸和清洁剂聚山梨醇酯80 为主要成分的冲洗剂,是一种新的有抗菌作用的根管冲洗剂,溶液呈酸性,pH 值为2.15,生物相容性好。Torabinejad 等[10]的体外研究,MTAD 稀释200 倍可有效杀死粪肠球菌;次氯酸钠稀释32 倍以上就不具备抗菌作用;而EDTA 不具备任何抗菌作用。只有MTAD 在2-5min 内可以杀死暴露在其内的粪肠球菌。本实验研究的MTAD 对感染根管消毒效果的研究结果与之前其他学者的报道相似[11]。MTAD 在消毒根管内及牙根表面的能力主要取决于多西环素的抗菌效果,在柠檬酸的作用下多西环素可去除牙根表面的有机物和无机物,其效力取决于它的低PH、抗胶原酶活性及其结合牙本质的能力。MTAD 里的清洁剂可帮助冲洗液进入根管和牙本质小管。MTAD 通过清洁剂的作用可减少牙齿的表面张力,提高其在根管内的抗菌性能[12-13]。有学者通过电镜观察发现MTAD 还有去除玷污层的能力[14-15]。所以综合以上,MTAD 具有多种优良性能。
本实验在离体牙根管预备时分别用0.2%浓度替硝唑含漱液,MTAD 冲洗液,3%双氧水,2.5%NaClO 和0.9%NaCl 冲洗,冲洗过程中每组使用的冲洗方法、器械、时间、药量均相同,排除了这些因素对实验结果可能造成的影响。结果显示,MTAD 虽不能完全清除根管内的粪肠球菌,但与其他根管冲洗剂比较冲洗前后CFU 的减少量较多,MTAD 冲洗液对根管内粪肠球菌的抗菌性能明显优于其他组。但由于本次实验选用的为根管系统相对简单的单根管离体牙,且不能完全模拟患者口腔内的细菌环境,所以MTAD 在人体内对抗粪肠球菌是否具备优越抗菌效果还有待于进一步研究。
[1] PNR. On the causes of persistent apical periodontitis: a review[J].Int Endod J,2006,39(4):249-281
[2] Baumgartner JC,Falkler WA. Bacteria in the apical 5mm of infected root canals[J]. J Endod,1991,17:380-383
[3] Sjogren U,Figdor D,Persson S,et al. Influence of infection at the time of root filling on the outcome of endodontic treatment of teeth with apical periodontitis[J]. Int Endod J,1997,30:297-306
[4] 何 捷,郭家平,董青山. 超声冲洗应用于老年人隐裂牙牙髓炎一次性根管充填治疗术的临床评价[J].中华老年口腔医学杂志,2013,11(1):11-14
[5] George S,Kishen A,Song KP. The role of environmental changes on monospecies biofilm form atcion on root canal wall by Enterococcus faecalis[J]. J Endod,2005,31(12):867-872
[6] 于世凤.口腔组织病理学[M].第5 版.北京:人民卫生出版社,2003: 53
[7] Harrison JW.Irrigation of the root canal system[J].Dent Clin N Am,1984:797-808
[8] Spångberg L,Engström B,Langeland K. Biologic effects of dental materials. 3. Toxicity and antimicrobial effect of endodontic antiseptics in vitro[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,1973,36:856-871
[9] 黄 辉,罗丽华,张晓希.超声和冲洗液联合应用在根管预备中的抗菌效果[J].实用口腔医学杂志,2007,23(1):117-119
[10] Torabinejad M, Shabahang S, Aprecio R, et al. The antimicrobial effect of MTAD: An in vitro investigation[J]. J Endod,2003,29:400
[11] Shabahang S, Pouresmail M, Torabinejad M. In vitro antibacterial efficacy of MTAD and sodium hypochorite[J]. J Endod,2003,29:450-452
[12] Barbosa SV, Spangberg LS, Almeida D. Low surface tension calcium hydroxide solution is an effective antiseptic[J]. Int Endod J,1994,27:6-10
[13] Haapasalo H,Siren E,Waltimo T. Inactivation of local root canal medicaments by dentin: in vitro study[J]. Int Endod J,2000,32:94-98
[14] Portenier I,Haapasalo H,Orstavik D. Inactivation of the antibacterial activity of iodine potassium iodide and chlorhexidine digluconate againstEnterococcus faecalisby dentin,dentin matrix,type-I collagen,and heat-killed microbial whole cells[J]. J Endodon,2002,28:634-637
[15] Torabinejad M,Khademi AA,Babagoli J,et al. Effect of MTAD on the surface of instrumented root canals [J]. J Endodon,2003,29:170-175

