棉花黄萎病菌致病相关基因的分离及敲除载体的构建
李小萍,汪 敏,赵 杨,丁胜利,李洪连,马宗斌(.河南农业大学植物保护学院,河南 郑州 45000; .河南农业大学农学院,河南 郑州 45000)
棉花黄萎病菌致病相关基因的分离及敲除载体的构建
李小萍1,汪 敏1,赵 杨1,丁胜利1,李洪连1,马宗斌2
(1.河南农业大学植物保护学院,河南 郑州 450002; 2.河南农业大学农学院,河南 郑州 450002)
利用分生孢子蘸根法筛选棉花黄萎病菌T-DNA插入转化体库,获得了1个致病力减弱的突变体V546,该突变体在PDA平板上不产生微菌核。利用hiTAIL-PCR技术,获得了突变体V546 T-DNA插入的侧端序列。序列比对分析表明,该突变体T-DNA插入位点在大丽轮枝菌基因VDAG_07282.1的编码区。
棉花黄萎病;大丽轮枝菌;致病相关基因;侧端序列;敲除载体
棉花黄萎病是棉花生产上最重要的病害之一,几乎遍及全球各主要棉区,造成严重的经济损失[1,2]。大丽轮枝菌(Verticilliumdahliae)是引起棉花黄萎病的主要原因。棉花黄萎病菌作为典型的土传性病原真菌,该病原菌致病机理复杂。目前,对其致病机理的研究主要存在堵塞学说[3]和毒素学说[4,5]2种观点。随着大丽轮枝菌基因组序列的完成,黄萎病菌致病分子机理及微菌核形成机理的研究取得一定进展[6]。研究表明,真菌里一些保守的信号传导途径如cAMP依赖的蛋白激酶A途径、促分裂原蛋白激酶途径(MAPK)、感受营养信号的SNF途径和小GTPase Rac1等,与黄萎病菌的致病力或微菌核的形成有关[7-11]。TZIMA等[7,8]利用同源重组技术敲除了大丽轮枝菌cAMP依赖的蛋白激酶A基因VdPKAC1(VerticilliumPKA catalytic subunit),发现其与致病性有关, 而蔗糖非发酵的蛋白激酶VdSNF1基因(Verticilliumsucrose nonfermenting 1 gene)敲除突变体表现为致病力显著下降,且细胞壁降解酶活性显著降低。RAUYAREE等[9]成功敲除了MAPK信号转导途径的VMK1(VerticilliumMAP Kinase 1)基因,VMK1突变体表现出明显的致病性下降,且影响微菌核的形成。TIAN[10]研究表明,小GTPase VdRac1与P21活化激酶Cla4(p21 activated kinase Cla4)调节黄萎病菌菌丝的极性生长和致病力。敲除后发现突变体毒性降低,致病力明显减弱。SANTHANAM[11]研究发现转录调控因子VdSeg1 是大丽轮枝菌致病性重要的调控因子,Seg1突变体完全丧失对番茄的致病力。利用正向遗传学途径,利用农杆菌介导构建黄萎病菌T-DNA插入突变体库,筛选致病力减弱或微菌核形成缺陷的突变体,进而分离并鉴定致病相关基因或微菌核形成相关基因的功能,是黄萎病菌功能基因组学研究的一种有效途径。利用该策略,ZHANG[12]筛选黄萎病菌T-DNA插入突变体库,鉴定VdPR3基因参与菌落生长、微菌核形成、胞外酶活性和毒素的形成。TIAN[13]研究发现黄萎病菌VdMsb基因与微菌核的形成和毒性有关,该基因敲除体产孢能力明显下降。近年来,尽管国内外有关黄萎病菌致病机理研究取得一定进展,但同其他植物病原真菌相比,其致病机理的研究相对滞后。本研究从T-DNA插入突变体库中筛选出1个T-DNA插入微菌核形成能力丧失且致病力减弱的突变体,利用hiTAIL-PCR方法扩增其侧端序列,构建了该基因的敲除载体,为研究该致病基因的功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株与质粒 供试菌株为河南农业大学植物病理学实验室前期保存的强致病力落叶型棉花黄萎病菌FGH2菌株及构建的黄萎病菌FGH2T-DNA插入转化子菌株[14];致病基因敲除载体构建所用质粒为pKOV21,由中国农业大学彭友良教授提供;pMD19-T Vector购自宝生物工程(大连)有限公司;大肠杆菌感受态DH5α由河南农业大学植物病理学实验室自备。
1.1.2 主要试剂与材料 Premix Taq,T4 DNA Ligase和限制性内切酶均购自Taraka公司;DNA Marker购自宝生物工程(大连)有限公司;Ampicillin购自北京索莱宝公司;质粒提取试剂盒和PCR产物回收试剂盒购自上海生工生物有限公司。
1.2 方法
1.2.1 黄萎病菌T-DNA插入转化体的致病力测定 致病力测定采用分生孢子悬浮液蘸根法。致病力测定所用的棉花品种为感黃萎病品种银山1号。将供试棉种催芽,在温室中进行育苗。将黄萎病菌单孢分离并活化后,将黄萎病菌分生孢子1.0×106个·mL-1涂布在PDA平板上。6 d后,收集待测的棉花黄萎病菌T-DNA 插入突变体和野生型菌株FGH2分生孢子悬浮液,调节其浓度至1.0×107个·mL-1。待棉苗长至2片真叶时,挑选根系生长良好的植株进行浸根40 min接种后,移栽至装有无菌土的纸杯中,25 ℃下培养。每个菌株接种10株棉苗,3次重复。接种30 d后,按照石磊岩等[15]棉花苗期分级标准进行病情调查。
棉花苗期叶片分级标准为: 0 级:健株,无症状; 1 级:1~2 片子叶发病; 2 级:1 片真叶发病; 3 级:2 片以上真叶发病或脱落仅剩心叶; 4 级:植株生长点或全株枯死。
1.2.2 黄萎病菌T-DNA插入转化体微菌核形成能力测定及菌落形态观察 将筛选获得的致病力减弱的黄萎病菌T-DNA 插入突变体和野生型菌株FGH2接种于PDA培养基平板上,暗培养1周后,用直径0.7 cm的打孔器在菌落的边缘处选取菌饼,置于PDA平板中心,暗培养15 d后对其进行菌落形态的观察和分类。根据突变体的菌落形态[16]和黑色微菌核的有无将其分为菌核型、菌丝型和中间型3种类型。
1.2.3 黃萎病菌T-DNA插入突变体侧翼序列的获得 将待测突变体菌株和野生型菌株FGH2接种于Czapek液体培养基中,150 r·min-1培养6 d,收集菌丝,采用CTAB法提取菌株的基因组DNA。采用hiTAIL-PCR法扩增突变体T-DNA插入位点侧端序列,试验参照LIU等[17]的方法进行。所用随机引物序列和特异性引物序列如表1。
1.2.4 PCR产物连接、测序和序列分析 将第3轮PCR产物切胶回收后与pMD19-T载体连接,转化到大肠杆菌DH5α感受态中,蓝白斑挑取阳性克隆,以AC1和RB-2b为引物进行测序。获得的突变体T-DNA插入位点右侧序列与美国BROAD研究所(http://www.broad.mit. edu/)公布的大丽轮枝菌VDLs.17和黑白轮枝菌(V.albo-atrum)VaMs.102的基因组序列进行比对分析。
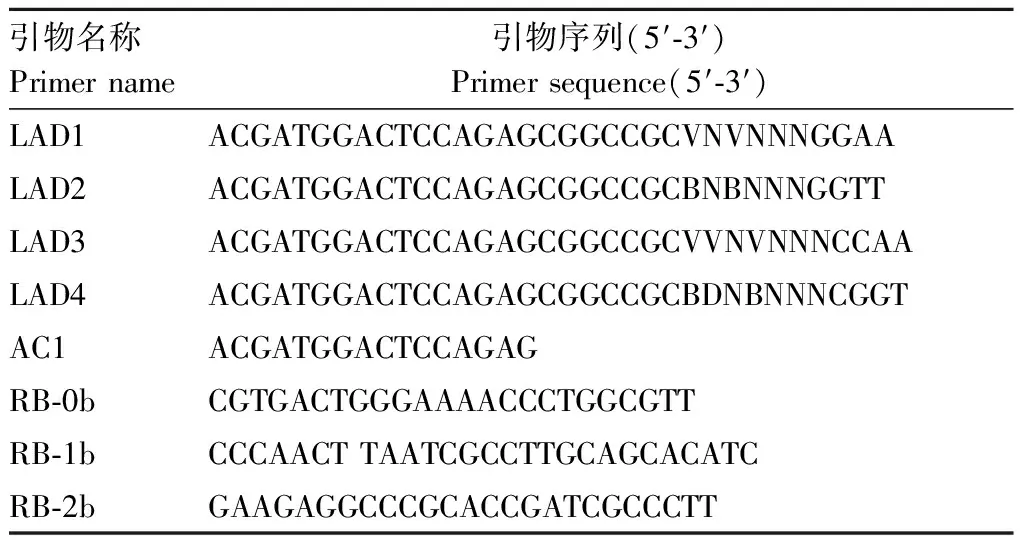
表1 hiTAIL-PCR扩增引物列表Table 1 Primers list used for hiTAIL-PCR
注:LAD1-LAD4 是简并引物;RB-0b-RB-2b是特异性嵌套引物。M=A/C,R=A/G,W=A/T,S=G/C,Y=C/T,K=G/T,V=A/G/C,H=A/C/T,D=A/G/T,B=G/C/T,N=A/G/C/T。
Note: LAD1-LAD4 are longer arbitrary degenerate; RB-0b-RB-2b are specific nested primers. M=A/C,R=A/G,W=A/T,S=G/C,Y=C/T,K=G/T,V=A/G/C,H=A/C/T,D=A/G/T,B=G/C/T,N=A/G/C/T.
1.2.5 黄萎病菌致病相关基因敲除载体的构建
1.2.5.1 黄萎病菌致病相关基因VDAG_07282.1及上、下游序列的获得 扩增目标基因上、下游特异引物的设计:从大丽轮枝菌VDLs.17基因组数据库中,选取基因VDAG_07282.1编码区的上、下游1 200 bp的序列,利用 DNAman 软件设计扩增基因VDAG_07282.1上、下游序列的引物,并在上、下游引物上加上合适的酶切位点(表2)。
目标基因上、下游序列的获得:以黄萎病菌FGH2基因组DNA为模板,分别以引物546UP/F和546UP/R扩增基因VDAG_07282.1的上游片段,以引物546DOWN/F和546DOWN/R扩增基因VDAG_07282.1下游片段。扩增体系为:基因组DNA 1 μL,546UP/F(546DOWN/F)1 μL,546UP/R(546DOWN/R)1 μL,Premix Taq 12.5 μL,ddH2O 9.5 μL。反应条件为:94 ℃预变性2 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。
1.2.5.2 中间载体的构建 将扩增的上下游PCR产物,利用PCR产物回收试剂盒进行纯化。纯化后的上游片段及质粒pKOV21用限制性内切酶BamHI 30 ℃下酶切12 h后,再加入限制性内切酶EcoRI 37 ℃酶切9 h,酶切后回收酶切产物,并通过T4连接酶将上游片段连接到pKOV21上,连接产物命名为p546UPKOV21。

表2 构建敲除载体所用引物及引入的酶切位点Table 2 The primers used for a knockout vector and the enzymes introduced from primers
注:下划线处为酶切位点,波浪线处为保护碱基。
Note:The underline line is for enzyme loci, while the wavy lines are protecting base.
利用潮霉素基因设计特异引物,用于构建载体的检测(表2)。将p546UPKOV21连接产物转化大肠杆菌,进行蓝白斑挑选,挑取白色菌落在LB液体培养基内摇培5~6 h,以546UP/F和HYG/R为引物进行阳性菌液PCR筛选。用质粒提取试剂盒提取阳性克隆的质粒DNA,对构建的中间载体p546UPKOV21用BamHI和EcoRI进行双酶切验证。
1.2.5.3 敲除载体的构建 将下游片段与p546UPKOV21同时用限制性内切酶HindIII和KpnI 在37 ℃下双酶切,将酶切产物纯化后,利用T4连接酶连接,得到p546KOV21,即为敲除载体。将p546KOV21转化大肠杆菌,进行蓝白斑挑选。挑取白色菌落在LB液体培养基内摇培5~6 h,以546UP/F和546DOWN/R为引物进行阳性菌液PCR筛选,并将获得的阳性克隆加甘油保存到-80 ℃。用试剂盒提取阳性克隆的质粒DNA,使用HindIII和KpnI在37 ℃进一步进行双酶切验证。
2 结果与分析
2.1 黄萎病菌T-DNA 插入转化体的致病力测定
对100个黄萎病菌T-DNA插入转化体和野生型菌株利用分生孢子悬浮液浸根接种,测定转化体与野生型的致病性差异。结果表明,野生型黄萎病菌FGH2在接种12 d后叶片出现典型症状,21 d后病情严重,30 d大多数植株叶片脱落成光杆,表现为典型的落叶型症状(表3)。大多数转化体致病力未发生显著变化,7%的转化体致病力降低,而转化体V546致病力显著降低(表3)。同野生型菌株FGH2相比,V546 12 d开始出现典型的黄萎病症状,但病情扩展较慢,30 d后仅表现为下部叶片黄化(图1)。
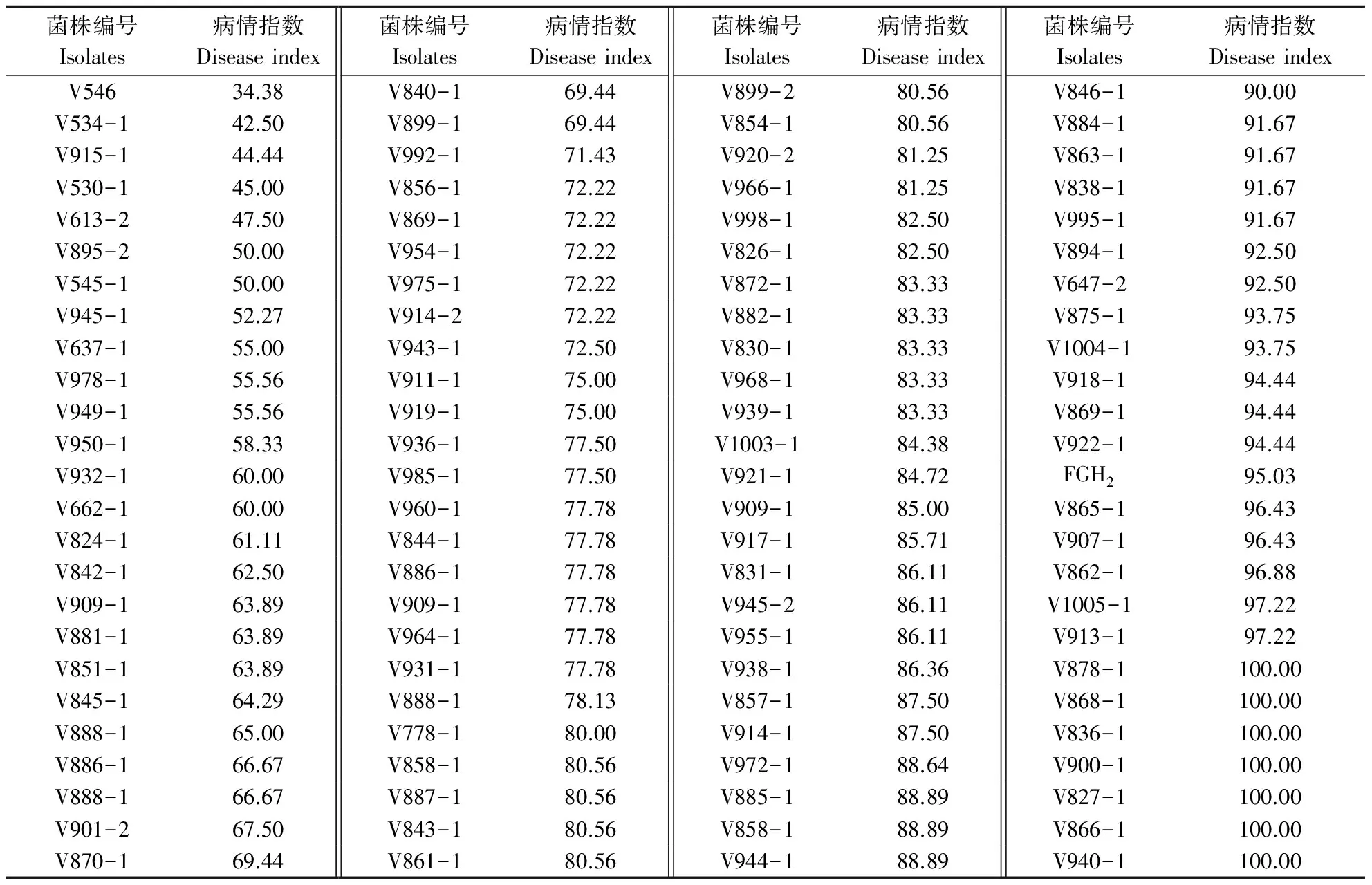
表3 黄萎病菌T-DNA插入转化子接种银山1号致病性测定结果 Table 3 Pathogenicity assays of V.dahliae FGH2 and T-DNA Transformants on cotton Yinshan 1 post inoculation 30 days

图1 黄萎病菌突变体V546接种30 d症状Fig.1 Disease symptoms of cotton plants Yinshan 1 post inoculation 30 days with V.dahliae FGH2 and mutant V546
2.2 棉花黄萎病菌突变体生物学筛选
将致病力显著减弱的黄萎病菌突变体V546菌饼置于PDA上培养15 d后,突变体V546菌落平铺,气生菌丝较少、白色,没有黑色微菌核产生(图2)。
2.3 T-DNA插入突变体V546侧端序列扩增
采用hiTAIL-PCR方法扩增突变体V546 T-DNA插入位点的侧端序列。将第2轮和第3轮的扩增的PCR产物进行凝胶电泳图谱分析,对第2,3轮的条带大小做比较,理论上第3轮的条带比第2轮小约70 bp,为本研究所需要的特异性条带(图3)。

图2 野生型FGH2和突变体V546在PDA平板上培养15 d后菌落形态Fig.2 The colony morphology of FGH2 and mutant V546 grown on PDA plate for 15 days

注: 1.第2轮hiTAIL-PCR产物;2.第3轮hiTAIL-PCR产物。
Note:1.The secondary hiTAIL-PCR products; 2.The tertiary hiTAIL-PCR products.
图3 大丽轮枝菌突变体T-DNA侧翼序列 hiTAIL-PCR第2步和第3步产物琼脂糖凝胶电泳
Fig.3 Agarose gel electrophoresis patterns ofV.dahliaemutants T-DNA flanking sequence secondary and tertiary hiTAIL-PCR products.
2.4 黃萎病菌突变体V546T-DNA插入侧翼序列的分析
将扩增的目标片段连接到pMD19-T载体上,经PCR筛选后,选择阳性克隆,送华大基因生物公司测序,测序结果见图4。图4中下划线序列为T-DNA右侧臂序列。

注:波浪线处为载体序列,下划线处为比对序列。 Note: The wavy lines indicated vector’s sequence,underline line as gene’s sequence.
将获得的T-DNA侧翼序列与大丽轮枝菌VDLs.17和黑白轮枝菌VaMs.102基因组序列进行比对,结果发现扩增得到突变体V546 T-DNA插入位点右侧翼序列大小为112 bp,T-DNA插入位点位于V.dahliaeVdLs.17 菌株的5号染色体16重叠群的289 278 bp处,位于基因VDAG_07282.1的外显子上(图5),该基因编码一个未知功能蛋白。
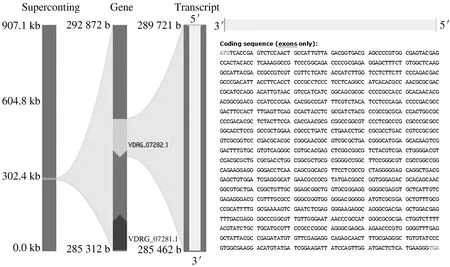
图5 VDAG_07282.1基因的结构图Fig.5 Gene structure of VDAG_07282.1
2.5 目标基因上下游序列的获得
以黄萎病菌野生型菌株FGH2基因组DNA为模板,以引物546UP/F和546UP/R扩增出基因VDAG_07282.1的上游片段,大小为1 003 bp。以引物546DOWN/F和546DOWN/R扩增出其下游片段,大小为1 006 bp(图6)。
2.6 中间载体p546UPKOV21 的构建及菌液PCR筛选和酶切验证
将目标基因的上游片段和质粒pKOV21用BamHI和EcoRI双酶切后用T4连接酶进行连接,将连接产物p546UPKOV21转化大肠杆菌DH5α,挑取阳性菌落摇菌,以546UP/F和HYG/R为引物进行菌液PCR验证,结果得到的条带大小与预期结果一致(图7)。同时用BamHI和EcoRI进行酶切验证重组质粒,酶切结果与预期结果相同(图8),表明目标基因上游片段已成功连接到pKOV21上。

注:M.DL2000;1.基因上游片段;2.基因下游片段。Note: M.DL2000;1.Gene segments of upstream;2.Gene fragment of the downstream.

注: M.DL10000;1.阴性对照;2~11.p546UPKOV21。 Note: M.DL10000;1.Negative control; 2~11.p546KOV21.
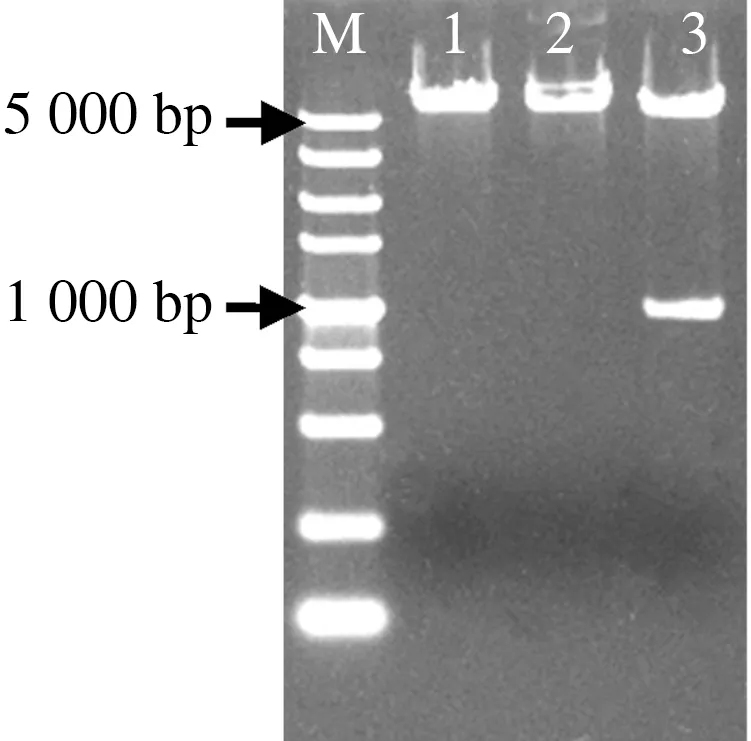
注: M.DL5000;1.BamH I酶切;2.EcoR I酶切;3.双酶切。Note: M.DL5000;1.BamH I Enzyme digestion results; 2.EcoR I Enzyme digestion results; 3.Double enzyme digestion results.
2.7 敲除载体p546KOV21的构建及菌液PCR筛选和酶切验证
将构建的中间载体和目标基因的下游片段同时用HindIII和KpnI进行酶切,然后用T4连接酶进行连接,将连接产物p546KOV21转化大肠杆菌DH5α,随机挑取白色菌落摇菌以546UP/F和546DOWN/R为引物进行菌液PCR验证,结果得到的条带大小与预期结果一致(图9)。进一步提取阳性菌落重组质粒DNA,利用HindIII和KpnI 进行酶切验证,酶切结果与预期结果相同(图10)。以上结果表明基因下游片段已成功连接到p546UPKOV21(图11)上,线性化后可用于后续的目标基因敲除转化实验。

注: M.DL10000;1~11.p546KOV21;12.阴性对照。Note: M.DL10000;1~11.p546KOV21;12.Negative control.

注: M.DL10000;1.Hind III酶切;2.Kpn I酶切;3.双酶切。Note: M.DL10000; 1.Hind III Enzyme digestion results; 2.Kpn I Enzyme digestion results; 3.Double enzyme digestion results.
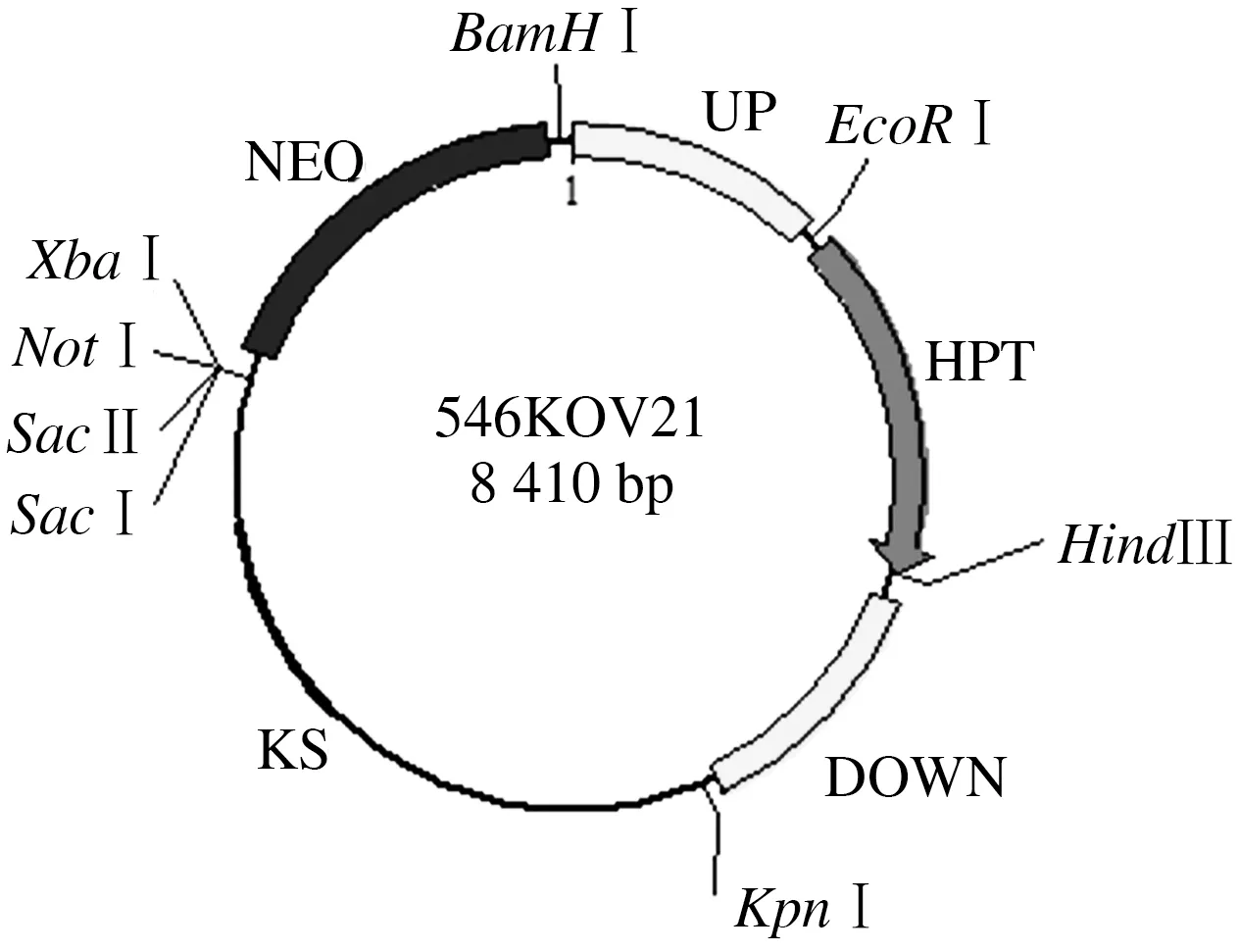
图11 基因敲除载体p546KOV21Fig.11 Gene replacement vector p546KOV21
3 结论与讨论
目前,种植抗病品种是防治植物病害的一种有效措施,但是生产上尚缺乏高抗棉花黄萎病品种[18]。由于田间棉花黄萎病菌是一个致病力高度分化的群体,且致病力容易变异,出现强致病力的类型,以及棉花品种抗病性的不稳定性,导致中国主要产棉区棉花黄萎病普遍发生[19]。深入研究黄萎病菌致病及微菌核形成的分子机理,鉴定出控制致病性的关键基因,有助于揭示其致病机制,为防治棉花黄萎病菌新型杀菌剂的设计和筛选提供候选靶标。
本研究对实验室构建的T-DNA插入转化体库进行筛选,获得了1个黄萎病菌突变体V546,该突变体致病力明显减弱且微菌核形成能力丧失。进一步研究发现,突变体T-DNA插入在大丽轮枝菌基因组基因VDAG_07282.1编码区,该基因编码一个未知功能的蛋白。本研究构建了该基因的敲除载体,为研究该基因的功能奠定了基础。在构建目标基因敲除载体时,质粒pKOV21同时带有新霉素抗性基因和潮霉素抗性基因,这样后续进行黄萎病菌转化时,可以以潮霉素作为阳性筛选标记,筛选出潮霉素阳性的转化子。对筛选的阳性转化子,进一步在新霉素抗性平板上筛选,排除假阳性的异位插入转化子,这样可以极大提高对目标基因敲除突变体筛选的效率[20]。
[1] 简桂良,卢美光,仇家山,等.棉花黄萎病防治策略[J].中国植保导刊,2004,24(4):30-31.
[2] 徐荣旗,汪佳妮,陈捷胤,等.棉花黄萎病菌 T-DNA 插入突变体表型特征和侧翼序列分析[J].中国农业科学,2010,43(3):489-496.
[3] 丁笑生,于广丽.棉花黄萎病及其抗病育种的研究[J].生物技术,2005,15(1):96-97.
[4] FRADIN E F,THOMMA B P .Physiology and molecular aspects of Verticillium wilt diseases caused byV.dahliaeandV.albo-atrum[J].Molecular Plant Pathology,2006,7(2):71-86.
[5] WANG J Y,CAI Y, GOU J Y,et al.VdNEP, an elicitor fromVerticilliumdahliae, induces cotton plant wilting[J].Applied and environmental microbiology,2004,70(8):4989-4995.
[6] KLOSTERMAN S J,SUBBARAO K V,KANG S,et al.Comparative genomics yields insights into niche adaptation of plant vascular wilt pathogens[J].PLoS Pathogens,2011,7(7):e1002137.
[7] TZIMA A K,PAPLOMATAS E J,RAUYAREE P,et al.Roles of the catalytic subunit of cAMP-dependent protein kinase A in virulence and development of the soilborne plant pathogenVerticilliumdahliae[J].Fungal Genetics and Biology,2010,47(1):406-415.
[8] TZIMA A K,PAPLOMATAS E J,RAUYAREE P,et al.VdSNF1, the sucrose nonfermenting protein kinase gene ofVerticilliumdahliae, is required for virulence and expression of genes involved in cell-wall degradation[J].Molecular plant-microbe interactions,2011,24(1):129-142.
[9] RAUYAREE P,OSPINA-GIRALDO M D,KANG S,et al.Mutations inVMK1, a mitogen-activated protein kinase gene, affect microsclerotia formation and pathogenicity inVerticilliumdahliae[J].Current genetics,2005,48(2):109-116.
[10]TIAN H,ZHOU L,GUO W,et al.Small GTPase Rac1 and its interaction partner Cla4 regulate polarized growth and pathogenicity inVerticilliumdahliae[J]. Fungal Genetics and Biology,2015,74:21-31.
[11]SANTHANAM P,THOMMA B P .VerticilliumdahliaeSge1 differentially regulates expression of candidate effector genes[J].Molecular Plant-Microbe Interactions,2013,26(2):249-256.
[12]ZHANG Y L,LI Z F,FENG Z L,et al.Isolation and functional analysis of the pathogenicity-related gene VdPR3 fromVerticilliumdahliaeon cotton[J].Current genetics,2015,61:1-12.
[13]TIAN L,XU J,ZHOU L,et al.VdMsb regulates virulence and microsclerotia production in the fungal plant pathogenVerticilliumdahliae[J].Gene,2014,550(2):238-244.
[14]谷素静,汪 敏,桑 茜,等.棉花黄萎病菌 T-DNA 插入突变体库的构建及致病缺陷突变体筛选[J].河南农业科学,2014,43(1):69-73.
[15]石磊岩,王 波,文 学.我国棉花黄萎病菌类型分化及培养特性研究[J].植物保护学报,1993,20(3):247-252.
[16]宋晓轩,朱荷琴,郭金城.安阳菌系致病力分化研究[J].中国农业科学,1997,30(1):13-18.
[17]LIU Y G,CHEN Y L.High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J].Biotechniques,2007,43: 649-656.
[18]宋学贞,杨国正.棉花抗黄萎病育种研究进展[J].中国农学通报,2013,29(21):16-22.
[19]林 玲,张 昕,邓 晟.棉花黄萎病研究进展[J].棉花学报,2014,26(3):260-267.
[20]LIANG L,LI J,CHENG L,et al.A high efficiency gene disruption strategy using a positive-negative split selection marker and electroporation forFusariumoxysporum[J].Microbiological research,2014,169(11):835-843.
(责任编辑:蒋国良)
Isolation of the pathogenicity-related gene fromVerticilliumdahliaeand construction of knockout vector in cotton
LI Xiaoping1, WANG Min1, ZHAO Yang1, DING Shengli1, LI Honglian1, MA Zongbin2
(1.College of Plant Protection, Henan Agricultural University,Zhengzhou 450002,China;2.Agronomy College of Henan Agricultural University, Zhengzhou 450002,China)
The pathogenicity ofV.dahliaeT-DNA transformants on the cotton variety Yinshan 1 seeding was tested by dipping roots withV.dahliaespore suspension,and a pathogenicity defective mutant V546 was obtained,indicating microsclerotia development defectively on PDA.The T-DNA insertional flanking sequence of mutant V546 was isolated by hiTAIL-PCR,which was integrated in theV.dahliaegeneVDAG_07282.1 coding sequence by genome sequence alignment.
verticillium wilt of cotton;Verticilliumdahliae; pathogenicity-related gene; flanking sequence; knockout vector
2015-05-10
国家自然科学基金项目(30700520);农业部公益性行业科技专项(201503109);河南省教育厅科学技术研究重点项目(14A210025);河南省棉花产业技术体系建设专项资金资助(S2013-07-G04)
李小萍(1988-),女,河南鹤壁人,硕士研究生,从事植物病原真菌生物学方面的研究。
汪 敏(1974-),男,河南新县人,副教授,博士。
1000-2340(2015)06-0787-07
S435.6
A

