12个白花泡桐种源的遗传多样性分析
李海英, 茹广欣, 侯 婷, 李翰书(. 河南农业大学, 河南 郑州450002; 2. 华北水利水电大学, 河南 郑州 4500)
12个白花泡桐种源的遗传多样性分析
李海英1,2, 茹广欣1, 侯 婷1, 李翰书1
(1. 河南农业大学, 河南 郑州450002; 2. 华北水利水电大学, 河南 郑州 450011)
采用AFLP分子标记对12个白花泡桐种源进行遗传多样性分析,筛选出8对引物组合,共扩增出980个多态性位点,平均每对引物扩增的总带数为122.5条,多态性条带百分率为97.32%,有效等位基因数为1.228 5~1.263 9,Nei基因多样性指数为0.164 6~0.189 1,Shannon信息指数变化为0.275 4~0.307 2。这些表明白花泡桐具有丰富的遗传性。经UPMGA聚类分析, 将12个白花泡桐种源分为3类,聚类结果与材料的地理来源有一定的相关性。
白花泡桐;种源;AFLP;遗传多样性
白花泡桐(Paulowniafortunei) 原产中国,隶属于玄参科(Scrophulariaceae)泡桐属(Paulownia),是泡桐属中一个优良速生树种,具有生长快、干形好、树体高大、抗病性强等特点[1]。白花泡桐的自然分布区在北纬20°~30°、东经100°~122°之间,长江流域以南分布广泛。由于悠久的栽培历史和分布区内多变的生态环境条件,白花泡桐的种内变异十分丰富。长期以来,由于生态环境的恶化以及人为砍伐,导致速生树种白花泡桐种质资源流失严重,部分种源分布区日益缩小,种源数量急剧下降,严重威胁着中国珍贵的白花泡桐资源的生存和发展,因此,对于白花泡桐种质资源的调查和收集,并进行遗传多样性的系统性研究迫在眉睫。为了充分利用其种内变异特性,研究各层次变异的规律性,马浩等[2]进行了白花泡桐种源、家系和个体的多水平试验和优良家系选择。苏金乐等[3]对白花泡桐不同种源叶片比较解剖学研究,探究其解剖构造的差异性及其与生态环境的关系。近年来,研究人员利用RAPD,RFLP,ISSR等分子标记对泡桐属植物的遗传多样性进行了研究[4-6],国外对于白花泡桐的研究也主要集中在生长特性和理化性质等方面[7-9]。AFLP分子标记技术多态性高,重复性好,可以提供大量的遗传变异信息, 是研究种源遗传多样性水平的有力工具[10-11]。本研究采用AFLP技术,以白花泡桐主要分布区的12个种源为试验材料进行遗传多样性分析,揭示其遗传变异规律,为白花泡桐种质资源保护及合理利用提供依据。
1 材料与方法
1.1 材料
供试材料来自中国5个省的12份白花泡桐种源,种源分布区位于23°24′~29°34′ N,106°72′~120°02′ E。材料见表1。
1.2 研究方法
1.2.1 12个白花泡桐种质基因组 DNA提取 采用改良CTAB法[10-11]提取,从硅胶干燥的幼叶中提取总DNA,提取的DNA用0.8%琼脂糖凝胶电泳和核酸测定仪检测其浓度和纯度,保存在-20 ℃备用。
1.2.2 PCR扩增 用筛选出的8对引物组合(表2)经荧光标记后进行选择性扩增(对Mse I引物的5’端进行荧光标记)。25 μL扩增体系中含有2 μL预扩稀释样品,2.5 μL 10×PCR buffer,0.5 μL dNTPs,Pst I和Mse I引物各1 μL,0.5 μL Taq酶,最后用ddH2O补足体系。将上述体系混匀,离心数秒后,按下列扩增程序进行选择性扩增,第1轮扩增参数:94 ℃扩增 30 s,64 ℃预变(以后每轮循环温度递减0.7 ℃)30 s,72 ℃延伸 80 s,扩增12轮;然后94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸80 s 再扩增23轮;最后72 ℃ 延伸5 min,4 ℃保存。
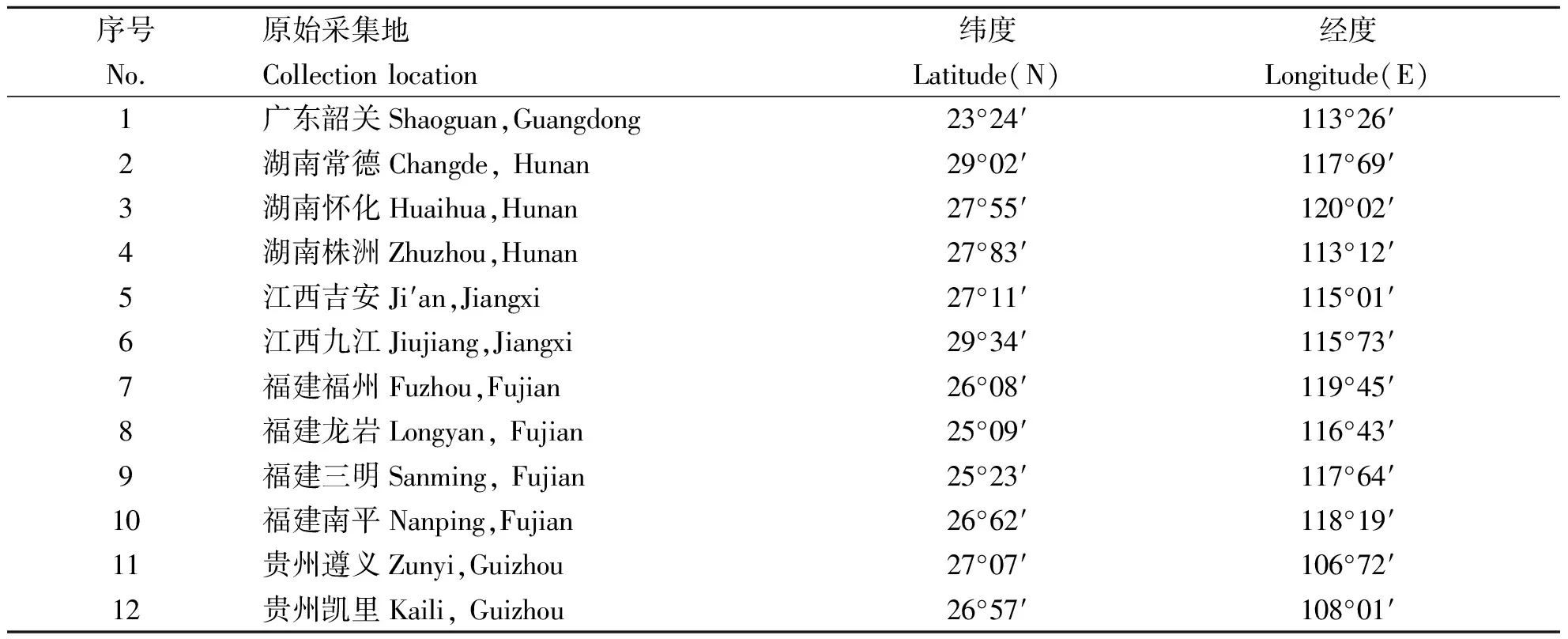
表1 白花泡桐供试材料Table 1 The tested P.fortunei in this study
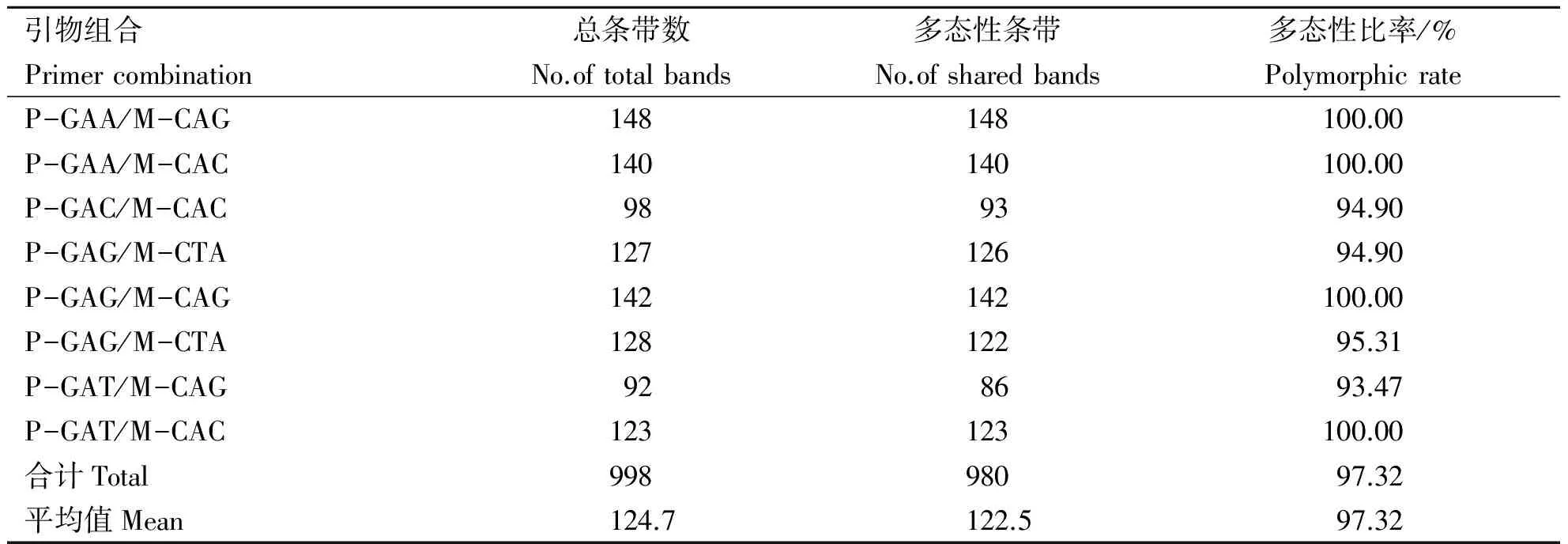
表2 不同引物组合在白花泡桐种源中的扩增多态性Table 2 The polymorphism of different primers combination in P.fortunei provenances
1.2.3 电泳与数据分析 扩增后的样品在ABI 377自动测序仪上电泳分离检测,得到AFLP的指纹图谱,通过GeneScan 3.1软件生成由“l”和“0”组成的原始矩阵。采用软件POPGENE 1.32对12个白花泡桐种源分别计算多态性条带(AP)、多态位点百分率(P)、观测等位基因数(Na)、有效等位基因数(Ne)、Nei基因多样性指数(H)和Shannon信息指数(I),种群水平的Nei′s遗传距离(D) 。运用NT-SYSpc2.10进行UPGMA聚类分析,构建系统发育树。
2 结果与分析
2.1 12种白花泡桐种质基因组DNA的AFLP 扩增片段多态性
试验采用8对AFLP选择性引物对12份白花泡桐种质基因组DNA进行了AFLP扩增分析,都得到了清晰的多态性指纹图谱。在白花泡桐12个种源共检测到大小为70~500 bp的多态性条带980条,平均每对引物扩增的总带数为122.5条,多态带比例为97.32%(表2),这表明12份白花泡桐种源具有高比例的多态性条带。其中P-GTG/M-CAG检测到的多态性条带最多,为148条,P-GAT/M-CAG检测到的最少,为86条,P-GAA/M-CAG, P-GAA/M-CAC ,P-GAG/M-CAG,P-GTG/M-CAC这4对引物效率最高,其产生位点的多态性条带比率达到100%,而引物P-GAT/M-CAG扩增出的条带的多态性比率最低,其多态性条带比率93.47%,表明8对引物组合具有较强的检测白花泡桐种源内及种源间遗传变异的能力。
衡量种群遗传多样性最常用的指标有多态位点比率(P)、观测等位基因数(Na)、有效等位基因数(Ne)、Nei基因多样性指数(H)和Shannon信息指数(I)。统计结果表明(表3),白花泡桐种源多态位点比率变化为77.42%~81.56%,平均为79.72%。平均有效等位基因数变化为1.228 5~1.263 9,平均为1.243 0。Nei基因多样性指数变化为0.164 6~0.189 1,平均为0.173 9。Shannon信息指数变化为0.275 4~0.307 2,平均为0.2908,而其种级水平分别达到1.245 3,0.181 8和0.314 9。分析结果说明,12个白花泡桐种源具有丰富的遗传多样性。此外,不同白花泡桐种源的遗传多样性也存在显著差异,其中湖南怀化和江西吉安的Nei基因多样性指数值和Shannon信息指数都较大,而来自贵州凯里及遵义种源的Nei基因多样性指数值和Shannon信息指数都较小。这些数据表明,白花泡桐的12个种源具有较为丰富的遗传多样性,其中来自湖南怀化、江西吉安和江西九江等遗传多样性水平较高,而来自贵州的种源多样性水平较低。
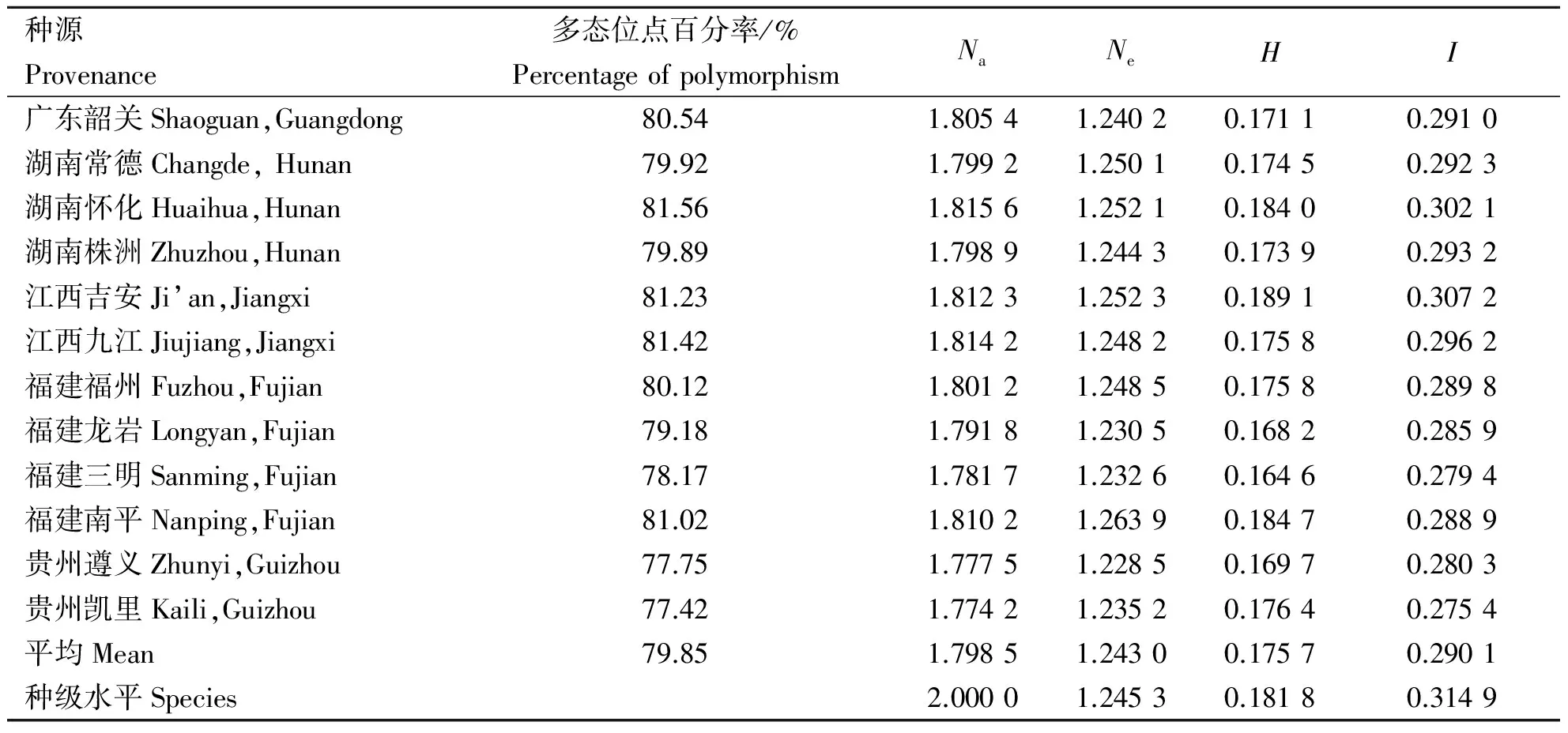
表3 白花泡桐种源遗传多样性Table 3 Genetic diversity of P.fortunei provenances
注:Na,等位基因数;Ne,有效等位基因数;H,Nei基因多样性指数;I,Shannon信息指数。
Note:Na,means observed number of alleles;Ne,means effective numner of alleles;H,means Nei’s gene diversity;I,means Shannon’s information index.
2.2 12种白花泡桐种源的遗传一致度和遗传距离分析
遗传一致度和遗传距离作为进一步分析种群间遗传分化程度的依据,从相同和相反的方向对遗传关系进行分析。本试验利用POPGENE 32软件,计算了种群间的Nei′s遗传距离和遗传一致度[12]。从表4可以看出,白花泡桐遗传一致度变化范围为0.985 2~0.994 5,遗传距离为0.006 1~0.014 8,遗传一致度最大的来自贵州遵义和贵州凯里的种群之间(0.994 5),其遗传距离最小(0.006 5),而湖南怀化和贵州遵义的遗传一致度最小(0.985 2),遗传距离最大(0.014 8)。
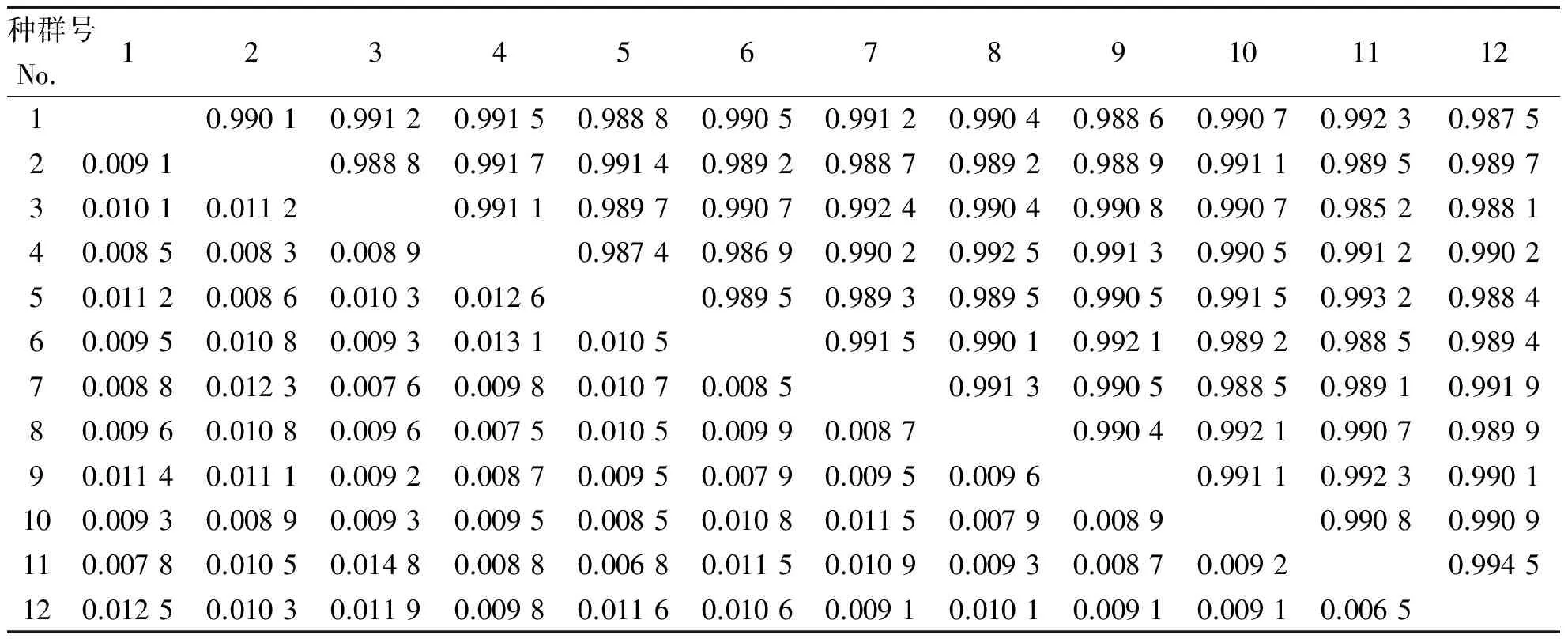
表4 白花泡桐种群的遗传一致度和遗传距离Table 4 Genetic identity and genetic distance of P.fortunei populations
注:表中对角线以上的数据为Nei′s遗传一致度,以下为遗传距离。
Note:Nei′s genetic identity(above diagonal )and genetic distance(below diagonal).
2.3 12种白花泡桐种源的聚类分析
采用NT-SYSpc 2.1软件,根据白花泡桐Nei′s遗传距离,对12个种源进行UPGMA聚类分析(图1)。从图1中可以看出,种源之间的遗传相似系数分布范围为0.46~0.66。12个白花泡桐种源分为3类:第1类包括10个种源,有湖南常德、广东韶关、贵州遵义、贵州凯里、福建福州、福建南平、福建三明、福建龙岩、江西九江;第2类包括湖南怀化1个种源;第3类为1个江西吉安种源。聚类图显示,地理来源相近的种源基本聚在一起,通过Mantel相关性检验,地理距离和遗传距离之间呈正相关,但相关性不显著(r=0.210 5 ,P= 0.062 1)。
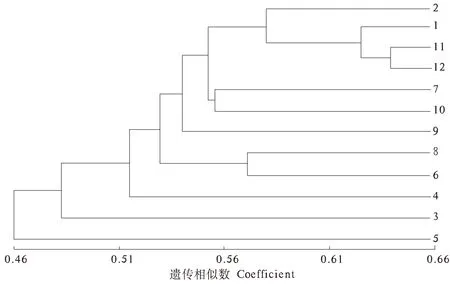
图1 12种白花泡桐种源聚类图Fig.1 Dendrogram of 12 kinds of P. fortunei provenances
3 结论与讨论
白花泡桐是泡桐中的原始种,但当其在地球上出现以后,泡桐属内很快变得复杂起来,成为当今许多杂交种的直接或间接亲本。本研究对白花泡桐的12个种源进行遗传多样性分析,8对AFLP引物共扩增出多态性条带980条,多态带比率为97.32%,多态位点百分率变化为77.42%~51.56%,平均有效等位基因数变化为1.228 5~1.263 9, Nei基因多样性指数变化为0.156 6~0.188 7,Shannon信息指数变化为0.269 2~0.311 7。李芳东等[13]采用ISSR技术筛选出9条引物对38个白花泡桐种源进行扩增分析,白花泡桐不同引物的多态位点为73.73%~100.00%,物种水平的多态位点比率为92.63%,Shannon信息指为0.376,Nei指数为0.242 4,都反映白花泡桐物种水平遗传多样性高。与他们的结果相比,本研究采用AFLP技术扩增条带多,多态性位点的比率高,说明AFLP技术可以有效地检测白花泡桐种源的遗传多样性水平。这表明AFLP一种检测效率很高的分子标记技术。
遗传多样性是物种或居群长期进化的产物,也是其生存、适应和发展、进化的前提[14]。植物的遗传多样性水平与泡桐的进化历史有关。从有关泡桐古植物的资料来看, 泡桐在第四纪以前分布区十分广泛,可能是由于在第四纪冰期来临期间泡桐被迫退却或在间冰期向北扩展,为了适应各种复杂环境的结果,泡桐保留了其丰富的遗传基础。
[1] 蒋建平.泡桐栽培学[M].北京:中国林业出版社,1990:17-43.
[2] 马 浩,李荣幸,李培健,等.白花泡桐种内多层次变异及其选择效果分析[J].河南农业大学学报,1996, 30(1):1-8.
[3] 苏金乐,程绍荣,孙启水.白花泡桐不同种群叶片比较解剖学研究[J].河南农业大学学报,1993,27(1):52-56.
[4] 马 浩,张冬梅,李荣幸,等.泡桐属植物种类的RFLP分析[J].植物研究,2001,21(1):136-139.
[5] 莫文娟,傅建敏,乔 杰,等.泡桐属植物亲缘关系的ISSR分析[J].林业科学,2013,49(1) :61-67.
[6] 李翰书,卢妍妍,李海英,等.泡桐属植物遗传多样性的FISH-AFLP分析[J].河南农业大学学报,2014,48(2):52-56.
[7] AYOUB S,TAGHI T,ABOLGHASEM K, et al. Effect of nanoclay on some applied properties of oriented strand board (OSB) made from underutilized low qualityPaulownia(Paulowniafortunei) wood[J].Journal of Wood Science,2012,58(6):513-524.
[8] AKHTARI M, TAGHIYARI H R, KOKANDEH M, et al. Effect of some metal nanoparticles on the spectroscopy analysis ofPaulowniawood exposed to white-rot fungus [J].European Journal of Wood and Products,2013,71(2):283-285.
[9] ESTEBAN L B,MANUEL W B, CONSUELO, et al. Microbial activity in soils under fast-growingPaulownia(Paulowniaelongata×P.fortunei) plantations in Mediterranean areas [J].Applied soil Ecology,2011, 51: 42-51.
[10] 茹广欣,袁金玲,张 朵,等.运用AFLP技术分析筇竹种群遗传多样性[J]. 林业科学研究,2010,23(6):850-855.
[11] 王玉山,邢世岩,唐海霞,等.侧柏种源遗传多样性分析[J].林业科学, 2011,47(7):91-96.
[12] 陈 锋,何中虎, LILLEMO M, 等.CIMMYT普通小麦子粒硬度等位变异的检测[J].作物学报,2005, 31(10):1277-1283.
[13] NEI M.Molecular population genetics and evolution[M]. New York: Amsterdam and North Holland,1973.
[14] 李芳东,袁德义,莫文娟,等.白花泡桐种群遗传多样性的ISSR分析[J].中南林业大学学报,2011,31(7) :1-7.
[15] SOLTIS P S,SOLTIS D E.Genetic variation in endemic and widespread plant species: examples fromSaxiftagaceaeandPolystichum(Dry 2 opteridaceae)[J]. Aliso, 1991,13:215-223.
(责任编辑:常思敏)
Genetic diversity analysis of 12 kinds ofPaulowniafortuneiprovenances
LI Haiying1,2, RU Guangxin1, HOU Ting1, LI Hanshu1
(1. Henan Agricultural University ,Zhengzhou 450002,China; 2. North China University of Water Resources and Electric Power, Zhengzhou 450011,China)
Using AFLP molecular markers,the genetic diversity and relationships of 12Paulowniafortuneiprovenances were studied. 8 pairs were screened from 64 primer combinations,obtaining 980 polymorphic locis. On the average each pair of primers amplification produced 122.5 locis. The percentage of polymorphic bands was 97.32%. The effective number of alleles was 1.2285 to 1.2639. Nei′s genetic diversity and Shannon′s information diversity index ranged from 0.1646 to 0.1891 and from 0.2754 to 0.3072, indicating a rich genetic diversity amongPaulowniafortuneiprovenances. Cluster analysis (UPMGA) results showed that 12Paulowniafortuneiprovenances were divided into 3 groups. The clustering results and the material source of geography had certain relevance.
Paulowniafortunei; provenances; AFLP; genetic diversity
2015-06-10
国家科技支撑计划专题(2013BAD01B06) ;郑州市科技领军人才计划(10LRC177)
李海英(1974-),女,河南滑县人,博士研究生,从事林木遗传育种方向研究。
茹广欣(1963-),男,河南洛阳人,教授,博士生导师。
1000-2340(2015)06-0764-05
S 792.43
A

