植物核质运输与其先天免疫研究进展
郭晓雨,刘 俊,汪 天
(1安徽农业大学园艺学院,合肥230036;2中国科学院微生物研究所植物基因组学国家重点实验室,北京100101)
植物核质运输与其先天免疫研究进展
郭晓雨1,2,刘 俊2,汪 天1*
(1安徽农业大学园艺学院,合肥230036;2中国科学院微生物研究所植物基因组学国家重点实验室,北京100101)
植物为了抵御病原菌的侵染而进化出一套独特的先天免疫系统,它主要通过定位在细胞膜或细胞质上的受体介导并激活下游抗病基因表达而实现,但在这些信号传递过程中,细胞质的信号向核传递需要核质运输相关元件的参与。虽然目前只有个别核质运输的信号元件被证实参与了植物的先天免疫信号传递过程,但越来越多的研究表明核质运输是连接抗病基因表达和信号识别受体的一个主要方式。研究发现,病原菌的效应因子也可以利用植物核质运输机制侵入到宿主细胞核内,调控敏感基因的表达,干扰植物的免疫反应。该文对近年来国内外有关植物的核质运输机制、各层次免疫反应需要核质运输作用、核质运输相关蛋白在免疫反应中的作用等方面对核质运输参与植物先天免疫反应研究的研究进展进行综述,并指出该领域未来研究的主要内容和方向。
核质运输;植物免疫;信号传递;抗病性
植物在与各种致病微生物斗争中进化出的先天免疫系统,可以在两个层面上激活植物的抗病防御反应。第一层防御是植物通过识别病原菌相关分子模式物质(pathogen-associated molecular patterns,PAMPs)而做出的反应,称之为PTI(PAMPs-triggered immunity)。PAMPs是众多病菌结构组成相对保守的部分,例如细菌的鞭毛蛋白flagella[1]、伸长因子EF-TU[2]等,它们在大部分细菌中的组成成分和结构都是相似的。植物细胞表面的模式识别受体(pattern recognition receptors,PRRs)可以特异性地识别PAMPs,从而激活植物体内相应的免疫反应[3]。但是病菌进化出了一些致病性的蛋白——效应因子(effectors),这些效应因子通过一些特定的分泌途径进入寄主细胞内,特异性地干扰寄主的PTI过程。而抗性的宿主植物也进化出了存在于胞内的NB-LRR类的免疫受体,特异性地识别病原菌分泌到细胞中的效应因子,从而激活较PTI更为强烈的免疫反应,称为ETI(effectors-triggered immunity)[4],这是第二层免疫反应。由NB-LRR类抗病基因介导的反应是快速有效的,通常会引起细胞程序性死亡(programmed cell death,PCD),也被称为超敏反应(hypersensitive response,HR)[5],以阻止病原菌的扩散。此外,超敏反应能够激发植物产生系统获得性抗性(systemic acquired resistance,SAR),使没有被病原菌侵染的叶片也可获得相应的抗性。
近年来对植物与病原菌之间相互作用关系的研究表明,植物细胞中的多个细胞器都参与了植物对病原菌的感应以及抗病反应的信号传导过程。细胞核和细胞质之间的物质运输在植物免疫反应中起到重要的作用。在免疫反应中,只有将胞质内识别病菌侵染的信号传递到细胞核中,才能激发其抗性基因的表达,达到抵御病菌的目的。细胞内外的信号是否能够被准确地传递到核内,直接影响到寄主能否对病原菌所引起的伤害做出迅速而有力的回应。此外,这种信号机制的激活需要严格的调控,才能保证在激活抗病反应的同时不损害寄主原有的生命活动。例如,与SAR相关的重要植物激素水杨酸(salicylic acid,SA)只有调控其调节因子向核内转运,才能激发相关抗病基因的表达[6];某些NB-LRR蛋白受病原菌效应因子激发或是与效应因子结合,才能向核内运输,进而激发下游抗病反应。此外,在对抗病基因SNC1的抑制子筛选中也发现一些与核质运输结构相关的基因,这些基因的缺失影响了植物对病原菌的抗病能力[7]。这也从另一方面证明了植物的免疫反应与核质运输机制有着紧密的联系,且相关信号分子的跨膜运输对于某些免疫通路是必须的。植物抗病信号的传递与核质运输的关系是近年来生命科学领域研究的一个重大发现,不仅在植物抗病研究中具有重要的意义,也同时促进了其他相关领域的研究。本文从植物和微生物分子互作的角度来阐述近约十年来该领域所取得的巨大成就,同时也对核质运输的基本机制做出概述。
1 大分子物质的核质运输机制
在真核细胞内,细胞核与细胞质被核膜分割开来,但两者却不是完全隔离的,核与质之间存在着物质和能量的交流。mRNA就是在细胞核内由DNA转录生成,然后穿越核膜进入细胞质,最后在细胞质内翻译成蛋白质。除了mRNA的出核运输外,还有很多转录因子、转录调节因子、相关功能蛋白和大分子复合物等物质单向地入核或出核,或是进行核质间的双向流通。这些物质的流通都依赖于核孔复合物(nuclear pore complexes,NPCs)结构[8]。核孔复合物嵌入在核膜中,它们可以跨越核膜的双层膜系统,由一些伸展在细胞质内的胞质纤维丝(cytoplasmic filaments)、一个中心核(central core)和位于细胞核内的核篮子(nuclear basket)三部分组成[8]。核孔复合物为蛋白质及其他高分子物质在核质之间运输提供一个通道[9-10]。但核孔复合物并不是被动地让物质通过,它们更像是一个屏障。小分子可以自由地通过核孔,但分子量大于30kD的蛋白,就必须结合核运输受体(nuclear transport receptors,NTRs)才能通过[11]。所以当细胞需要在核质间运输某些大分子物质时,靶标货物分子(cargo)会被接头蛋白(adapter proteins)针对性地识别。在货物蛋白被识别后,核运输受体就携带它们经由核孔复合物运输到核内[12]。这一运输方式可以确保货物被准确高效地送到目的地,减少了非相关物质的干扰,也有利于控制核输入物质和输出物质的比例,确保核质间物质的平衡。
参与核质运输的重要蛋白Ran是小G蛋白(small G proteins)家族的一类亚家族,主要负责蛋白质和RNA的核孔运输过程。小G蛋白可以被GTP激活成为活化态,随后在自身水解活性或其附属蛋白——GTPase激活蛋白(GTPase-activating proteins,RanGAPs)的水解作用下将GTP水解为GDP,从而转变为非活化态形式,然后等待被GTP再次激活,进行再次循环[13]。细胞核内针对Ran的鸟嘌呤核苷酸转换因子(ran-specific guanine nucleotide exchange factor,RanGEF)可以催化GDP转化为GTP[14]。因此RanGTP在细胞核内有较高的含量,并能够与核运输受体以及货物靶标三者形成复合物出核。在细胞质中的RAN结合蛋白(ran-binding proteins,RanBPs)与RAN激活蛋白的共同作用下,RanGTP被水解为RanGDP。同时,细胞质中的RanGDP与其核输入载体蛋白——核运输因子2(nuclear transport factor 2,NTF2)——结合形成二聚物然后一同进核[15,16],完成RanGTP/RanGDP的循环利用。目前植物中研究较多的Ran蛋白是水稻中的OsRAN1和OsRAN2,它们都与植物的发育及细胞分化周期相关,并参与植物激素的信号转导[17,18]。
核输入载体蛋白(importin)和核输出载体蛋白(exportin)是两种核运输受体。随着RanGTP与RanGDP的循环转化,这些载体蛋白分别携带着货物进行入核与出核的运输过程。核输入载体蛋白结合到货物的核定位信号区域将其送入核中,而核输出载体蛋白则是结合货物的核外排信号将其运输到细胞质中。输入蛋白β(importin-β)可以与货物直接作用,或是在接头蛋白的帮助下携带蛋白入核。输入蛋白α(importin-α)就是常见的接头蛋白,它可以与输入蛋白β以及靶标货物形成三聚复合物向核内运输。输入蛋白携带货物通过核孔复合物进入细胞核。核内的RanGTP与输入载体蛋白有更高的亲和性,从而迫使输入载体蛋白与目标货物分离,达到将货物运送到细胞核的目的[19,20](图1)。在细胞核内,输出蛋白、货物和RanGTP三者形成复合物,通过核孔进入到细胞质内。在存在于细胞质中的Ran结合蛋白1和Ran激活蛋白1的共同作用下,复合物中的RanGTP被水解为RanGDP,使得货物与载体蛋白分离,完成货物的核输出过程(图1)。此外,还有一些核运输受体既参与了入核运输也参与了出核运输过程,是核运输的双向受体。如Importin 13/RanBP13既能作为核输入载体帮助SUMO结合酶hUBC9进核,也能作为核输出载体帮助翻译因子(translation factor)eIF1A进核[21]。Exportin 4是运输翻译起始因子(translation initiation factor)eIF-5A出核的输出蛋白,但在动物体内它又可以作为与疾病相关的转录因子SOX2和SRY的核输入受体蛋白[22,23]。这种利用载体蛋白跨膜运输大分子的机制也广泛地存在于高等生物的免疫反应中。某些重要的免疫调节蛋白通过结合载体蛋白来完成出核或者入核的过程,从而完成免疫信号的传导。此外,参与核质运输的核孔蛋白NUP88、NUP96、NUP160以及核输入载体蛋白-α等都被证实在植物的免疫反应中起到了重要的作用。
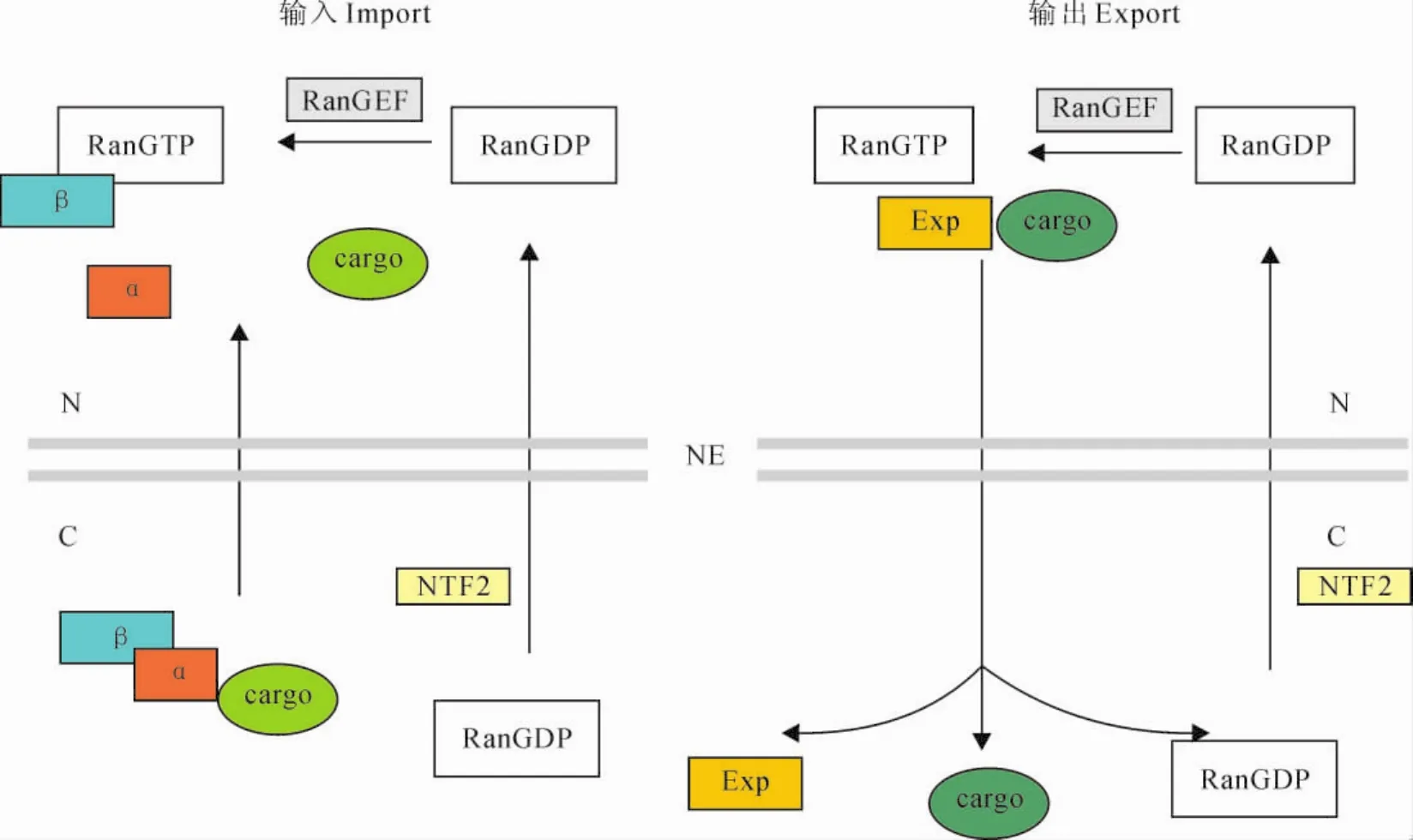
图1 大分子物质的跨膜运输机制α.核输入载体蛋白α;β.核输入载体蛋白β;Exp.核输出载体蛋白;N.细胞核;C.细胞质;NE.核膜Fig.1 The nucelocytoplasmic transport mechanism of macromolecules α.Importin-α;β.Importin-β;Exp.Exportin;N.Nuclear;C.Cytoplasm;NE.Nuclear envelope.
2 核质运输与植物先天免疫之间的关系
2.1 植物激素相关的免疫反应需要核质运输
众所周知,水杨酸、茉莉酸和乙烯是植物体内参与抗病反应的重要植物激素,其中水杨酸参与的植物系统获得性抗性与核质运输有着密切的关系。植物系统获得性抗性是植物体内能对不同的病原菌(病毒、细菌、卵菌和真菌等)产生的一种广谱的抗性反应,主要表现为使植物局部组织坏死,并能在未受侵染的植物组织中产生持续性的抗性。这种抗性反应可以持续几个星期到几个月,甚至植物的整个生命周期。植物系统获得性抗性会影响植物体内水杨酸的积累[24],并通过调节蛋白NPR1(non-expresser of PR genes 1)的活性来控制抗性基因PR(pathogenesis-related)的表达[6]。在通常情况下,NPR1定位在细胞质中,并以寡聚物的形式存在;当水杨酸含量增加时,NPR1在水杨酸诱导下还原解离为单分子结构并被转运到核中。大量的单分子NPR1在核中积累,激活了与水杨酸相关的抗病基因的表达[25]。同时,NPR1相关的信号传导也会受胞质内过氧化氢(H2O2)含量的影响。植物在应对病原菌入侵时,细胞质内会产生大量的过氧化氢。过氧化氢的强氧化性会限制胞质内的NPR1还原为单分子,这样NPR1就无法进核,也就无法激活下游抗性基因的表达[26]。总的来说,NPR1在核中的定位对于激活下游抗病基因PR的表达以及激活水杨酸介导的抗病反应都是必须的。
在细胞核中,NPR1结合含有亮氨酸拉链(leucine zipper)结构的转录因子(如TGA家族)[27],同时被激酶磷酸化。被磷酸化的NPR1最后被泛素化降解。细胞核内的单分子NPR1最终都会被降解,但只有被磷酸化的NPR1的降解才能激活抗性反应[28]。NPR3和NPR4是新发现的水杨酸途径中的受体,它们与水杨酸有不同程度的亲和性。NPR3和NPR4是泛素连接酶的适配子,参与调节NPR1的泛素化降解过程,同时它们与NPR1之间的互作也是受水杨酸调控的[29]。除此之外,水杨酸也与一些参与免疫反应的核质蛋白有关。例如,水杨酸会影响RNA结合蛋白AtGRP7(Arabidopsis thaliana glycine-rich RNA-binding protein 7)在免疫反应中的作用,而AtGRP7是一种核质蛋白,它参与调节包括抗逆反应、激素调节在内的许多信号通路中的转录活动,特别是在免疫反应中影响PR1的转录活性[30]。
2.2 R基因调控的免疫反应需要核质运输
植物对病菌分泌的效应蛋白的识别主要依赖于结构上相对保守的NB-LRR蛋白,又称R蛋白。植物中这些R蛋白可以特异性地识别病原菌分泌的效应蛋白,引起ETI防御反应。R蛋白在结构上是相对保守的,其C端由富含亮氨酸重复的结构域(leucine-rich repeat,LRR)组成,主要负责对配体蛋白的识别。中间部分的结构组分为核苷酸结合结构域(Nucleotide-binding domain,NB),可以结合并水解ATP产生蛋白构象变化所需的能量;R蛋白的N端主要是TIR(toll and interleukin 1receptor)结构域或CC(coiled coil)结构域组成,其二聚体或多聚体的形成可以激活抗病反应[31]。因此,R蛋白根据N端组成的不同,分为TIR-NB-LRR和CC-NBLRR两个亚家族。这些R蛋白在病原菌的识别、活性的激发、亚细胞的定位以及信号的传递等方面都有很大差异,因此它们才能更好地识别并抵御各种各样的病原菌入侵[32]。目前的研究显示,一些胞质定位的R蛋白在病菌信号识别后重新定位于细胞核中。N[33]、MILDEWA 10(MLA 10)[34]、RESISTANCE to PSEUDOMONAS SYRINGAE 4(RPS4)[35]和SUPPRESSOR of npr1-1CONSTITUTIVE1(SNC1)[9]都是这种类型的R蛋白。这些R蛋白在核质中的相对定位及其相对丰度的不同,决定了植物体内被激活的下游防御反应也各不相同。
2.2.1 与SNC1相关的植物免疫反应 SNC1是在对npr1的抑制子筛选中被发现的。在SNC1突变体植株snc1中,抗病基因PR1组成型表达,激发起持续性的抗病反应,突变体snc1也因此表现出矮小的表型[32,36]。Mang等研究发现,高温会诱使SNC1蛋白出核,使其定位在细胞膜上;但在ABA缺失情况下,这种高温引发的出核现象被抑制了[33]。在高温情况下,ABA缺失时,SNC1在核中的积累增加,增强了植物的抗病性。因此,SNC1在核中的积累对它所介导的抗病反应是必须的。尽管SNC1介导的免疫反应的具体信号传导途径尚不清楚,但是目前已发现SNC1相关的免疫信号传递与核质运输相关。在对SNC1的抑制子筛选中,得到了MOS3、MOS7和MOS6等基因,这些基因分别编码与人类核孔蛋白NUP96、NUP88同源的蛋白,以及核输入载体蛋白Impα-3。这3种蛋白都是核质运输机制中非常重要的蛋白。由此推测,SNC1不仅通过核质间积累量的变化来调节免疫反应,而且它所介导的免疫反应也要受到一些核运输载体蛋白和核孔蛋白的影响。
2.2.2 RPS4介导的免疫反应 RPS4是TIR-NBLRR型R基因,能够特异性地识别丁香假单胞菌Pseudomonas.syringae pv.tomato DC3000分泌的效应因子AvrRps4[34]。RPS4与SNC1功能的发挥会受一些相同蛋白的调节,它们所介导的信号转导途径中可能存在交叉互作的部分。其中一个重要的RPS4信号抑制子蛋白SRFR1(SUPPRESSOR OF rps4-RLD1)可以在细胞质中与SNC1和RPS4分别形成复合物,并参与对病原菌效应因子AvrRps4的响应。同时,SRFR1也可以对SNC1和RPS4的转录起到抑制作用,维持胞内SNC1和RPS4的含量,避免自身免疫反应产生[35]。另外一个RPS4激活信号途径中的重要组分EDS1(enhanced disease susceptibility 1)是TIR-NB-LRR型R基因介导的免疫反应中的正调控子。它可以与一些TIR-NBLRR型R蛋白形成复合物,也能与免疫负调控子SRFR1在细胞质膜上形成复合物,是免疫反应中非常重要的调节因子[37]。在RPS4介导的抗性反应中,EDS1起到信号传感器的作用,是引起下游抗病基因表达必不可少的组分。同时,RPS4-EDS1复合体在核中的积累对于它们介导的防御反应都是必须的[3839]。效应因子AvrRps4被分泌进入植物后,植物体内的RPS4-EDS1复合体会被激活,活跃在细胞核和细胞质内。细胞质内的复合物RPS4-EDS1负责触发细胞死亡,而细胞核内的RPS4-EDS1负责激活下游基因的表达。EDS1起到帮助RPS4识别AvrRPS4并激活下游免疫反应的作用。虽然目前没有明确的证据显示EDS1在RPS4的核质运输中起作用,但可以推测的是RPS4与EDS1都存在核质运输的过程,且这个运输过程对于激活防御反应是必不可少的[40]。
2.2.3 RRS1相关的免疫反应 RRS1是一种特殊的R基因,除了TIR-NB-LRR结构外,在它的C端还有一个属于WRKY家族的DNA结合结构域。它在抗病中的作用依赖于水杨酸和NDR1(nonracespecific disease resistance 1)[41]。最近的研究发现,青枯病菌(Ralstonia solanacearum)分泌的效应因子PopP2能与RRS1互作并定位在宿主的细胞核内。在PopP2存在时,RRS1发生从定位于细胞质到定位于细胞核的转变[42]。同时,RRS1-R介导的抗性反应也需要半胱氨酸蛋白酶RD19。RD19通常定位在囊泡中,当PopP2存在时RD19就特异性地与PopP2共定位在核中[43]。此外,RRS1与RPS4在应对病原菌入侵时具有协同作用,两者在对抗青枯病致病菌(R.solanacearum)、丁香假单胞菌番茄变种菌株DC3000(P.syringae pv.tomato DC3000)(avrRps4)和希金斯刺盘孢(Colletotrichum higginsianum)时都是不可缺少的。它们可能以二聚体复合物的形式参与对相应效应蛋白的识别[44]。Sohn研究发现RRS1与RPS4对于识别效应因子PopP2是缺一不可的,同时RPS4在核中的积累对于RRS1引起的HR反应也是必须的[45]。
2.2.4 与MLA10相关的防御反应 MLA10是小麦中的CC-NB-LRR型R基因,它存在于植物细胞的细胞质和细胞核中,可以特异性识别小麦白粉菌(Blumeria graminis)分泌的效应因子AVRA10。同其它可定位在核中的R蛋白一样,MLA10在核中的积累对抗病反应也是必须的。一旦MLA10蛋白不能在核中积累,植株就会表现出对小麦白粉菌的抗性减弱。这是因为识别该菌分泌的效应因子AVRA10的信号不能被有效地传递到核内,从而不能激活下游抗病基因的表达。MLA10的CC结构域可以与转录因子HvWRKY1/2互作,转录因子HvWRKY1/2在植物体内主要起到转录抑制的作用[46]。利用病毒诱导的基因沉默技术(virus-induced gene silencing,VIGS)将大麦中的HvWRKY1和HvWRKY2基因沉默,沉默后的植株在注菌后表现出较对照更强的抗病性,而HvWRKY1和HvWRKY2的过表达植株表现出对病原菌的抗性减弱。这些结果表明MAL10可以通过与HvWRKY1/2的相互作用参与抗病基因的表达调控[46]。
深入研究发现,在病原菌入侵后,MLA10感知到效应因子AVRA10,然后从细胞质转运到细胞核中,与转录因子HvWRKY1/2结合,减弱了转录因子HvWRKY1/2对相关基因的抑制作用[46]。Chang等的研究发现转录因子MYB6正调控MLA10相关的抗病基因的表达,但WRKY1抑制了MYB6的活性[47]。MLA10通过将MYB6从被WRKY1抑制的作用中释放出来,从而实现下游抗病基因的表达,产生对病原菌的免疫反应。进一步研究发现,细胞质中MLA10的积累引发了细胞的超敏死亡,而细胞核中的MLA10则参与调节抗病基因的表达[48]。由于MLA10的CC结构域对于引起细胞死亡是至关重要的,所以将CC结构域中第18位点的亮氨酸突变为谷氨酸后,植物在应对病原菌入侵时所产生细胞死亡现象就会减弱。但同时,突变后的MLA10仍然能在核中定位,所以植物的抗病反应不受影响。由此说明,MLA10在细胞质与细胞核中的积累与分布决定了不同的抗病信号途径的激活。因此,当病原菌入侵植物时,根据侵染程度的不同,植物可以通过核质运输来调节核质间MLA10的相对丰度,从而利用不同的方式来抵御病原菌的入侵。
2.3 病菌效应因子入侵宿主细胞核
一些细菌和卵菌分泌的效应因子可以进入到宿主的细胞核中,比如卵菌(Phytopthora infestans)分泌的效应因子Nuk6和Nuk7。它们依赖于α-核输入载体蛋白来达成侵入宿主细胞核的目的[49]。这些带有核定位信号的效应因子控制了宿主细胞核质间的信号传递,它们伪装成核质运输过程中的靶标蛋白,进入到宿主的细胞核内。其中部分效应因子还可以与宿主细胞中某些敏感基因(susceptibility genes)的启动子结合,影响这些基因的转录表达[50]。这种类型的效应因子被称作类转录激活子型效应因子(transcriptional activator-like effectors,TALEs),在黄单胞菌属(Xanthomonas)的细菌中最为常见。TAL型效应因子由三部分组成,N端是参与分泌的结构域(secretion and translocation domain);中间是DNA结合结构域(DNA binding domain);C端是转录激活结构域(transcription activation domain),其中包括效应因子进核时的核定位信号[51]。TAL型效应因子可以促进包括糖运输基因在内的许多寄主敏感基因的表达[52],从而在宿主细胞外建立一个更适宜自身生长与繁衍的环境,且更有利于病原菌对抗宿主的先天免疫反应。
AvrBs3是目前研究较为清楚的一个TAL型效应因子。AvrBs3是野油菜黄单胞菌(Xanthomonas campestris pv.vesicatoria)分泌的效应因子,在辣椒中能被抗性基因Bs3识别,继而产生超敏反应[53]。Boris等研究发现,AvrBs3C端的转录激活结构域对于Bs3识别AvrBs3后产生的超敏反应是必须的。利用AvrBs3对酵母中的辣椒cDNA文库进行筛选发现,AvrBs3可以与辣椒的两种α-核输入载体蛋白Caimpa1和Caimpa2进行互作,且AvrBs3中与这两种载体蛋白互作的是其C端的核定位信号部分[54]。由此说明,AvrBs3也是通过与核输入载体结合而被携带进核的,符合植物细胞核质运输的机制。至于AvrBs3作为效应因子,是怎样躲避宿主细胞识别,顺利与核输入载体蛋白结合而被携带进核的,目前仍不清楚。除AvrBs3之外,还有很多已知的TAL型的效应因子,如白叶枯菌(Xanthomonas oryzae pv.oryzae)分泌的AvrXa7、PthXo1、PthXo2和PthXo3以及柑橘溃疡病菌(Xanthomonas citri)分泌的PthA和PthB等[51]。
2.4 核质运输相关蛋白参与的先天免疫反应
核质运输机制中的相关蛋白也参与了植物的先天免疫。比如,参与核质运输的重要蛋白MOS3(modifier of snc1,3)[7]、MOS6[55]和MOS7[56]都是R基因SNC1的抑制子。MOS3、MOS7编码的蛋白分别与人类的核孔蛋白NUP96和NUP88同源;MOS6在拟南芥中编码1个α型核输入载体蛋白Imp-α3。遗传学结果显示,MOS6基因的突变能够部分抑制突变体snc1中的自免疫反应(autoimmune)。mos6 snc1双突变体的表型介于突变体snc1与野生型Col-0之间,且双突变体中抗病响应基因PR1和PR2的表达量相较于突变体植株snc1都降低。此外,突变体植株mos6体内水杨酸含量相较于突变体snc1也降低,说明MOS6对于SNC1介导的抗病反应是必须的[55]。突变体mos6对卵菌病原菌(Peronospora parasitica Noco2)也表现出更易感的表型,暗示了MOS6很有可能是SNC1特异性的响应卵菌病原菌而做出的免疫信号传导中重要的组成部分[55]。
值得关注的是,MOS6作为核输入载体蛋白,目前仍不清楚它主要运输的货物是哪些。由于SNC1是NPR1的抑制子,而MOS6是SNC1的抑制子,也许可以推测NPR1就是MOS6核输入的目标货物,但SNC1能否与MOS6结合还有待考证。Wirthmueller等利用卵菌的效应因子HaRxL106作为探针研究核输入蛋白α的功能时发现:植物中“货物—输入蛋白α”复合物的形成与货物同输入蛋白α的亲和性、输入蛋白α中NLS相结合位点序列的多样性和输入蛋白α的组织针对性的表达都有关[57]。Thirumala-Devi等将本氏烟草中的Importin-α1和α2沉默之后,抑制了致病疫霉(P.infestans)分泌的效应因子Nuk6和Nuk7入核,但对效应因子Nuk12的核输入没有影响[49],说明输入蛋白α在植物的先天免疫过程中会针对性地结合货物分子。某些病原菌分泌的效应因子,如AvrXa10、AvrBs3以及其它一些TAL型效应因子能成功入侵宿主细胞核内并稳定的存在,可能是因为这些效应因子与输入蛋白α有更强的亲和性或是它们模仿了核运输机制,所以没有引起抗病反应[58-59]。
与MOS3相关的遗传学研究发现,双突变体snc1mos3相较于突变体snc1,其体内水杨酸含量增加的趋势受到抑制并且植株抗性降低[7]。突变体植株mos3对致病菌株Pseudomonas syringae mac-ulicola(P.s.m.)ES4326、Peronospora parasitica Emoy2、 P.syringae pv.tomato DC3000(avrRps4)和P.s.m.ES4326(avrB)都表现出比野生型更易感的表型。由此看来,MOS3应该与基础抗性反应以及R基因介导的抗性反应都是相关的。MOS3编码拟南芥的核孔蛋白AtNup96,与人类核孔蛋白NUP96基因序列有很高的相似性[7]。Zhang等推测,MOS3有可能与某个免疫反应正调控子的RNA的核输出相关,所以,在突变了MOS3之后,这个正调控子的翻译受到了影响,进而抑制了突变体snc1的表型,并降低了植株的基础抗性[7]。
Cheng等的研究发现SNC1的抑制子MOS7与人类和果蝇的核孔蛋白NUP88同源,定位于核膜上[56]。拟南芥MOS7的突变体植株mos7表现出对R蛋白介导的抗病反应和系统获得性抗性反应中更易感的表型。进一步研究发现,将MOS7突变后,与核外排相关的核输出反应增强了,特别是NPR1蛋白、SNC1蛋白和EDS1蛋白在核中的积累量都降低了。由此看来,MOS7能够影响水杨酸、SNC1和RPS4相关的免疫反应。
MOS3(Nup96)蛋白在脊椎动物体内,属于Nup107-160复合物。因此,Marcel等对拟南芥Nup107-160复合物中的蛋白进行筛选,发现突变体nup160对Pst DC3000(avrRps4)特异性地表现出更易感的表型,说明核孔蛋白NUP160参与TIRNB-LRR型R基因介导的抗性反应[60]。在突变体nup160中,细胞核内mRNA的总量有明显的增加,推测NUP160会影响核中mRNA的输出以及EDS1的转录活动[60-61]。
3 展 望
随着对植物先天免疫反应研究的不断深入,越来越多植物对抗病原菌的新机制被揭示出来。在植物的先天免疫过程中,R蛋白在识别效应因子之后能够进入到细胞核中,结合免疫反应的转录抑制子,重新编排细胞中的转录活动,激活相关抗病基因的表达。所以在植物抗病过程中,一些R蛋白能否进入到核中对激活抗病反应至关重要。值得注意的是,某些病原菌分泌的效应因子为了避免宿主细胞中R蛋白的识别,进化出直接进入宿主细胞核的本领。研究这些效应蛋白是如何挟持和利用植物核质运输机制的,可以帮助我们提高对病菌致病机制的认识,并进而为改造寄主植物核质运输机制、避开病菌侵染提供依据。
除了ETI反应外,植物的系统获得性抗性也需要植物激素水杨酸调控其下游蛋白NPR1进核来获得。在对抗病基因SNC1的研究中发现,一些核质运输相关蛋白的缺失也会引起植物抗病能力的变化,说明核质运输过程与植物的抗病反应有千丝万缕的联系,这种联系体现在核质运输调控了基础抗性,如激素水平的变化以及对效应蛋白的识别等一系列过程。目前植物细胞内基本的核质运输机制已逐渐明了,但病原菌的效应因子是如何进入宿主细胞核的?核质运输相关的蛋白是如何影响植物抗病反应的?免疫反应中的R蛋白又在细胞核内发挥着怎样的作用?这些过程都不是十分清楚,对这些机制的认识是我们人为设计并提高植物抗病性的前题,也是未来抗病领域研究的重要方向。
[1] FELIX G,DURAN JD,VOLKO S,et al.Plants have a sensitive perception system for the most conserved domain of bacterial flagellin[J].The Plant Journal,1999,18(3):265-276.
[2] KUNZE G,ZIPFEL C,ROBATZEK S,et al.The N terminus of bacterial elongation factor Tu elicits innate immunity in Arabidopsis plants[J].The Plant Cell Online,2004,16(12):3 496-3 507.
[3] CHISHOLM ST,COAKER G,DAY B,et al.Host-microbe interactions:shaping the evolution of the plant immune response[J].Cell,2006,124(4):803-814.
[4] JONES J D,DANGL J L.The plant immune system[J].Nature,2006,444(7 117):323-329.
[5] HAMMOND-KOSACK K E,JONES J.Resistance gene-dependent plant defense responses[J].The Plant Cell,1996,8(10):1773.
[6] CAO H,BOWLING S A,GORDON A S,et al.Characterization of an Arabidopsis mutant that is nonresponsive to inducers of systemic acquired resistance[J].The Plant Cell Online,1994,6(11):1 583-1 592.
[7] ZHANG Y,LI X.A putative nucleoporin 96is required for both basal defense and constitutive resistance responses mediated by suppressor of npr1-1,constitutive 1[J].The Plant Cell Online,2005,17(4):1 306-1 316.
[8] HINSHAW J E,CARRAGHER B O,MILLIGAN R A.Architecture and design of the nuclear pore complex[J].Cell,1992,69(7):1 133-1 141.
[9] XU X M,MEIER I.The nuclear pore comes to the fore[J].Trends in Plant Science,2008,13(1):20-27.
[10] MEIER I,BRKLJACIC J.Adding pieces to the puzzling plant nuclear envelope[J].Current Opinion in Plant Biology,2009,12(6):752-759.
[11] BREEUWER M,GOLDFARB D S.Facilitated nuclear transport of histone H1and other small nucleophilic proteins[J].Cell,1990,60(6):999-1008.
[12] PEMBERTON L F,PASCHAL B M.Mechanisms of receptor-mediated nuclear import and nuclear export[J].Traffic,2005,6(3):187-198.
[13] YANG Z.Small GTPases versatile signaling switches in plants[J].The Plant Cell Online,2002,14(suppl 1):S375-S388.
[14] BISCHOFF F R,PONSTINGL H.Catalysis of guanine nucleotide exchange on Ran by the mitotic regulator RCC1[J].Nature,1991,354(6 348):80-82.
[15] RIBBECK K,LIPOWSKY G,KENT H M,et al.NTF2mediates nuclear import of Ran[J].The EMBO Journal,1998,17(22):6 587-6 598.
[16] SMITH A,BROWNAWELL A,MACARA I G.Nuclear import of Ran is mediated by the transport factor NTF2[J].Current Biology,1998,8(25):1 403-1 401.
[17] WANG X,XU Y,HAN Y,et al.Overexpression of RAN1in rice and Arabidopsis alters primordial meristem,mitotic progress,and sensitivity to auxin[J].Plant Physiology,2006,140(1):91-101.
[18] CHEN N,XU Y,WANG X,et al.OsRAN2,essential for mitosis,enhances cold tolerance in rice by promoting export of intranuclear tubulin and maintaining cell division under cold stress[J].Plant,Cell &Environment,2011,34(1):52-64.
[19] GÖRLICH D,KUTAY U.Transport between the cell nucleus and the cytoplasm[J].Annual Review of Cell and Developmental Biology,1999,15(1):607-660.
[20] COOK A,BONO F,JINEK M,et al.Structural biology of nucleocytoplasmic transport[J].Annu Rev Biochem,2007,76:647-671.
[21] MINGOT J M,KOSTKA S,KRAFT R,et al.Importin 13:a novel mediator of nuclear import and export[J].The EMBO Journal,2001,20(14):3 685-3 694.
[22] LIPOWSKY G,BISCHOFF F R,SCHWARZMAIER P,et al.Exportin 4:a mediator of a novel nuclear export pathway in higher eukaryotes[J].The EMBO Journal,2000,19(16):4 362-4 371.
[23] GONTAN C,GÜTTLER T,ENGELEN E,et al.Exportin 4mediates a novel nuclear import pathway for Sox family transcription factors[J].The Journal of Cell Biology,2009,185(1):27-34.
[24] LAWTON K,WEYMANN K,FRIEDRICH L,et al.Systemic acquired resistance in Arabidopsis requires salicylic acid but not ethylene[J].MPMI-Molecular Plant Microbe Interactions,1995,8(6):863-870.
[25] KINKEMA M,FAN W,DONG X.Nuclear localization of NPR1is required for activation of PRgene expression[J].The Plant Cell Online,2000,12(12):2 339-2 350.
[26] PELEG-GROSSMAN S,MELAMED-BOOK N,COHEN G,et al.Cytoplasmic H2O2prevents translocation of NPR1to the nucleus and inhibits the induction of PR genes in Arabidopsis[J].Plant Signaling &Behavior,2010,5(11):1 401.
[27] JOHNSON C,BODEN E,ARIAS J.Salicylic acid and NPR1induce the recruitment of trans-activating TGA factors to a defense gene promoter in Arabidopsis[J].The Plant Cell Online,2003,15(8):1 846-1 858.
[28] SPOEL S H,MOU Z,TADA Y,et al.Proteasome-mediated turnover of the transcription co-activator NPR1plays dual roles in regulating plant immunity[J].Cell,2009,137(5):860.
[29] FU Z Q,YAN S,SALEH A,et al.NPR3and NPR4are receptors for the immune signal salicylic acid in plants[J].Nature,2012,486(7402):228-232.
[30] HACKMANN C,KORNELI C,KUTYNIOK M,et al.Salicylic acid-dependent and-independent impact of an RNA-binding protein on plant immunity[J].Plant,Cell and Environment,2014,37(3):696-706.
[31] MAEKAWA T,CHENG W,SPIRIDON L N,et al.Coiled-coil domain-dependent homodimerization of intracellular barley immune receptors defines a minimal functional module for triggering cell death[J].Cell host &microbe,2011,9(3):187-199.
[32] ZHANG Y,GORITSCHNIG S,et al.A gain-of-function mutation in a plant disease resistance gene leads to constitutive activation of downstream signal transduction pathways in suppressor of npr1-1,constitutive 1[J].The Plant Cell Online,2003,15(11):2 636-2 646.
[33] MANG H G,QIAN W,ZHU Y,et al.Abscisic acid deficiency antagonizes high-temperature inhibition of disease resistance through enhancing nuclear accumulation of resistance proteins SNC1and RPS4in Arabidopsis[J].The Plant Cell Online,2012,24(3):1 271-1 284.
[34] GASSMANN W,HINSCH M E,STASKAWICZ B J.The Arabidopsis RPS4bacterial-resistance gene is a member of the TIR-NBS-LRR family of disease-resistance genes[J].The Plant Journal,1999,20(3):265-277.
[35] KIM S H,GAO F,BHATTACHARJEE S,et al.The Arabidopsis resistance-like gene SNC1is activated by mutations in SRFR1and contributes to resistance to the bacterial effector AvrRps4[J].PLoS Pathogens,2010,6(11):e1001172.
[36] LI X,CLARKE J D,ZHANG Y,et al.Activation of an EDS1-mediated R-gene pathway in the snc1mutant leads to constitutive,NPR1-independent pathogen resistance[J].Molecular Plant-Microbe Interactions,2001,14(10):1 131-1 139.
[37] WIERMER M,FEYS B J,PARKER J E.Plant immunity:the EDS1regulatory node[J].Current Opinion in Plant Biology,2005,8(4):383-389.
[38] WIRTHMUELLER L,ZHANG Y,JONES J D,et al.Nuclear accumulation of the Arabidopsis immune receptor RPS4is necessary for triggering EDS1-dependent defense[J].Current Biology,2007,17(23):2 023-2 029.
[39] GARCÍA A V,BLANVILLAIN-BAUFUMÉS,HUIBERS R P,et al.Balanced nuclear and cytoplasmic activities of EDS1are required for a complete plant innate immune response[J].PLoS Pathogens,2010,6(7):e1000970.
[40] HEIDRICH K,WIRTHMUELLER L,TASSET C,et al.Arabidopsis EDS1connects pathogen effector recognition to cell compartmentspecific immune responses[J].Science,2011,334(6061):1 401-1 404.
[41] DESLANDES L,OLIVIER J,THEULIÈRES F,et al.Resistance to Ralstonia solanacearumin Arabidopsis thalianais conferred by the recessive RRS1-Rgene,a member of a novel family of resistance genes[J].Proceedings of the National Academy of Sciences,2002,99(4):2 404-2 409.
[42] DESLANDES L,OLIVIER J,et al.Physical interaction between RRS1-R,aprotein conferring resistance to bacterial wilt,and PopP2,a type III effector targeted to the plant nucleus[J].Proceedings of the National Academy of Sciences,2003,100(13):8 024-8 029.
[43] BERNOUX M,TIMMERS T,JAUNEAU A,et al.RD19,an Arabidopsis cysteine protease required for RRS1-R-mediated resistance,is relocalized to the nucleus by the Ralstonia solanacearumPopP2effector[J].The Plant Cell Online,2008,20(8):2 252-2 264.
[44] NARUSAKA M,SHIRASU K,NOUTOSHI Y,et al.RRS1and RPS4provide a dual Resistance-gene system against fungal and bacterial pathogens[J].The Plant Journal,2009,60(2):218-226.
[45] SOHN K H,SEGONZAC C,RALLAPALLI G,et al.The nuclear immune receptor RPS4Is required for RRS1SLH1-dependent constitutive defense activation in Arabidopsis thaliana[J].PLoS Genetics,2014,10(10):e1004655.
[46] SHEN Q H,SAIJO Y,MAUCH S,et al.Nuclear activity of MLA immune receptors links isolate-specific and basal disease-resistance responses[J].Science,2007,315(5815):1 098-1 103.
[47] CHANG C,YU D,JIAO J,et al.Barley MLA immune receptors directly interfere with antagonistically acting transcription factors to initiate disease resistance signaling[J].The Plant Cell Online,2013,25(3):1 158-1 173.
[48] BAI S,LIU J,CHANG C,et al.Structure-function analysis of barley NLR immune receptor MLA10reveals its cell compartment specific activity in cell death and disease resistance[J].PLoS Pathogens,2012,8(6):e1002752.
[49] KANNEGANTI T D,BAI X,et al.A functional genetic assay for nuclear trafficking in plants[J].The Plant Journal,2007,50(1):149-158.
[50] SCHORNACK S,MOSCOU M J,WARD E R,et al.Engineering plant disease resistance based on TAL effectors[J].Annual Review of Phytopathology,2013,51:383-406.
[51] BOCH J,BONAS U.Xanthomonas AvrBs3family-type III effectors:discovery and function[J].Annual Review of Phytopathology,2010,48:419-436.
[52] CHEN L Q,HOU B H,LALONDE S,et al.Sugar transporters for intercellular exchange and nutrition of pathogens[J].Nature,2010,468(7323):527-532.
[53] BONAS U,STALL R E,STASKAWICZ B.Genetic and structural characterization of the avirulence gene avrBs3from Xanthomonas campestris pv.vesicatoria[J].Molecular and General Genetics MGG,1989,218(1):127-136.
[54] SZUREK B,MAROIS E,BONAS U,et al.Eukaryotic features of the Xanthomonas type III effector AvrBs3:protein domains involved in transcriptional activation and the interaction with nuclear import receptors from pepper[J].The Plant Journal,2001,26(5):523-534.
[55] PALMA K,ZHANG Y,LI X.An importinαhomolog,MOS6,plays an important role in plant innate immunity[J].Current Biology,2005,15(12):1129-1135.
[56] CHENG Y T,GERMAIN H,WIERMER M,et al.Nuclear pore complex component MOS7/Nup88is required for innate immunity and nuclear accumulation of defense regulators in Arabidopsis[J].The Plant Cell Online,2009,21(8):2 503-2 516.
[57] WIRTHMUELLER L,ROTH C,FABRO G,et al.Probing formation of cargo/importin-αtransport complexes in plant cells using a pathogen effector[J].The Plant Journal,2015,81(1):40-52.
[58] WIRTHMUELLER L,ROTH C,BANFIELD M J,et al.Hop-on hop-off:importin-α-guided tours to the nucleus in innate immune signaling[J].Frontiers in Plant Science,2013,4:149
[59] DESLANDES L,RIVAS S.The plant cell nucleus[J].Plant Signaling &Behavior,2011,6(1):42-48.
[60] WIERMER M,CHENG Y T,IMKAMPE J,et al.Putative members of the Arabidopsis Nup107-160nuclear pore sub-complex contribute to pathogen defense[J].The Plant Journal,2012,70(5):796-808.
[61] ROTH C,WIERMER M.Nucleoporins Nup160and Seh1are required for disease resistance in Arabidopsis[J].Plant Signaling &Behavior,2012,7(10):1212-1214.
(编辑:裴阿卫)
Plant Nucleocytoplasmic Transport and Innate Immunity
GUO Xiaoyu1,2,LIU Jun2,WANG Tian1*
(1College of Horticulture,Anhui Agricultural University,Hefei 230036,China;2State Key Laboratory of Plant Genomics,Institute of Microbiology,Chinese Academy of Sciences,Beijing 100101,China)
In order to counteract the invasion of pathogenic microorganisms,plants have evolved a set of immune system to recognize the pathogens and mount defense.The plasma membrane-tethered pathogen recognition receptors(PRRs)and the cytoplasmic NB-LRR immune receptors are responsible for the recognition of the conserved features of pathogens.Following the recognition,the transportation of signals between nucleus and cytoplasm requires the presence of nucleocytoplasmic transport proteins to help the immune proteins and/or their associated signal carries to pass through the nuclear pores.Notably,some types of pathogen effectors,such as transcription activator-like(TAL)effectors,have also been found utilizing the host nucleocytoplasmic transport system to enter nucleus and to activate the expression of host susceptibility genes.In this review,we summarized the recent progresses of nucleocytoplasmic transport in plant innate immunity,including the mechanism of it,the require of plant immunity to it and some protein related to it in plant immunity,to demonstrate its importance in disease resistance.
nucleocytoplasmic transport;plant immunity;signal transduction;disease resistance
Q945.8;Q257
A
10.7606/j.issn.1000-4025.2015.07.1488
1000-4025(2015)07-1488-09
2015-02-13;修改稿收到日期:2015-06-05
安徽农业大学稳定和引进人才科研项目(wd2006-2)资助。
郭晓雨(1991-),女,在读硕士研究生,主要从事植物病理的研究。E-mail:xiaoyuguo118@163.com
*通信作者:汪 天,博士,副教授,主要从事园林植物栽培与逆境生理等方面的研究。E-mail:wangtian63@163.com

