H3N2亚型禽流感病毒双重实时荧光定量RT-PCR检测方法的建立
刘婷婷,谢芝勋,宋德贵,谢志勤,邓显文,谢丽基,黄 莉,罗思思,黄娇玲,曾婷婷
(1.广西师范大学生命科学学院,广西桂林541004;2.广西壮族自治区兽医研究所,广西畜禽疫苗新技术重点实验室,广西南宁530001)
禽流感病毒(Avian influenza virus,AIV)是单股负链、分节段的RNA病毒,属于正黏病毒科A型流感病毒属,其基因组长约13kb,含有8个基因节段,分别编码 HA、NA、NP、NS、MP、PA、PB1和PB2蛋白[1-3]。其中HA、NA基因是两个比较重要的基因节段,研究表明HA和NA基因之间存在某种平衡对病毒的致病性有很大关系[4],因此,在对AIV的研究中多将重点放在对HA和NA基因的研究。
H3N2亚型AIV是低致病性的,在禽类中呈隐性携带,被感染的禽类通常不发病或症状表现较轻,往往不被人们所注意。在对H3亚型AIV进行分离纯化、鉴定中发现,H3N2亚型在H3亚型AIV中为较多组合的血清型亚型。同时,在猪流感病毒与人流感病毒中H3N2亚型也为较常见亚型之一,这就为两种宿主的流感病毒在猪"混合器"中发生基因重排提供了条件。因此,应加强对H3N2亚型AIV的监测,而传统的血清学检测方法对NA亚型的检测存在局限性。实时荧光定量RT-PCR是一种将普通PCR方法与荧光检测方法相结合的技术,通过在PCR反应体系中加入能与扩增模板特异性结合并标有荧光基团的探针,监测每一时刻产物的集聚程度[5]。该法具有操作简便、结果直观、敏感性高、特异性强、可定量检测等特点。尤其是多重实时荧光定量PCR在临床多种病原混合感染的鉴别诊断上具有独特的优势[6-7]。目前,针对H3N2亚型AIV多重实时荧光定量RT-PCR方法尚未见报道,因此,本研究建立了一种H3N2亚型AIV双重实时荧光定量RT-PCR,旨在为H3N2亚型AIV的监测提供一定的技术支撑。
1 材料与方法
1.1 材料
1.1.1 主要试剂 DNA/RNA抽提试剂盒,北京全式金生物技术有限公司产品;pMD-18T试剂盒、反转录试剂和荧光PCR Premix ExTaq,宝生物(大连)有限公司产品;胶回收试剂盒和质粒提取试剂盒,广州东盛生物科技有限公司产品。
1.1.2 毒 株 H1N1 、H3N2、H3N6 、H3N8、H4N2、H4N6、H6N1、H6N6、H6N8、H9N2 亚 型AIV由广西兽医研究所畜禽疫苗新技术重点实验室分离保存,H5N1、H7N2亚型AIV RNA为香港大学惠赠,新城疫病毒(NDV)F48E9、传染性支气管炎病毒(IBV)H52、传染性喉气管炎病毒(ILTV)北京株、鸡毒支原体(MG)S6及禽呼肠病毒(ARV)S1733由广西兽医研究所畜禽疫苗新技术重点实验室保存提供。
1.1.3 其他 SPF鸡胚,北京梅里亚公司产品;Lightcycler2.0荧光定量PCR仪,Roche公司产品。
1.2 方法
1.2.1 引物与TaqMan探针的设计与合成 根据GenBank中H3N2亚型AIV HA、NA基因保守序列,利用Primer Express3.0软件,设计了两对特异性引物和两条TaqMan探针,并通过Blast验证,保证引物扩增出对应的靶基因,且不与其他亚型AIV发生交叉。引物与探针由TaKaRa公司合成,序列见表1。
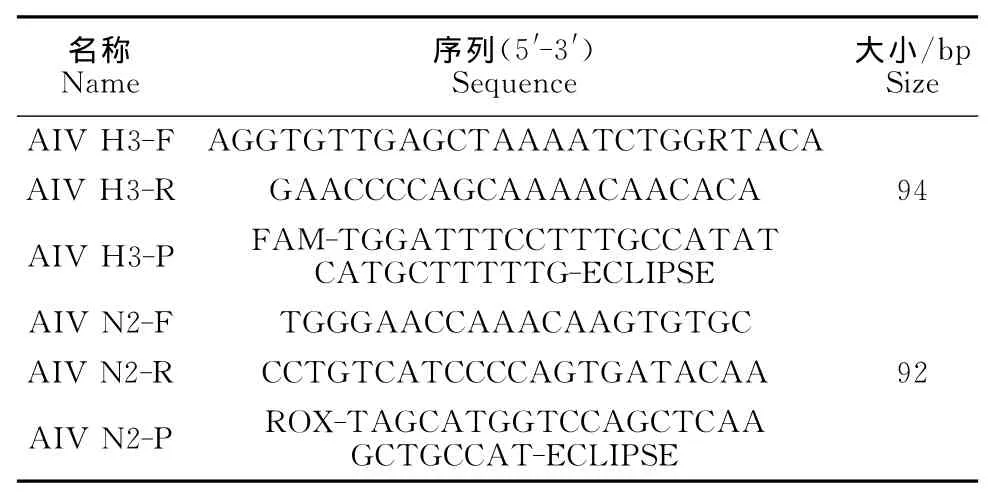
表1 引物信息Table 1 Primer information
1.2.2 病毒RNA的抽提与反转录 参照DNA/RNA抽提试剂盒说明书提取各亚型AIV及NDV、IBV和ARV的RNA,并用随机引物(9mer)进行反转录,将反转录的cDNA及抽提的ILTV、MG的DNA,置-30℃保存备用。
1.2.3 标准品的制备 以 H3N2亚型 AIV的HA、NA基因全长通用引物进行PCR扩增,阳性产物经胶回收纯化后,连接到pMD18-T载体,提取阳性克隆质粒AIV-H3和AIV-N2送至宝生物工程(大连)有限公司进行测序。参照Sambrook J的方法[8]测定核酸的浓度与纯度,计算各质粒的拷贝数。
1.2.4 双重实时荧光定量PCR反应条件的优化应用AIV-H3和AIV-N2质粒作为标准品,采用20μL PCR 反应体系:real-time PCR premix 10μL,AIV-H3、AIV-N2引物和探针终浓度采用矩阵法在0.2μmol/L~0.8μmol/L之间调整,模板2μL,以ddH2O补足20μL。根据结果筛选出能够检测H3N2亚型AIV,且对Ct值和扩增效率影响不大的引物和探针配比浓度,建立双重实时荧光定量RT-PCR方法。
1.2.5 敏感性试验与标准曲线的建立 用含有目的片段的AIV-H3、AIV-N2质粒做标准品,对其进行10倍系列稀释后,将相同拷贝数的质粒混合作为模板进行实时荧光定量RT-PCR,并建立标准曲线。
1.2.6 特异性试验 利用优化好的双重实时荧光定量RT-PCR反应体系,对各亚型AIV和上述常见禽病病原体进行扩增,以ddH2O为模板作为阴性对照,对仪器中的每个检测孔同时收集FAM和ROX两种荧光信号,确定该检测方法的特异性。
1.2.7 重复性试验 按照优化好的双重实时荧光定量RT-PCR,以1×108拷贝/μL的 AIV-H3和AIV-N2质粒为标准品,分为5个标本同时检测。通过计算Ct值的标准差(S)和变异系数(CV)来验证实时荧光定量PCR的批内重复性。在第4天、第7天后重复检测保存于-20℃的模板,验证模板的稳定性及实时荧光定量PCR的批间重复性。
1.2.8 干扰性试验 将AIV-H3和AIV-N2质粒标准品按不同浓度进行组合(1×108和1×102;1×102和1×108;1×108和1×103;1×103和1×108),分别用双重实时荧光定量RT-PCR和单重荧光定量PCR检测,确定模板浓度相差较大时二者的检测是否存在干扰。
1.2.9 临床样品检测 抽提从广西南宁市活禽市场采集的96份咽喉、泄殖腔拭子样品的RNA,应用所建立的H3N2亚型AIV双重实时荧光定量RTPCR方法进行检测。同时对这96份样品进行抗生素处理后,用鸡胚法分离病毒,用传统血清学方法验证HA亚型的准确性,通过普通RT-PCR扩增NA基因,进行克隆测序验证NA亚型准确性。
2 结果
2.1 双重实时荧光定量RT-PCR反应条件
通过对AIV-H3、AIV-N2引物对及探针终浓度的优化,最终确定最佳反应体系为real-time PCR premix 10μL,AIV-H3、AIV-N2引物和探针终浓度均为0.4μmol/L,模板2μL,以无RNA酶的超纯水补足20μL,均匀混合,置Lightcycler荧光定量PCR仪上进行自动化扩增反应。反应程序为:94℃30s;94℃10s,60℃20s,共40个循环;40℃结束反应。
2.2 敏感性试验结果及标准曲线的建立
将相同拷贝数的AIV-H3质粒和AIV-N2质粒混合作为模版进行双重实时荧光定量RT-PCR扩增,结果如图1,在FAM荧光通道(530nm激发光下)H3亚型AIV检测下限为1×102拷贝/μL,根据Ct值和质粒标准品拷贝数的对数值而建立的标准曲线回归方程为:y=-3.23x+41.21(x代表模板拷贝数的对数值,y代表Ct值),在ROX荧光通道(610nm激发光下)(图2)N2亚型AIV检测下限为1×102拷贝/μL,根据Ct值和质粒标准品拷贝数的对数值而建立的标准曲线回归方程为:y=-3.28x+41.31,结果表明该法对 H3N2亚型AIV的检测下限为1×102拷贝/μL,且Ct值与标准品的浓度具有良好的相关性。
2.3 特异性试验结果
特异性结果显示,H3N2亚型AIV在FAM和ROX荧光通道均产生扩增曲线,H3N6、H3N8亚型AIV在FAM荧光通道(530nm激发光下)出现扩增曲线,在ROX荧光通道(610nm激发光下)为直线,H4N2、H7N2、H9N2亚型AIV在ROX荧光通道出现扩增曲线,在FAM荧光通道为直线,其他亚型AIV和常见禽呼吸道疾病病毒在FAM和ROX荧光通道检测均为直线,与实验设计相符(图3)。
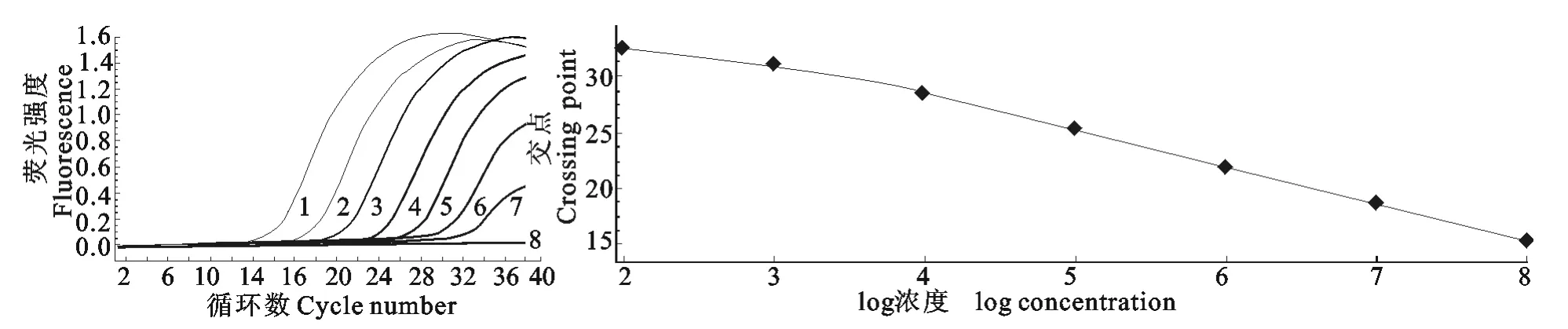
图1 H3亚型AIV的敏感性及标准曲线Fig.1 The sensitivity and the standard curve of real-time RT-PCR for H3

图2 N2亚型AIV的敏感性及标准曲线Fig.2 The sensitivity and the standard curve of real-time RT-PCR for N2
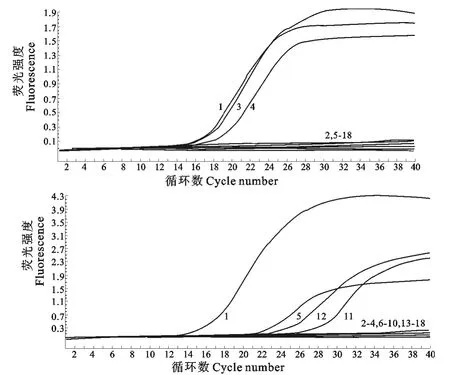
图3 Real-time RT-PCR特异性试验Fig.3 The specificity assay of real-time RT-PCR
2.4 重复性试验结果
在批内重复性试验中,对H3和N2亚型相同浓度质粒标准品混合物作为模板进行5次平行双重实时荧光定量RT-PCR,5个平行反应在相应的荧光通道下均获得扩增曲线(图4),H3亚型AIV通道Ct值变异系数为0.31% ,N2亚型AIV通道Ct值变异系数为0.30% ,对上述模板,以相同反应条件4d和7d后进行批间重复试验,Ct值变异系数分别为1.28%、1.35%。结果表明,本研究建立的双重实时荧光定量PCR检测方法的重复性良好,可以满足临床检测的要求(表2和表3)。

图4 Real-time RT-PCR组内重复性试验Fig.4 The repeatability of real-time RT-PCR in one group
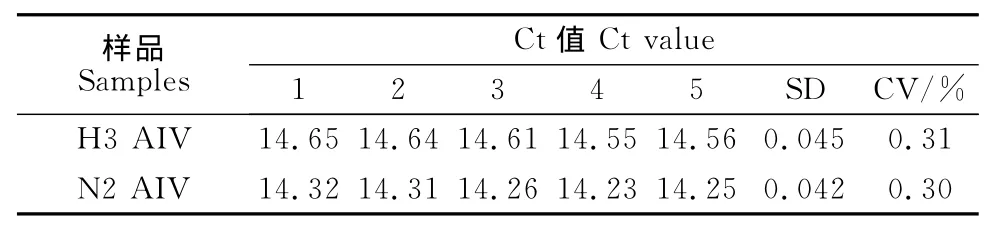
表2 组内重复性试验Table 2 Repeatability test in the group
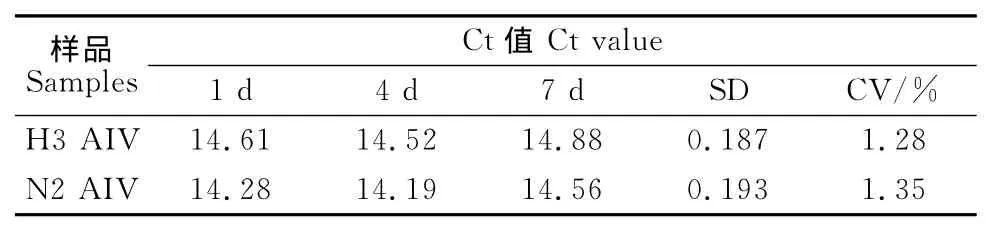
表3 组间重复性试验Table 3 Repeatability test between groups
2.5 干扰性试验结果
将AIV-H3和AIV-N2质粒标准品模板按不同浓度进行组合时发现,当一个模板浓度高而另一个模板浓度低时,仍可在不同荧光通道下分别检测到2个模板,并与单项荧光PCR检测的Ct值的变异不大。
2.6 临床样品检测结果
应用该法对96份临床样品进行检测,结果显示,检出 H3N2亚型 AIV 4份(阳性率为4.17%),检出单H3亚型AIV 1份(阳性率为1.04%),检出单N2亚型AIV 17份(阳性率为17.70%),检测结果与病毒分离鉴定结果一致。
3 讨论
H3N2亚型AIV的致病力较低,在流行病学中的作用常被忽视。近年来,研究发现H3亚型AIV不仅可引起禽类的感染,也可以感染猪、马、犬等哺乳动物。由于流感病毒聚合酶保真性低,当同一宿主同时感染多种流感病毒时,容易发生基因重排,形成新的病毒毒株,造成对人类健康的威胁。1968年暴发的香港流感病毒A/HongKong/68(H3N2)经研究证实就是由人的H2N2亚型流感病毒与H3亚型AIV的HA基因重排得来,其PB1基因也来自于AIV[9-10]。因此,建立一种快速检测 H3N2亚型AIV的方法显得尤为重要。
实时荧光定量RT-PCR是一种高敏感型、特异性、准确可靠的一种检测技术,目前,应用于多项病毒的检测[11-16]。本研究针对 H3N2亚型 AIV的HA基因和NA基因的保守序列,通过Primer Express 3.0软件,设计并筛选出2套荧光TaqMan探针和引物,通过优化引物与探针的配比浓度,建立了H3N2亚型AIV双重实时荧光定量RT-PCR。该方法具有较高的敏感性,可检测到100拷贝/μL的H3N2亚型AIV;可一管检出H3N2亚型AIV感染,也可鉴别单个H3亚型或N2亚型AIV的感染,且相互间没有干扰,实现了一管二检的目的,节省了成本。同时,该方法对其他亚型AIV和常见禽病病原体的检测均为阴性,表明本研究建立的H3N2亚型AIV双重实时荧光定量RT-PCR具有较高的特异性;通过重复性试验表明,Ct值变异系数均小于3%,检测体系稳定,具有良好的重复性。该双重实时荧光定量RT-PCR与普通RT-PCR相比,整个反应过程仅需30min左右即可完成,而且不需要EB染色,减少了环境污染,整个扩增过程可以通过电脑实时观察,简便、直观,实现了对H3N2亚型AIV快速检测的目的。因此,本研究所建立的H3N2亚型AIV双重实时荧光定量RT-PCR具有一定的有效实用性,对H3N2亚型AIV的早期诊断和有效防控具有重要意义。
[1]谭 伟,谢芝勋.甲型流感病毒PA蛋白新成员的研究进展[J].病毒学报,2014,30(6):689-693.
[2]谭 伟,谢芝勋.甲型流感病毒NS1、NS2和NS3蛋白的研究[J].畜牧兽医学报,2014,45(12):1911-1916.
[3]彭 宜,谢芝勋,郭 捷,等.利用RT-LAMP可视化检测技术检测H1亚型禽流感病毒及N1、N2亚型的分型[J].病毒学报,2013,29(3):154-161.
[4]Castrucci M R,Kawaoka Y.Biologic importance of neuramini dase stalk length in influenza A virus[J].Virology,1993,67(2):759-764.
[5]谭 伟,李 孟,谢芝勋.禽流感病毒的监测及诊断[J].中国人兽共患病学报,2014,30(11):1145-1149.
[6]Elnifro E,Ashshi A,Cooper R,et al.Multiplex PCR:Optimization and application in diagnostic virology[J].Clin Microbiol Rev,2000,13(4):559-570.
[7]Pang Y,Wang H,Girshick T,et al.Development and application of a multiple polymerase chainreaction for avain respiratory agents[J].Avian Dis,2002,46(3):691-699.
[8]Sambrook J,Fritsh E T,Maniatis T.Molecular cloning:a laboratory manuel[M].New York:Cold Spring Harbor.Cold Spring Harbor Laboratory Press,1989.
[9]Peng Y,Xie Z,Liu J,et al.Epidemiological surveillance of low pathogenic avian influenza virus(LPAIV)from poultry in Guangxi province,southern China.[J].PLoS One,2013,8(10):1-6.
[10]Peng Y,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].Virol J,2011(8):337.
[11]谢芝勋,谢丽基,庞耀珊,等.WSSV和IHHNV二重实时荧光PCR检测方法的建立[J].水生生物学报,2009,33(1):22-27.
[12]Xie Z,Pang Y S,Liu J,et al.A multiplex RT-PCR for detection of type A influenza virus and differentiation of avian H5,H7,and H9hemagglutinin subtype[J].Mol Cell Probe,2006,20(3-4):245-249.
[13]罗思思,谢芝勋,刘加波,等.H7N9亚型AIV双重实时荧光定量RT-PCR检测方法的建立[J].动物医学进展,2013,34(12):1-5.
[14]谢丽基,谢芝勋,邓显文,等.鸭Ⅰ型肝炎病毒和番鸭细小病毒二重荧光定量RT-PCR方法的建立[J].中国兽医学报,2013,33(8):1184-1189.
[15]谢芝勋,谢丽基,刘加波,等.禽流感和新城疫病毒二重荧光定量 RT-PCR检测方法的建立[J].生物技术通讯,2008,19(3):410-413.
[16]许宗丽,谢芝勋,谢丽基,等.鸭副黏病毒和鸭圆环病毒二重荧光定量PCR检测方法的建立[J].中国畜牧兽医,2013,40(4):26-31.

