血红素氧化酶-1与非肥胖女性多囊卵巢综合征的关联性研究*
丁洪波, 高 慧, 严佩佩, 王 迪
1武汉轻工大学生物与制药工程学院,武汉 430023
2华中科技大学同济医学院营养与食品卫生学系,武汉 430030
血红素氧化酶-1与非肥胖女性多囊卵巢综合征的关联性研究*
丁洪波1, 高 慧2, 严佩佩2, 王 迪2
1武汉轻工大学生物与制药工程学院,武汉 430023
2华中科技大学同济医学院营养与食品卫生学系,武汉 430030
目的 探讨循环中血红素氧化酶-1(HO-1)是否参与了多囊卵巢综合征(PCOS)的发生。方法 获得知情同意后,按照年龄和体重指数(BMI)匹配的原则,检测了80名PCOS患者和80名健康对照者的临床特征、外周血中激素水平以及糖脂代谢情况,提取并量化血清中HO-1。分析HO-1与PCOS发病风险的关系,并界定其预测作用。结果PCOS组妇女较对照组存在显著增加的胰岛素抵抗(IR)、氧化应激(OS)和炎症状态,三者共同作用,对PCOS的病理生理过程形成一个恶性循环。复合模型的受试者工作特征曲线(ROC)分析显示,纳入或不纳入HO-1的曲线下面积分别为0.864(95%CI 0.808~0.919)与0.953(95%CI 0.923~0.982)(P=0.000 5)。结论 血清HO-1可能参与了PCOS发生和发展过程,提示HO-1可作为识别女性发生PCOS的一个早期生物学标志物。
血红素氧化酶-1; 多囊卵巢综合征; 胰岛素抵抗; 氧化应激; 炎症
多囊卵巢综合症(PCOS)是一种在孕龄期妇女中常见的内分泌紊乱性疾病。不论是在肥胖或是非肥胖患者中,胰岛素抵抗(IR)和高胰岛素血症都被认为是PCOS患者发病机制和病理生理的重要环节[1]。虽然该病具体的发病机制仍有待研究,但已有的研究证实,氧化应激(OS)是胰岛素分泌缺陷和IR的重要早期病理机制。同时,PCOS患者亚临床慢性炎症因子水平升高,后者与其IR、心血管疾病发病风险增高密切相关[2]。
血红素氧化酶-1(HO-1),也称为热休克蛋白32(Hsp32),因其具有良好的抗炎、抗氧化和抗代谢紊乱特性而越来越受到人们的关注。在正常生理状态下,HO-1的表达与活性较低,但在各种应激条件下,其表达和活性会大大增强[3]。然而,循环中HO-1水平是否与PCOS有关,目前还未有研究证实。
研究表明,肥胖能诱导氧化应激和炎症过程,后者能增加PCOS妇女发生心血管疾病的风险。事实上,有20%~50%患PCOS的妇女是非肥胖体型的,他们发生PCOS的病理生理过程可能也与肥胖妇女不同。基于此,本研究选择2011年12月至2012年6月就诊于武汉同济医院生殖中心的门诊患者作为研究对象,筛选纳入80例PCOS病例和80例对照人群,拟界定和量化血清HO-1水平与PCOS的关系,并采用复合模型的受试者工作特征曲线(ROC)模型评价血清HO-1对PCOS的诊断价值。
1 资料与方法
1.1 研究对象
根据2003年鹿特丹会议修订的PCOS诊断标准,即以下3项中符合任何2项:①稀发排卵或无排卵;②高雄激素血症或高雄激素的临床表现(如多毛、痤疮等);③超声检查显示一侧或双侧卵巢直径2~9 mm的卵泡数≥12个和(或)卵巢体积增大(每侧>10 cm3,卵巢体积=0.5×长×宽×厚),即卵巢多囊样改变。此外,诊断时还需除外高雄激素血症等其它原因。
选取武汉同济医院生殖医学中心就诊的80例PCOS患者,同时选择同期因输卵管原因或男性不育在该院门诊就诊的月经规律、内分泌激素正常的80例患者作为正常对照组。所有研究对象均签署知情同意书。
纳入标准:①两组对象均为年龄25~38岁,BMI小于30 kg/m2;②两组对象均无感染性疾病、恶性肿瘤、自身免疫性疾病、心脑血管疾病、糖尿病、肝肾功能不全等;③近1个月未服用抗炎药物、免疫调节药物、降糖调脂药物及抗氧化药物等,至少3个月未使用过任何激素类药物;④无吸烟、饮酒等不良生活习惯。
1.2 方法
1.2.1 调查方法 本研究中所用问卷是通过查阅相关文献并结合调查对象自身特点,自行设计问卷,经预调查后修订而成。经问卷调查收集研究对象的基本资料(年龄、身高、体重、吸烟、饮酒状况等),既往病史,月经史,生育史,治疗史等信息。体重指数(BMI)=体重(kg)/身高的平方(m2)。采用现场发放、不记名填写、现场收回调查问卷的形式,文化程度较低无法填写者,必须是由调查人员根据调查表提出问题,调查对象完全理解后由调查人员如实将答案记录,以确保调查内容的真实性和完整性。
1.2.2 样本收集 受试者于月经周期第3天,闭经患者于B超检查未见优势卵泡日,早晨空腹抽取静脉血5 m L于非抗凝管中,室温静置沉淀30 min,2 000 r/min离心20 min,分离上层血清,分装后置于超低温冰箱冻存待测。
1.2.3 试剂 总胆固醇测定试剂盒(北京普利来基因技术有限公司);甘油三脂酶法测定试剂盒(北京普利来基因技术有限公司);葡萄糖测定试剂盒(北京普利来基因技术有限公司);丙二醛(MDA)试剂盒(中国碧云天公司);酶联免疫吸附法检测胰岛素试剂盒(美国R&D systems公司);8-羟基脱氧鸟苷(8-OHdG)试剂盒(美国Cayman化工公司)。
1.2.4 仪器 低温离心机(德国Eppendorf公司);-80℃低温冷冻冰箱(美国Thermo Scientific公司);Synergy 2多功能酶标仪(美国Bio-Tek公司);Roche Elecys 2010电化学发光免疫分析系统(瑞士Roche公司);96孔板微量振荡器(深圳天南海北有限公司);FA1604电子天平(上海天平仪器厂);ELX800型酶标仪(美国BIO-TEK公司);ALOKA-a-10彩超机(日本ALOKA公司)。
1.2.5 血清相关指标检测 按照试剂盒说明书检测血清生长激素、胰岛素和血脂浓度。胰岛素抵抗通过不同的方式来确定,包括空腹胰岛素(FI),β细胞功能稳态模型评估(HOMA-β)和胰岛素抵抗稳态模型评估(HOMA-IR)[4]。其计算公式为:HOMA-β=20×FI(μU/mL)/[FG(mmol/L)-3.5],HOMA-IR=FG(mmol/L)×FI(μU/m L)/22.5。其中FG为空腹血糖。血清中HO-1和HO-2的浓度使用特定的ELISA方法按照说明书测定(Enzo Life Sciences,USA)。组内和组间的变异系数总睾酮(TESTO)分别为5.5%和9.7%,泌乳刺激素(PRL)分别为5.6%和8.5%,促卵泡激素(FSH)分别为1.6%和3.2%,黄体生成素(LH)分别为2.8%和4.1%,雌二醇(E2)分别为3.4%和6.2%。
1.3 统计学方法
使用SPSS 12.0软件对所得数据进行整理和统计分析。由于获得的数据存在类型和分布的差异,故采用t检验(连续变量,正态分布)或Mann-Whitney U检验(连续变量,偏态分布)进行统计性描述。以双侧P<0.05为差异具有统计学意义。使用Stata 11.0绘制复合模型ROC曲线,以曲线下面积(AUC)评估血清HO-1对PCOS的诊断意义。
2 结果
2.1 PCOS组患者与对照组各临床特征和代谢参数的比较
PCOS组患者的年龄、BMI、CHO、FSH、E2、PRL、HDL-C及LDL-C、FG较对照组差异无统计学意义(均P>0.05)。血清TESTO、LH和LH/FSH比值、TG、FI、HOMA-IR均较对照组显着升高,而HOMA-β值则显着降低,差异均具有统计学意义(均P<0.05)。同时我们发现,与对照组相比,PCOS患者血清HO-1水平显著降低(P<0.01)。见表1。
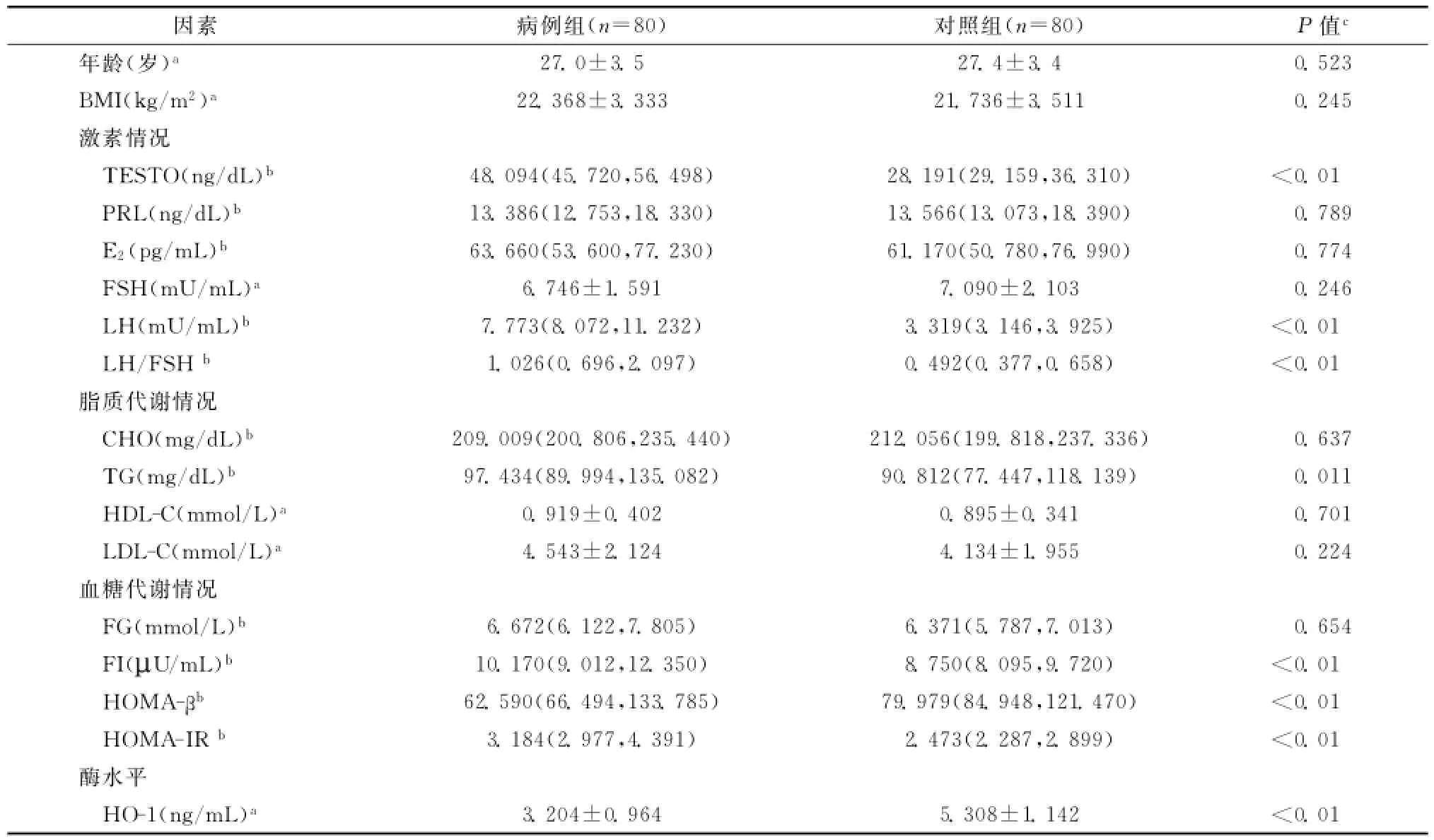
表1 PCOS病例和对照组间基本情况比较Table 1 Basic information of women with polycystic ovary syndrome(PCOS)and normal women(controls)
比较病例组和对照组间炎症和OS标志物的水平,血清CRP(图1A)和TNF-α(图1B)的浓度在PCOS组均较对照组显着增加(均P<0.01),OS标志物如MDA(图1C),8-OHd G(图1D)和NO(图1E)也有相同结果。
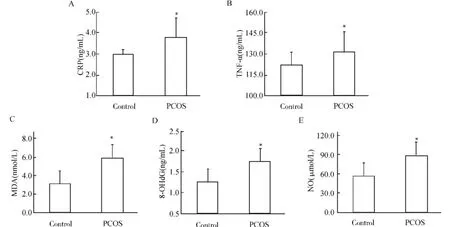
图1 PCOS病例和对照组血清炎症和OS标志物水平的比较Fig.1 Comparison of inflammation and oxidative stress(OS)status between polycystic ovary syndrome(PCOS)individuals and controls
2.2 血清HO-1水平和PCOS相关变量的关系
相关分析显示HO-1与TESTO、LH、FI以及LH/FSH比值间存在明显的负相关(均P<0.01)。调整了年龄和BMI,上述相关关系仍存在,但略有减弱(表2)。

表2 血清HO-1水平与PCOS其他各指标的相关性分析Table 2 Correlation coefficients between heme oxygenase-1(HO-1)and other variables of PCOS in the study subjects
以血清HO-1作为独立变量,年龄和BMI作为协变量的多元线性回归分析,发现HO-1与HOMA-IR指数呈负相关(图2A),而与HOMA-β呈正相关(图2B)。此外,HO-1与炎症指标CRP(图2C)和TNF-α(图2D)呈现负相关,而更大的幅度的负相关也在MDA(图2E),8-OHd G(图2F)和NO(图2G)中观察到。
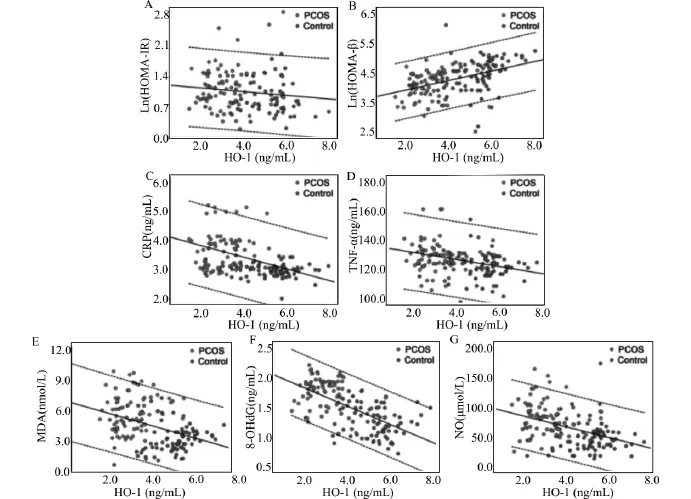
图2 HO-1与胰岛素敏感性、β细胞功能、炎症和OS指标间的关系Fig.2 Correlation between serum heme oxygenase-1(HO-1)concentration and insulin sensitivity,β-cell function,inflammation,and oxidative stress(OS)
2.3 血清HO-1对PCOS的判别分析
复合的ROC曲线模型中,在模型1中纳入PCOS已知的危险因素,包括年龄、BMI、TESTO、HOMA-IR、CHO和TG。模型2在模型的基础上加入血清HO-1水平。AUCs分别为0.864(95% CI 0.808~0.919)与0.953(95%CI 0.923~0.982),两组比较差异有统计学意义(P=0.000 5)(图3)。

图3 HO-1复合模型的ROC曲线和AUCsFig.3 Receiver operator characteristic(ROC)curves and corresponding areas under the curve(AUCs)for polycystic ovary syndrome(PCOS)using models without or with serum heme oxygenase-1(HO-1)level
3 讨论
PCOS目前的患病率已高达10%,其病因仍然不清楚。PCOS患者往往会出现IR合并代偿性高胰岛素血症,不仅增加患2型糖尿病的风险,并可导致多种代谢和血流动力学异常,使患者发生代谢综合征和心血管疾病风险增加[5]。新的证据表明,IR、低度慢性炎症和OS状态与PCOS的发生密切相关[1,67]。病理生理学观点认为,PCOS及其代谢并发症的发生发展,与相关的危险因素之间存在的恶性循环有关。PCOS代表了一个慢性炎症的过程[2],同时这种炎症引起了IR,而后者又可能通过削弱胰岛素的抗炎作用而进一步促进炎症[8]。此外,被高血糖活化的单核细胞可以引起PCOS的OS,后者可以刺激局部炎症反应[9],如此形成了炎症和OS之间的恶性循环。另一方面,IR易导致OS的发生,这是由于高血糖和高水平的游离脂肪酸能导致活性氧(ROS)的产生[10]。无论是在体外还是体内研究中均表明,OS损害组织对葡萄糖的摄取,导致IR和胰岛素分泌受损[1112]。总之,多种已知的危险因素之间的恶性循环对PCOS发病产生了关键作用。
HO-1是血红素降解的限速酶,能够催化血红素生成胆绿素、CO和铁。HO-1基因表达最大的特点是具有可诱导性。许多研究指出HO-1的诱导表达是一种自适应防御机制,以保护细胞和组织不受各种应激损伤,这也意味着它是一些临床疾病如2型糖尿病,阿尔兹海默症和硅肺病等的早期诊断生物标志物[1314]。本研究表明血清HO-1与上述的恶性循环呈负相关。本研究结果显示,血清HO-1与FI和HOMA-IR呈负相关,而对β细胞功能具有保护作用,因此可推测HO-1与PCOS患者体内的胰岛素功能具有密切关系。有趣的是,在PCOS人群中,HO-1和IR之间的相互作用似乎是双向的。一方面,上调的HO-1能增强胰岛素敏感性,改善葡萄糖耐量,并降低胰岛素水平[13];另一方面,2型糖尿病患者体内HO-1的m RNA水平较年龄匹配的对照组明显降低,提示IR可能会下调HO-1的活性[15]。这也印证了我们的研究结果,循环中HO-1水平在PCOS患者中较对照组低。
全身性的炎症一定程度上降低了PCOS患者循环中HO-1的水平。本研究发现在PCOS患者血清中,降低的HO-1与高表达的TNF-α呈负相关,这也与其他研究中HO-1的抑制会增加肥胖小鼠TNF-α的分泌[2]的结果相一致,提示体内HO-1的活化能削弱炎症反应并调节免疫反应。此外,CRP能抑制人单核细胞源性巨噬细胞中HO-1的表达[3,10],这也与本研究中HO-1与CRP的表达呈负相关的结果是一致的。上述的结果提示我们:HO-1在抗PCOS相关性炎症方面有重要作用。
HO-1是已知的强效抗氧化物质,在OS状态下,可迅速诱导产生。但目前的研究发现,PCOS患者体内HO-1表达降低,与体内OS状态呈负相关。可能的原因是:首先,PCOS患者体内的高水平ROS可能通过抑制HO-1基因启动子多态性而降低HO-1水平,由此减弱对各种应激损伤的敏感性[16]。此外,HO-1表达在疾病早期阶段增加(应对OS的防御能力活跃),但到后期则下降(防御能力受损),这一点在2型糖尿病和慢性阻塞性肺疾病(COPD)中都有论证[3,13]。
鉴于上述结果,我们发现,血清HO-1表达/活性的抑制是对PCOS患者体内存在的IR、炎症和OS状态的适应性反应,而这又导致患者更容易受到此三者的损害,进一步加剧PCOS的发展。此外,ROC曲线分析揭示,HO-1是PCOS的一个重要的保护因素,并对PCOS的诊断具有临床意义。
综上,本研究表明,在非肥胖PCOS妇女体内,对IR、OS和慢性炎症具有防御作用的HO-1显著降低。此项研究也强调了血清HO-1水平的医学价值,其有望成为PCOS诊断的新型临床生物标志物。
[1] Teede H,Deeks A,Moran L.Polycystic ovary syndrome:a complex condition with psychological,reproductive and metabolic manifestations that impacts on health across the lifespan[J].BMC Med,2010,8(1):41-50.
[2] Kelly C C,Lyall H,Petrie J R,et al.Low grade chronic inflammation in women with polycystic ovarian syndrome[J].J Clin Endocrinol Metab,2001,86(6):2453-2455.
[3] Grochot-Przeczek A,Dulak J,Jozkowicz A.Haem oxygenase-1:non-canonical roles in physiology and pathology[J].Clin Sci(Lond),2012,122(3):93-103.
[4] Lorenzo C,Hazuda H P,Haffner S M.Insulin resistance and excess risk of diabetes in Mexican-Americans:the San Antonio Heart Study[J].J Clin Endocrinol Metab,2012,97(3): 793-799.
[5] Moran L J,Misso M L,Wild R A,et al.Impaired glucose tolerance,type 2 diabetes and metabolic syndrome in polycystic ovary syndrome:a systematic review and meta-analysis[J].Hum Reprod Update,2010,16(4):347-363.
[6] Gao H,Meng J,Xu M,et al.Serum heat shock protein 70 concentration in relation to polycystic ovary syndrome in a nonobese chinese population[J].PLoS One,2013,8(6):e67727.
[7] Murri M,Luque-Ramirez M,Insenser M,et al.Circulating markers of oxidative stress and polycystic ovary syndrome(PCOS):a systematic review and meta-analysis[J].Hum Reprod Update,2013,19(3):268-288.
[8] Nicolai A,Li M,Kim D H,et al.Heme oxygenase-1 induction remodels adipose tissue and improves insulin sensitivity in obesity-induced diabetic rats[J].Hypertension,2009,53(3): 508-515.
[9] Gonzalez F,Rote N S,Minium J,et al.Reactive oxygen species-induced oxidative stress in the development of insulin resistance and hyperandrogenism in polycystic ovary syndrome[J].J Clin Endocrinol Metab,2006,91(1):336-340.
[10] Inoguchi T,Li P,Umeda F,et al.High glucose level and free fatty acid stimulate reactive oxygen species production through protein kinase C--dependent activation of NAD(P)H oxidase in cultured vascular cells[J].Diabetes,2000,49(11): 1939-1945.
[11] 孙晓菲,刘红.氧化应激激活信号转导通路与胰岛素抵抗[J].内科,2008,3(6):889-891.
[12] 李根霞,李巍巍.多囊卵巢综合征患者胰岛素抵抗和氧化应激的关系[J].郑州大学学报:医学版,2011,46(05):759-762.
[13] Bao W,Song F,Li X,et al.Plasma heme oxygenase-1 concentration is elevated in individuals with type 2 diabetes mellitus[J].PLoS One,2010,5(8):e12371.
[14] Sato T,Takeno M,Honma K,et al.Heme oxygenase-1,a potential biomarker of chronic silicosis,attenuates silica-induced lung injury[J].Am J Respir Crit Care Med,2006,174(8): 906-914.
[15] 李倩倩,李慧敏,钟继娟,等.2型糖尿病患者脂肪组织中的HO-1表达及临床意义[J].山东医药,2012,52(45):7-10.
[16] Yamada N,Yamaya M,Okinaga S,et al.Microsatellite polymorphism in the heme oxygenase-1 gene promoter is associated with susceptibility to emphysema[J].Am J Hum Genet,2000,66(1):187-195.
(2015-02-19 收稿)
Association of Heme Oxygenase-1 with the Risk of Polycystic Ovary Syndrome in Non-obese Women
Ding Hongbo1,Gao Hui2,Yan Peipei2et al
1School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China
2Department of Nutrition and Food Hygiene,School of Public Health,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective To examine whether heme oxygenase-1(HO-1)is involved in the etiology of polycystic ovary syndrome(PCOS).Methods After obtaining ethical approval and written informed consent,80 PCOS patients and 80 healthy controls(age range,21-38 years;BMI<30 kg/m2),matched for age and BMI,were analyzed for their clinical characteristics,hormone levels and glycolipid metabolism in peripheral blood.Besides,serum HO-1 was extracted and determined.Additionally,associations of HO-1 with the prevalence and risk of PCOS were also analyzed.Results As compared with the controls,women with PCOS were found to have a significantly increased insulin resistance,oxidative stress and inflammation status,eliciting a vicious circle of effects on the pathophysiology of PCOS.The receiver-operating characteristic curve(ROC)analysis yielded notably different discriminative value for PCOS,with or without an addition of HO-1[areas under the curves were 0.864(95%CI 0.808-0.919)vs.0.953(95%CI 0.923-0.982);P=0.000 5].Conclusion Serum HO-1 is possibly involved in the pathogenesis and development of PCOS,indicating that HO-1 can serve as an early biological marker of PCOS among young women.
heme oxygenase-1; polycystic ovary syndrome; insulin resistance; oxidative stress; inflammation
*国家十二五科研支撑项目资助(No.2012BAI02B02)
丁洪波,男,1967年生,医学博士,E-mail:dinghongbooo@aliyun.com
R711.75
10.3870/j.issn.1672-0741.2015.04.013

