miR-21对食管癌移植瘤模型的作用研究
刘 涛, 张 春, 杨晨晨, 刘 清, 戴 芳, 马 嵋, 郑树涛, 伊力亚尔·夏合丁,寿 玺, 李志强, 林仁勇, 卢晓梅,
(1新疆医科大学第一附属医院临床医学研究院, 乌鲁木齐 830054; 2新疆医科大学, 乌鲁木齐 830011;3新疆医科大学第一附属医院教学科, 乌鲁木齐 830054; 4新疆维吾尔自治区食管癌研究所, 乌鲁木齐 830054)

miR-21对食管癌移植瘤模型的作用研究
刘 涛1, 张 春1, 杨晨晨2, 刘 清1, 戴 芳1, 马 嵋3, 郑树涛1, 伊力亚尔·夏合丁4,寿 玺1, 李志强1, 林仁勇1, 卢晓梅1,4
(1新疆医科大学第一附属医院临床医学研究院, 乌鲁木齐 830054;2新疆医科大学, 乌鲁木齐 830011;3新疆医科大学第一附属医院教学科, 乌鲁木齐 830054;4新疆维吾尔自治区食管癌研究所, 乌鲁木齐 830054)
目的 探讨微小RNA-21(miR-21)对食管癌移植瘤模型肿瘤的作用。方法 建立裸鼠食管癌移植瘤模型,分别用miR-21(miR-21组)、miR-21 抑制剂(miR-21抑制剂组)和生理盐水进行治疗;应用免疫组化技术检测肿瘤组织中增殖细胞核抗原(Ki-67)、半胱氨酸天冬氨酸特异性蛋白酶(Caspase-3)、锌脂蛋白转录因子(Snail)蛋白的表达。 结果 成功建立食管癌裸鼠移植瘤模型,miR-21组和miR-21抑制剂组肿瘤大小差异有统计学意义(P<0.05),miR-21组Ki-67阳性表达率[(86.28±14.3)%]和Snail阳性表达率[(88.76±12.35)%]明显高于生理盐水组[(46.72±15.68)%和(72.35±8.36)%]及miR-21抑制剂组[(19.34±10.23)%和(35.26±10.28)%];而miR-21组和生理盐水组的Caspase-3阳性率[(35.27±16.12)%和(45.62±23.32)%]明显低于miR-21抑制剂组[(76.45±18.32)%]。结论miR-21与食管癌生长和转移相关,抑制miR-21可抑制移植瘤生长和转移,并且通过影响Ki-67、Caspase-3和Snail的表达发挥作用。提示miR-21可作为食管癌临床治疗候选靶基因。
裸鼠食管癌移植瘤模型; 微小RNA-21(miR-21); 增殖细胞核抗原(Ki-67); 半胱氨酸天冬氨酸特异性蛋白酶(Caspase-3); 锌脂蛋白转录因子(Snail)
食管癌(Esophageal cancer, EC)是世界范围内最常见的恶性肿瘤之一,在恶性肿瘤中其发病率位居第9位,死亡率位居第6位[1]。食管癌患者5年生存率仅为5%~10%,并且75%的病人在1 a内死亡。
miR-21位于染色体的脆性区域17q23.2,其在肝细胞肝癌、胃癌、卵巢癌、宫颈癌、头颈部肿瘤细胞株、乳头状甲状腺癌等一系列实体性恶性肿瘤中均出现上调,具有原癌基因的功能[2-7]。本课题组前期研究发现,在体外miR-21对食管癌Eca109细胞增殖具有促进作用,同时转染miR-21抑制剂后,细胞增殖明显受到抑制[8]。基于此研究结果,本研究拟研究miR-21对小鼠体内食管癌的生长及其转移的影响,探讨miR-21在食管癌肿瘤发生、发展中的作用机制。
1 材料和方法
1.1 材料食管鳞癌细胞株Eca109购自武汉大学细胞保藏中心,BALB/c雌性裸鼠,周龄4~6 w(购自北京维通利华实验动物技术有限公司),miR-21和miR-21 抑制剂由上海吉玛生物科技有限公司合成,Lipofectamine 2000 购自Invitrogen公司,兔抗人多克隆抗体增殖细胞核抗原(Ki-67)、半胱氨酸天冬氨酸特异性蛋白酶(Caspase-3)抗体购自北京博奥森生物科技有限公司,锌脂蛋白转录因子(Snail)抗体购自CST公司。
1.2 方法
1.2.1 动物模型建立 裸鼠准备: 4~6 w、体质量18~22 g的12只雌性BALB/c裸鼠饲养在恒定温度(25~27℃)、恒定湿度(40%~50%)的无特定病原体(SPF)层流室中, 所用饲料、饮用水和垫料均经高压灭菌处理, 并每隔3 d 更换1次,每天12 h明/12 h暗周期。体外培养食管癌细胞株Eca109,取对数生长期细胞用台盼蓝颜色计数活细胞在95%以上时调整细胞密度为1.5×106个/mL,收集并制备单细胞悬液,裸鼠背侧皮下注射细胞悬液200 μL(相当于每只裸鼠注射Eca109细胞3×105个)。
1.2.2 动物模型治疗 当移植瘤直径平均约为2 mm时,将裸鼠随机分为3组:生理盐水组(对照组)4只,miR-21组4只,miR-21抑制剂组4只。各组瘤内分别给予注射生理盐水100 μL、50 μg的miR-21 100 μL和3 μL Lipofectamine 2000及miR-21抑制剂100 μL和3 μL Lipofectamine 2000。每周2次,每次治疗时测量肿瘤大小[肿瘤体积(mm3)=长×宽2×0.5],并称量体质量。4 w后处死小鼠,收集各组肿瘤标本,待检测。
1.2.3 免疫组化染色 3组瘤块固定,包埋,切片,HE染色,间接法免疫组化检测Ki-67、Caspase-3和Snail的表达水平;由2位经验丰富的病理医师进行双盲阅片,采用半定量结果判断,分别对镜下每张切片上5个高倍视野(×200)下计数阳性细胞百分比。
1.3 统计学处理应用SPSS 13.0统计软件进行数据处理,两组以上标本采用单因素方差分析,以P<0.05为有差异统计学意义。
2 结果
2.1 各组人食管癌移植瘤生长抑制情况12只裸鼠种植人食管癌细胞株Eca109细胞后,移植瘤成功率为100%。miR-21组食管癌移植瘤体积平均为(2 214.41±393.62)mm3,miR-21 抑制剂组肿瘤体积为(908.67±666.24)mm3,生理盐水组肿瘤体积为(1 120. 28±524.54)mm3,miR-21组移植瘤体积明显大于miR-21抑制剂组移植瘤体积,差异具有统计学意义(P<0.05),与生理盐水组比较差异无统计学意义(P>0.05)(图1)。

图1 治疗后各组肿瘤大小
2.2 各组治疗后移植瘤的组织学观察HE染色结果显示,生理盐水组及miR-21组肿瘤异型性明显,细胞大小不一且不规则,miR-21抑制剂组可见大片细胞坏死( 图2)。



a:miR-21 组b: 生理盐水组c:miR-21抑制剂组
图2 不同治疗组HE染色结果(HE ×200)
2.3 各组瘤细胞增殖指数Ki-67和caspase-3的蛋白表达与生理盐水组比较,miR-21组Ki-67阳性表达率明显增加(P<0.05),miR-21 抑制剂组Ki-67阳性表达率显著减少,差异均具有统计学意义(P<0.05)(表1、图3)。与生理盐水组和miR-21组比较,miR-21 抑制剂组Caspase-3蛋白阳性表达率明显增加,差异均有统计学意义(P<0.05),miR-21组与生理盐水组Caspase-3阳性表达率差异无统计学意义(P>0.05)(表1、图4)。
2.4 各组锌指结合蛋白(Snail)的表达差异与生理盐水组相比,miR-21组Snail阳性表达率明显增高,差异具有统计学意义(P<0.05),而miR-21 抑制剂组中Snail阳性表达率明显减少,与生理盐水组和miR-21组比较,差异均有统计学意义(P<0.05)(表1、图5)。


组别Ki-67Caspase-3SnailmiR-21组86.28±14.3*35.27±16.1288.76±12.35*miR-21抑制剂组19.34±10.23*76.45±18.32*△35.26±10.28*△生理盐水组46.72±15.6845.62±23.3272.35±8.36
注:与生理盐水组比较,*P<0.05; 与miR-21组比较,△P<0.05。


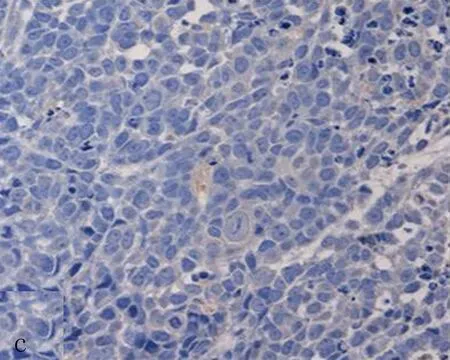
a:miR-21 组b: 生理盐水组c:miR-21抑制剂组
图3 不同治疗组细胞增殖指数Ki-67蛋白表达结果(×200)


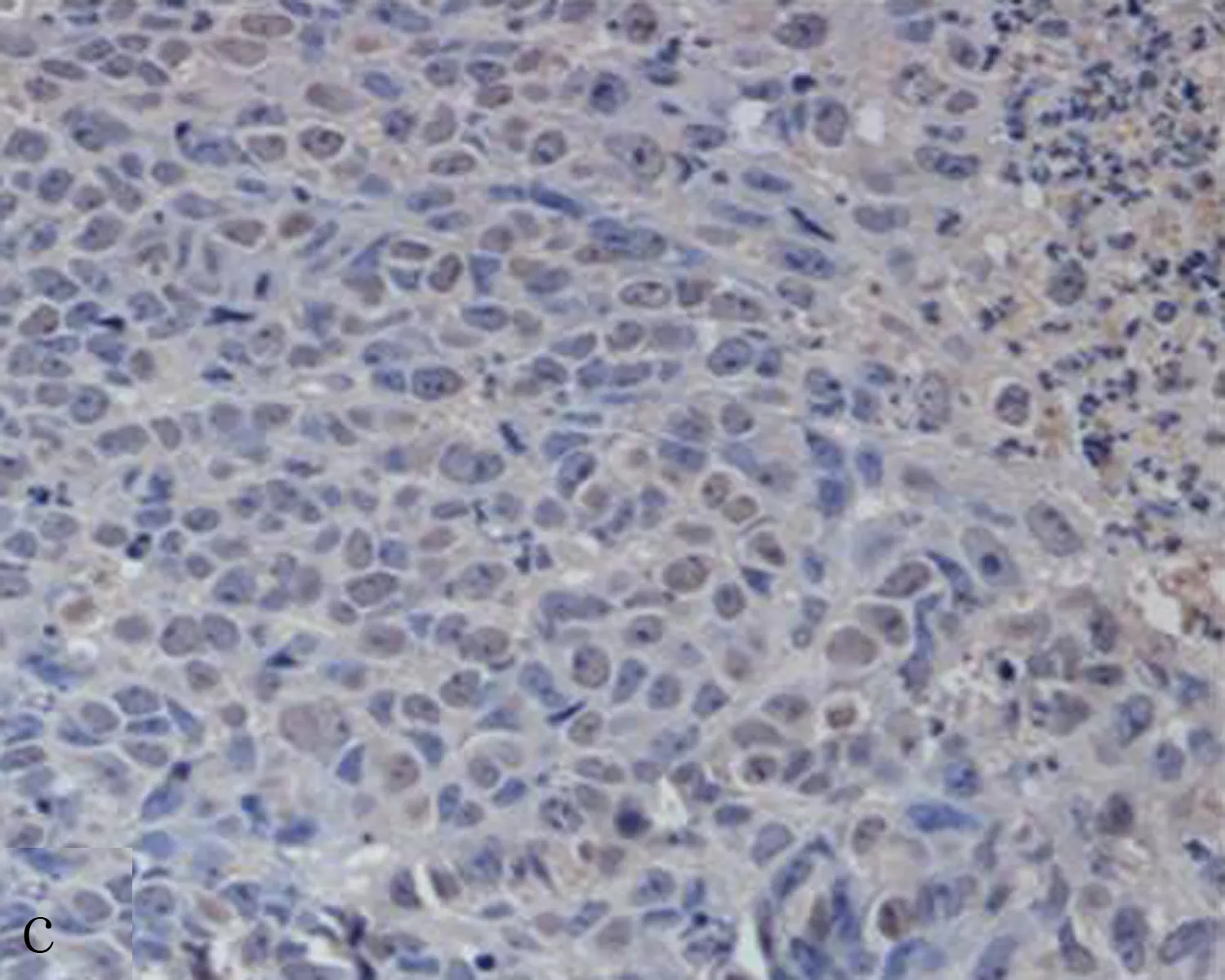
a: miR-21 组 b: 生理盐水组 c: miR-21抑制剂组
图4 不同治疗组Caspase-3蛋白表达结果(×200)



a: miR-21 组 b: 生理盐水组 c: miR-21抑制剂组
图5 不同治疗组snail蛋白表达结果(×200)
3 讨论
肿瘤的发生、发展及转移是一个多步骤、多因素参与的过程。除原癌基因激活、抑癌基因失活外, 尚有某些凋亡控制基因的异常表达促使细胞恶性转化,形成恶性肿瘤[9]。微小RNA是指长度为20~22个核苷酸的小分子非编码RNA分子,对真核细胞的基因表达、细胞发育分化和个体发育等多方面起调控作用。目前研究表明,微小RNA能够识别特定的目标mRNA,并在转录后水平通过负调控或正调控目标基因mRNA的表达,促进目标基因mRNA的降解和/或抑制翻译过程而发挥作用[10]。迄今为止,人类基因组可能存有1 000多种微小RNA 基因,目前已被证实的微小RNA 有700多种[11]。并且越来越多的证据显示微小RNA在肿瘤的发生、发展中起着重要的作用,某些特定微小RNA可作为一种癌基因或者抑癌基在肿瘤发生、发展中发挥作用[12]。
本课题组前期在体外细胞水平上发现miR-21可促进食管癌细胞株Eca109的增殖[8],在此基础上,本研究选用免疫缺陷型裸鼠为实验对象,皮下种植人食管癌细胞株Eca109,成瘤率为 100%。分别采用miR-21和miR-21 抑制剂进行治疗,4 w后处死小鼠,测量肿瘤大小,结果发现miR-21组瘤块明显大于miR-21抑制剂组,提示在体内miR-21可能促进肿瘤的生长。为进一步确认miR-21对瘤块中细胞增殖或凋亡的影响,本研究采用免疫组化方法检测瘤块中细胞增殖指数Ki-67和细胞凋亡基因Caspase-3蛋白的表达,发现miR-21组Ki-67的蛋白表达明显高于miR-21抑制剂组,而miR-21抑制剂组Caspase-3表达明显高于生理盐水组和miR-21组。提示在体内miR-21可能通过促进细胞增殖指数Ki-67的表达和抑制细胞凋亡基因Caspase-3的表达,影响肿瘤细胞的增殖或凋亡,从而导致肿瘤生长明显缓慢[13]。
Snail属于转录抑制子中的 Snail 超家族(Snail、Slug、Smuc),其能够促进细胞迁移,在EMT中发挥着重要的作用[14]。Snail通过直接抑制E-cadherin的表达及上调间质细胞标记分子Vimentin等的表达而促使上皮间质转化的发生,并促进肿瘤的侵袭和转移[15-16]。本研究发现,加入miR-21抑制剂后,Snail阳性表达率明显低于miR-21组和生理盐水组,miR-21可能通过影响Snail的表达促进食管癌上皮间质转化,从而促使食管癌发生转移。提示miR-21可作为食管癌临床治疗的靶基因,为食管癌的治疗提供一种新思路。
[1] Parkin DM, Bray F, Ferlay J, et al. Estimating the world cancer burden:Globocan 2000[J]. Int J Cancer, 2001, 94(2):153-156.
[2] Ladeiro Y, Couchy G, Balabaud C, et al. MicroRNA profiling in hepatocellular tumors is associated with clinical features and oncogene/tumor suppressor gene mutations[J]. Hepatology, 2008, 47(6):1955-1963.
[3] Cui L, Zhang X, Ye G, et al. Gastric juice MicroRNAs as potential biomarkers for the screening of gastric cancer[J]. Cancer, 2013, 119(9):1618-1626.
[4] Nam EJ, Yoon H, Kim SW, et al. MicroRNA expression profiles in serous ovarian carcinoma[J]. Clin Cancer Res, 2008, 14(9):2690-2695.
[5] Yao T, Lin Z. MiR-21 is involved in cervical squamous cell tumorigenesis and regulates CCL20[J]. Biochim Biophys Acta, 2012, 1822(2):248-260.
[6] Masood Y, Kqueen CY, Rajadurai P. Role of miRNA in head and neck squamous cell carcinoma[J]. Exp Rev Anticancer Ther, 2015, 15(2):183-197.
[7] Jazdzewski K, Boguslawska J, Jendrzejewski J, et al. Thyroid hormone receptor beta (THRB) is a major target gene for microRNAs deregulated in papillary thyroid carcinoma (PTC) [J]. J Clin Endocrinol Metab, 2011, 96(3):E546-553.
[8] Ma WJ, Lv GD, Tuersun A, et al. Role of microRNA-21 and effect on PTEN in Kazakh's esophageal squamous cell carcinoma[J]. Mol Biol Rep, 2011, 38(5):3253-3260.
[9] Wang Q, Yang C, Zhou J, et al. Cloning and characterization of full- length human ribosomal protein L15 cDNA which was overexpressed in esophageal cancer[J]. Gene, 2001, 263(1-2):205-209.
[10] Molnar V, Tamasi V, Bakos B, et al. Changes in miRNA expression in solid tumors:An miRNA profiling in melanomas[J]. Seminars Cancer Biol, 2008, 18(2):111-122.
[11] Osada HI, Takahash T. MicroRNAs in biological processes and carcinogenesis[J]. Carcinogenesis, 2007, 28(1):2-12.
[12] Maqbool R, Ul Hussain M. MicroRNAs and human diseases:diagnostic and therapeutic potential[J]. Cell Tissue Res,2014, 358(1):1-15.
[13] Li JS, Huang HZ, Sun LJ, et al. MiR-21 indicates poor prognosis in tongue squamous cell carcinomas as an apoptosis inhibitor[J]. Clin Cancer Res, 2009,15(12):3998-4008.
[14] Soinila J, Soinila S. Interaction of calcitonin gene-related peptide (CGRP), substance P (SP) and conventional autonomic agonists in rat subsmandibular salivary peroxidase release in vita[J]. Auton Neurosci, 2001, 86(3):163-169.
[15] Myung JK, Choi SA, Kim SK, et al. Snail plays an oncogenic role in glioblastoma by promoting epithelial mesenchymal transition[J]. Int J Clin Exp Pathol, 2014, 7(5):1977-1987.
[16] Wang J, Zhu X, Hu J, et al.. The positive feedback between Snail and DAB2IP regulates EMT, invasion and metastasis in colorectal cancer[J]. Oncotarget, 2015, 6(29):27427-27439.
(本文编辑 杨晨晨)
The role of miR-21 in xenografted nude mice of human esophageal cancer
LIU Tao1, ZHANG Chun1, YANG Chenchen2, LIU Qing1, DAI Fang3, MA Mei1, ZHENG Shutao1,ILYAR Sheyhidin4, SHOU Xi1, LI Zhiqiang1, LIN Renyong1, LU Xiaomei1,4
(1ClinicalMedicalResearchInstitute,theFirstAffliatedHospitalofXinjiangMedicalUniversity,Urumqi, 830054,China;2XinjiangMedicalUniversity,Urumqi830011,China;3EducationAdministrationOffice,theFirstAffliatedHospitalofXinjiangMedicalUniversity,Urumqi, 830054,China;4EsophagealCancerResearchInstituteofXinjiangUygurAutonomousRegion,Urumqi830054,China)
Objective To explore the role of microRNA-21 (miR-21) in carcinogenesis and metastasis in xenografted nude mice of human ESCC cell line Eca109. Methods Based on ESCC xenografted nude mice model, miR-21 mimics and AMO (Anti-miR-21 Oligonucleotides) were subcutaneously inoculated into xenografted tumor, respectively. The cell growth and morphological alteration were observed. Meanwhile, the expression level of Ki-67, cleaved Caspase-3 and Snail was detected using immunohistochemistry. Results ESCC xenografted nude mice model was successfully established. There is significant difference between the group inoculated with miR-21 mimics and group with AMO (P<0.05).ThepositiverateofKi-67(86.28%±14.3%)andSnail(88.76%±12.35%)wassignificantlyhigheringroupwithmiR-21mimicsthanthatingroupwithAMO(19.34%±10.23%;35.26%±10.28%)andsteriledsalinegroup(46.72%±15.68%;72.35%±8.36%),respectively.WhereasthepositivestainingofactiveCaspase-3ingroupwithmiR-21 (35.27%±16.12%)andsteriledsaline(45.62%±23.32%)weresignificantlylowerthanthatingroupinoculatedwithAMO(76.45%±18.32%) . Conclusion The present results suggested that miR-21 was associated with tumor growth and metastasis, and that miR-21 AMO can inhibit the growth of tumor by targeted the expression of Ki-67, Caspase-3 and Snail, which indicating that miR-21 could be used as potential therapeutic target in ESCC.
xenografted nude mice of esophageal cancer; miR-21; Ki-67; Caspase-3; Snail
国家自然科学基金(81160303,81260359、U1303321);新疆维吾尔自治区重大科技专项计划(201430123-1); 新疆重大疾病重点实验室开放课题(SKLIB-XJMDR-2014-15)
刘 涛(1984-),男,硕士,助理研究员,研究方向:消化道肿瘤。
卢晓梅,女,博士,教授,研究员,博士生导师,研究方向:消化道肿瘤的转化医学研究,E-mail:luxiaomei88@163.com。
专题研究 作者简介:卢晓梅, 教授,研究员,博士生导师。现任新疆维吾尔自治区免疫学会理事长、中国医药生物技术学会组织生物样本库分会常务委员、中华医学会医学科学研究管理学分会青年委员会委员、中华医学会医学伦理学分会青年委员会委员、中国遗传学会国际交流委员会委员、新疆医科大学第一附属医院伦理委员会副主任委员、科技部省部共建国家重点实验室培育基地-新疆维吾尔自治区重大疾病医学重点实验室学术委员会委员、中华医学科技奖评委会委员和国家自然科学基金项目评议人。担任 《世界华人消化杂志》、《疾病预防控制通报》编委;《Molecular Biology Reports》、《Cellular & Molecular Biology Letters》、《Cancers》、《Asia-Pacific Journal of Clinical Oncology》等期刊审稿人。
在中国科学院研究生院博士后流动站出站后,以客座教授、访问学者身份,先后赴美国、英国、法国、奥地利等国开展肿瘤合作研究。先后主持科研课题共15项,其中包括国家自然科学基金5项、中国博士后科学基金1项、新疆维吾尔自治区科技援疆计划1项、新疆维吾尔自治区高技术研究发展计划1项等。目前主持项目:国家自然科学基金3项“哈萨克族食管鳞癌恶性表型的微环境调控研究(U1303321)”,“哈萨克族食管鳞癌上皮间质转化调控及其分子病理学意义(81260359)”,“基于M2型丙酮酸激酶、膜联蛋白A2靶点的哈族食管鳞癌分子分型研究(81160303)”。新疆维吾尔自治区重大科技专项计划“上皮间质转化在炎症诱导食管癌胃癌发生发展中TGF-β关键信号通路和调控分子的研究 (201430123-1)”。
食管癌恶性表型与上皮间质转化(EMT)的关联性
R332;R
A
1009-5551(2015)12-1461-05
10.3969/j.issn.1009-5551.2015.12.001
2015-08-30]
作为主要贡献者,荣获新疆维吾尔自治区科学技术进步奖二等奖、新疆医学科技奖一等奖、新疆维吾尔自治区自然科学优秀论文二等奖等共12项。作为第一或通信作者,发表论文56篇,其中SCI收录25篇。被新疆维吾尔自治区人民政府授予第五届“新疆青年科技奖”以及“新疆医学会科技之星”称号。
2003年获得硕士生导师资格,培养硕士研究生16名,其中14名已经顺利毕业。2011年获得博士生导师资格,指导博士生4名。
癌细胞的浸润、转移是癌症患者的主要死亡原因。癌细胞的浸润、转移是复杂的过程,但并非所有的癌细胞都具有浸润、转移的能力,在具有高度选择性的过程中,除依赖于癌细胞的内在分子机制外,癌微环境的调控发挥重要作用。癌细胞与微环境相互作用,其形态结构和分化状态经历可调控的动态变化:上皮样癌细胞可转化为具有浸润、转移状态的间质样细胞,在合适的微环境中,间质样细胞也可反向分化为上皮样肿瘤细胞,形成转移灶,即肿瘤微环境的变化与上皮间质转化(EMT)在肿瘤的癌变、进展中密切相关。本专题探讨食管癌恶性表型与EMT的关联性,可为食管癌的恶性表型机制提供科学依据。

